1. ņä£ ļĪĀ
Ļ│Āņ▓┤ņé░ĒÖöļ¼╝ņŚ░ļŻīņĀäņ¦Ć (solid oxide fuel cell) ļŖö ĒöäļĪ£Ēåż ĻĄÉĒÖśļ¦ē ņŚ░ļŻīņĀäņ¦Ć (PEMFC), ņ¦üņĀæ ļ®öĒāäņś¼ĒśĢ ņŚ░ļŻīņĀäņ¦Ć (DMFC) ņÖĆ Ļ░ÖņØĆ ņĀĆņś©ĒśĢ ņŚ░ļŻīņĀäņ¦ĆņŚÉ ļ╣äĒĢ┤ ļåÆņØĆ ņŚÉļäłņ¦Ć ĒÜ©ņ£©, ņŚ░ļŻīņØś ļŗżņ¢æņä▒, Ļ░Æņŗ╝ ņ┤ēļ¦ż ņé¼ņÜ® Ļ░ĆļŖźĻ│╝ Ļ░ÖņØĆ ļ¦ÄņØĆ ņןņĀÉņØä Ļ░Ćņ¦äļŗż [1,2]. ĒŖ╣Ē׳ Ni ņØīĻĘ╣ņŚÉņä£ ņ¦üņĀæņĀüņØĖ ļ®öĒāä-ņłśņ”ØĻĖ░ Ļ░£ņ¦łņØ┤ Ļ░ĆļŖźĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ĒāäĒÖöņłśņåī Ļ│äņŚ┤ņØś ļŗżņ¢æĒĢ£ ņä▒ļČäņØ┤ ĒżĒĢ©ļÉ£ ņŚ░ļŻīļōżņØä ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŗż [3-5]. ņ▓£ņŚ░Ļ░ĆņŖż ļ░Å ļ░öņØ┤ņśż Ļ░ĆņŖżņÖĆ Ļ░ÖņØĆ ĒāäĒÖöņłśņåī Ļ│ä ņŚ░ļŻīļōżņØĆ ĒÖ®ĒÖöņłśņåī (H2S) ļČłņł£ļ¼╝ņØä ĒżĒĢ©ĒĢĀ ņłś ņ׳ņ£╝ļ®░, ņłś ppm ņłśņżĆņØś ĒÖ®ĒÖöņłśņåīņŚÉ ņØśĒĢ┤ Ni ņØīĻĘ╣ņŚÉņä£ ņŗ¼Ļ░üĒĢ£ ĒÖ® Ēö╝ļÅģ ņŚ┤ĒÖöĻ░Ć ņØ╝ņ¢┤ļéĀ ņłś ņ׳ļŗż [6,7]. ņĄ£ĻĘ╝ ļ¬ć ļģäĻ░ä Ni ņØīĻĘ╣ņØś ĒÖ® Ēö╝ļÅģ ĒśäņāüņŚÉ Ļ┤ĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć Ļ┤æļ▓öņ£äĒĢśĻ▓ī ņ¦äĒ¢ē ļÉśņŚłņ£╝ļ®░ [8-11], ļśÉĒĢ£ ĒÖ®ņŚÉ ļīĆĒĢ£ ļé┤ņä▒ņØ┤ Ļ░ĢĒĢĀ ļ┐É ņĢäļŗłļØ╝ ĒÖ®ĒÖöņłśņåīņØś ņŚ░ļŻīĒÖöĻ░Ć Ļ░ĆļŖźĒĢ£ ņāłļĪ£ņÜ┤ ņØīĻĘ╣ņ×¼ (ņĀäļÅäņä▒ ņé░ĒÖöļ¼╝ ļ░Å ĻĖłņåŹ ĒÖ®ĒÖöļ¼╝) Ļ░£ļ░£ņØ┤ ĒÖ£ļ░£Ē׳ ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā ņ׳ļŗż [12,13].
ĒÖ® Ēö╝ļÅģ ĒśäņāüņØĆ ĒÖ®ĒÖöņłśņåīņØś ļåŹļÅä, ņŚ░ļŻīņØ┤ņÜ®ļźĀ(ņĀäļźśļ░ĆļÅä), ņ×æļÅÖņś©ļÅäņÖĆ ņØīĻĘ╣ ĻĄ¼ņĪ░ ļō▒ ļŗżņ¢æĒĢ£ ņÜöņåīļōżņŚÉ ņØśĒĢ£ ņśüĒ¢źņØä ļ░øņØä ņłś ņ׳ļŗż [8]. ņĀĢņĀäļźś ņĪ░Ļ▒┤ņŚÉņä£ ņŗ£Ļ░äņŚÉ ļö░ļźĖ ņĀäņĢĢ Ļ░Éņåī ĒśäņāüņØĆ Ēü¼Ļ▓ī ļæÉ Ļ░Ćņ¦Ć ņśüņŚŁņ£╝ļĪ£ ĻĄ¼ļČäĒĢĀ ņłś ņ׳ļŖöļŹ░, ĻĖēĻ▓®ĒĢ£ ņ┤łĻĖ░ ņĀäņĢĢ Ļ░ĢĒĢśĒśäņāü (1st voltage drop) Ļ│╝ ĻĘĖ ĒøäņŚÉ ņØ┤ņ¢┤ņ¦ĆļŖö ņāüļīĆņĀüņ£╝ļĪ£ ļŖÉļ”░ ļæÉ ļ▓łņ¦Ė ņĀäņĢĢ Ļ░ĢĒĢś Ēśäņāü (2nd voltage drop) ņ£╝ļĪ£ ļéśļłī ņłś ņ׳ļŗż [14,15]. ņ┤łĻĖ░ ņĀäņĢĢ Ļ░ĢĒĢś ĒśäņāüņØĆ Ni ņ×ģņ×É Ēæ£ļ®┤ņŚÉņä£ ņØ┤ļŻ©ņ¢┤ņ¦ĆļŖö ĒÖ® ĒØĪņ░® ĒśäņāüĻ│╝ ņ¦üņĀæņĀüņØĖ Ļ┤ĆļĀ© ņ׳ņ£╝ļ®░, ņØ┤ļ¤¼ĒĢ£ ĒØĪņ░® ĒśäņāüņØĆ ņŗżņĀ£ļĪ£ ņĀäĻĖ░ĒÖöĒĢÖ ļ░śņØæņØ┤ ļ░£ņāØĒĢśļŖö ņłśņåī ņŚ░ļŻī, ņĀäĻĘ╣, ņĀäĒĢ┤ņ¦łņØ┤ ļ¦īļéśļŖö ņé╝ņāüĻ│äļ®┤ (three phase boundaries) Ļ░ÉņåīļĪ£ ņØ┤ņ¢┤ņĀĖ Ni ņØīĻĘ╣ņØś ļČäĻĘ╣ ņĀĆĒĢŁņØä ņ”ØĻ░Ć ņŗ£Ēé©ļŗż [8,16]. ņ┤łĻĖ░ ņĀäņĢĢ Ļ░ĢĒĢśĻ░Ć ņÖäļŻīļÉśļŖö ņŗ£Ļ░äņØĆ ņŚ░ļŻī ļé┤ ĒÖ®ĒÖöņłśņåī ļåŹļÅäņŚÉ ļö░ļØ╝ ļŗżļź┤ļ®░, ņØīĻĘ╣ ņ¦Ćņ¦ĆĒśĢ ņŚ░ļŻīņĀäņ¦ĆņØś Ļ▓ĮņÜ░ ĒÖ®ĒÖöņłśņåī 1 ppm ņĪ░Ļ▒┤ņŚÉņä£ļŖö 20 ņŗ£Ļ░ä ņØ┤ņāüņØĖ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ļ░ö ņ׳ļŗż [17-20]. ļ░śļ®┤ ņ¢ćņØĆ ņØīĻĘ╣ņĖĄņ£╝ļĪ£ ĻĄ¼ņä▒ļÉ£ ņĀäĒĢ┤ņ¦ł ņ¦Ćņ¦ĆĒśĢ ņģĆņØĆ ņāüļīĆņĀüņ£╝ļĪ£ ņ¦¦ņØĆ ņŗ£Ļ░ä ļé┤ņŚÉ 1ņ░© ņĀäņĢĢ Ļ░ĢĒĢśĻ░Ć ņÖäļŻī ļÉ£ļŗż [20]. ņ”ē, 1ņ░© ņĀäņĢĢ Ļ░ĢĒĢśņŚÉ ņåīņÜöļÉśļŖö ņŗ£Ļ░äņØĆ ĒÖ®ĒÖöņłśņåīņØś ļåŹļÅäļ┐É ņĢäļŗłļØ╝ ņØīĻĘ╣ņĖĄņØś ĻĄ¼ņĪ░ņÖĆ ļæÉĻ╗śņŚÉ Ēü¼Ļ▓ī ņØśņĪ┤ĒĢ©ņØä ņĢī ņłś ņ׳ļŗż. ĒÖ® ĒØĪņ░®ņŚÉ ņØśĒĢ┤ Ļ░ÉņåīĒĢ£ ņä▒ļŖźņØĆ ļČłņł£ļ¼╝ņØ┤ ĒżĒĢ©ļÉśņ¦Ć ņĢŖņØĆ ņłśņåī ņŚ░ļŻīļź╝ Ļ│ĄĻĖēĒĢśļ®┤ Ni ņ×ģņ×É Ēæ£ļ®┤ņŚÉ ĒØĪņ░®ļÉ£ ĒÖ®ņØ┤ Ēāłņ░®ļÉ©ņ£╝ļĪ£ņŹ© ļČĆļČäņĀüņ£╝ļĪ£ Ēś╣ņØĆ ņÖäņĀäĒ׳ ĒÜīļ│ĄĒĢĀ ņłś ņ׳ļŖöļŹ░, ĻĘĖ ĒÜīļ│Ąņ£©ņØĆ ņ×æļÅÖ ņĪ░Ļ▒┤ņŚÉ ļö░ļØ╝ ļŗżļź╝ ņłś ņ׳ļŗż [14,21,22]. 2ņ░© ņĀäņĢĢ Ļ░ĢĒĢśņ£©ņØĆ ņ×æļÅÖ ņĪ░Ļ▒┤ņŚÉ ļö░ļØ╝ ļ»Ėļ»ĖĒĢĀ ņłśļÅä ņ׳Ļ│Ā, ļ¦żņÜ░ Ēü┤ ņłśļÅä ņ׳ļŗż. ņןĻĖ░ņĀüņ£╝ļĪ£ ņ▓£ņ▓£Ē׳ ņØ┤ļŻ©ņ¢┤ņ¦ĆļŖö 2ņ░© ņĀäņĢĢ Ļ░ĢĒĢś ĒśäņāüņØĆ ņŚ░ļŻīņĀäņ¦Ć ņ×æļÅÖ ņĪ░Ļ▒┤ ļ░Å ĒÖśĻ▓ĮĻ│╝ ļ¦żņÜ░ ļ│Ąņ×ĪĒĢśĻ▓ī ņ¢ĮĒśĆ ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņØ┤ņŚÉ ļīĆĒĢ£ ĒĢ┤ņäØņØĆ ņŚ░ĻĄ¼ņ×ÉļōżņŚÉ ļö░ļØ╝ ļŗżņ¢æĒĢśļŗż. ĒŖ╣Ē׳, 2ņ░© ņĀäņĢĢ Ļ░ĢĒĢśļŖö ņĀäļźśļ░ĆļÅäņÖĆ ļ╣äļĪĆĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļéś [15,23], ņĀĆļåŹļÅäņØś ĒÖ®ĒÖöņłśņåī (~ 0.5 ppm) ņĪ░Ļ▒┤ņŚÉņä£ļŖö ņĀäļźśļ░ĆļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ Ēö╝ļÅģņ£©ņØĆ Ļ░ÉņåīĒĢ£ļŗżĻ│Ā ļ│┤Ļ│ĀļÉ£ļ░ö ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ [24,25], ņĀäļźśļ░ĆļÅä ĒÜ©Ļ│╝ļŖö ļåŹļÅä ņĪ░Ļ▒┤ņŚÉ ļö░ļØ╝ Ēü¼Ļ▓ī ļŗ¼ļØ╝ņ¦ł ņłś ņ׳ļŗż.
ļ│Ė ļģ╝ļ¼ĖņŚÉņä£ļŖö ņŚ░ļŻīņĀäņ¦Ć ņ×æļÅÖ ņĪ░Ļ▒┤Ļ│╝ ņØīĻĘ╣ ņ¦Ćņ¦ĆĒśĢ Ļ│Āņ▓┤ ņé░ĒÖöļ¼╝ ņŚ░ļŻīņĀäņ¦ĆņØś ĒÖ® Ēö╝ļÅģ ņŚ┤ĒÖöņ£© Ļ░äņØś ņāüĻ┤ĆĻ┤ĆĻ│äņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢśņśĆņ£╝ļ®░, ĒŖ╣Ē׳ ņĀäļźśļ░ĆļÅä ļ░Å ņŚ░ļŻī ļé┤ ņłśņ”ØĻĖ░ ļČäņĢĢņØä ņŗżĒŚś ļ│ĆņłśļĪ£ ĒĢśņŚ¼ ĒÖ® Ēö╝ļÅģ ņŚ┤ĒÖöļź╝ Ļ┤Ćņ░░ĒĢ©ņ£╝ļĪ£ņŹ© ĒÖ® Ēö╝ļÅģ ļ░®ņ¦Ćļź╝ ņ£äĒĢ£ ņ×æļÅÖ ņĪ░Ļ▒┤ņØä ļÅäņČ£ĒĢśĻ│Āņ×É ĒĢśņśĆļŗż. ļśÉĒĢ£ XRD (x-ray diffraction) ņÖĆ EDS (Energy dispersive xray spectroscopy)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņŗżĒŚś ņĀäĻ│╝ Ēøä ņØīĻĘ╣ ĻĖ░ļŖźņĖĄņØś ņāü ļ│ĆĒÖö ļ░Å ļ»ĖņäĖĻĄ¼ņĪ░ļź╝ ļČäņäØĒĢ©ņ£╝ļĪ£ņŹ© 2ņ░© ņĀäņĢĢ Ļ░ĢĒĢś Ēśäņāü ņøÉņØĖņØä ļČäņäØĒĢśĻ│Āņ×É ĒĢśņśĆļŗż.
2. ņŗżĒŚśļ░®ļ▓Ģ
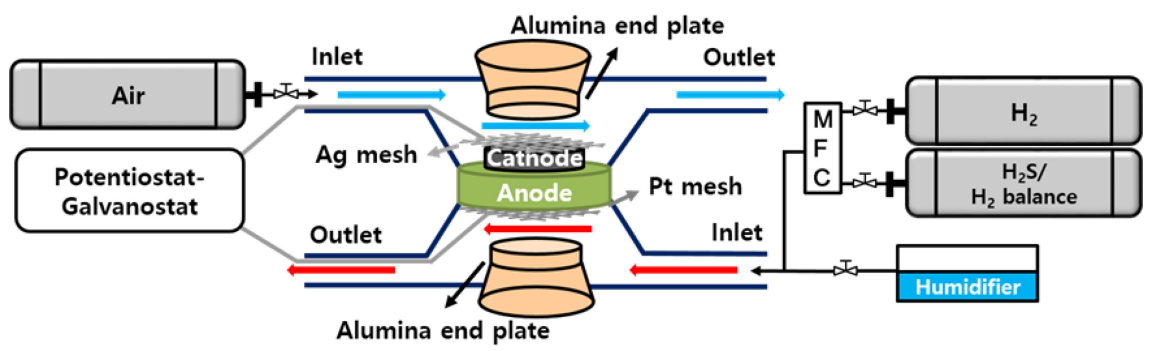
ĒÖ® Ēö╝ļÅģ ĒģīņŖżĒŖĖļź╝ ņ£äĒĢśņŚ¼ ņØīĻĘ╣ ņ¦Ćņ¦ĆĒśĢņØś Ļ│Āņ▓┤ ņé░ĒÖöļ¼╝ ņŚ░ļŻīņĀäņ¦Ćļź╝ ņĀ£ņĪ░ĒĢśņśĆļŗż. ņ┤Ø 6 ņĖĄņ£╝ļĪ£ ĻĄ¼ņä▒ļÉ£ ņØīĻĘ╣ ņ¦Ćņ¦ĆĒśĢ ņģĆņØś ĻĄ¼ņĪ░ņÖĆ ĻĄ¼ņä▒ ļ¼╝ņ¦łņØä ĻĘĖļ”╝ 1ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. ņĀ£ņĪ░ Ļ│ĄņĀĢņŚÉ ļīĆĒĢ£ ņ×ÉņäĖĒĢ£ ļé┤ņÜ®ņØĆ ņ░ĖĻ│Āļ¼ĖĒŚī [26]ņØä ĒåĄĒĢ┤ ĒÖĢņØĖ ĒĢĀ ņłś ņ׳ļŗż. ņØīĻĘ╣ ņ¦Ćņ¦ĆņĖĄĻ│╝ ĻĖ░ļŖźņĖĄņØĆ NiOĻ│╝ YSZ (yttria stabilized zirconia) ņØś Ēś╝ĒĢ®ļ¼╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņĀĖ ņ׳Ļ│Ā ĒģīņØ┤Ēöä ņ║ÉņŖżĒīģ Ļ│ĄņĀĢņØä ĒåĄĒĢ┤ ņĀ£ņ×æļÉśņŚłļŗż. YSZ ņĀäĒĢ┤ņ¦ł ņŖ¼ļ¤¼ļ”¼ ņĮöĒīģ Ēøä ņØīĻĘ╣Ļ│╝ ĒĢ©Ļ╗ś 1400 Ōäā ņŚÉņä£ 3 ņŗ£Ļ░äļÅÖņĢł ļÅÖņŗ£ ņåīĻ▓░ņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. ĻĄ¼ņä▒ ņĖĄ Ļ░ĆņÜ┤ļŹ░ Ļ░Ćņן ļæÉĻ║╝ņÜ┤ ņØīĻĘ╣ ņ¦Ćņ¦ĆņĖĄņØĆ ņģĆņØś ĻĖ░Ļ│äņĀü Ļ░ĢļÅäļź╝ ņ×ĪņĢäņŻ╝ļŖö ņŚŁĒĢĀņØä ĒĢśļŖö ļ░śļ®┤, ņØīĻĘ╣ ĻĖ░ļŖźņĖĄņØĆ ņłśņåī ņŚ░ļŻīņØś ņé░ĒÖö ļ░śņØæņØ┤ ļ░£ņāØĒĢśļŖö ņŗżņĀ£ ņØīĻĘ╣ ņŚŁĒĢĀņØä ĒĢ£ļŗż. ņĀäĒĢ┤ņ¦łĻ│╝ ņ¢æĻĘ╣ ņé¼ņØ┤ņŚÉ GDC (Gd doped Ceria) buffer layer ņĖĄņØä ļÅäņ×ģĒĢśņŚ¼ ņĀäĒĢ┤ņ¦łĻ│╝ ņ¢æĻĘ╣ ņé¼ņØ┤ņØś ļ░śņØæņØä ļ░®ņ¦ĆĒĢśņśĆļŗż. GDC ņĖĄ ņ£äņŚÉļŖö LSCF (La-Sr-Co-Fe oxide)ņÖĆ GDCņØś ļ│ĄĒĢ®ņĖĄņ£╝ļĪ£ ĻĄ¼ņä▒ļÉ£ ņ¢æĻĘ╣ ĻĖ░ļŖźņĖĄĻ│╝ LSCF ņ¢æĻĘ╣ ņ¦æņĀäņĖĄņØä ņ░©ļĪĆļīĆļĪ£ ņĮöĒīģĒĢśņŚ¼ 1000 ŌäāņŚÉņä£ ņŚ┤ņ▓śļ”¼ ĒĢśņśĆļŗż. ņ¢æĻĘ╣ ĻĖ░ļŖźņĖĄņØĆ ņŗżņĀ£ ņé░ņåīņØś ĒÖśņøÉ ļ░śņØæņØ┤ ņØ╝ņ¢┤ļéśļŖö ĻĄ¼ņä▒ ņÜöņåīļØ╝ ĒĢĀ ņłś ņ׳ņ£╝ļ®░, ņ¢æĻĘ╣ ņ¦æņĀäņĖĄņØĆ ļåÆņØĆ ņĀäņ×É ņĀäļÅäņä▒ņØä ņ¦ĆļŗłĻ│Ā ņ׳ņ¢┤ ņØīĻĘ╣ņŚÉņä£ ļ░£ņāØĒĢ£ ņĀäņ×Éļź╝ ņ¢æĻĘ╣ ĻĖ░ļŖźņĖĄņŚÉ ĒÜ©ņ£©ņĀüņ£╝ļĪ£ ņĀäļŗ¼ĒĢśļŖö ņŚŁĒĢĀņØä ĒĢ£ļŗż.
ĒÖ® Ēö╝ļÅģ ņŚ┤ĒÖö ĒģīņŖżĒŖĖļź╝ ņ£äĒĢ┤ ļŗżņØīĻ│╝ Ļ░ÖņØĆ ĻĄ¼ņä▒ ņÜöņåīļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦ä test fixtureļź╝ ņ×Éņ▓┤ ņĀ£ņ×æĒĢśņśĆļŗż: 1) cathode and anode end plates (alumina ņåīņ×¼, Ļ░üĻ░ü 9Ļ░£ņØś Ļ░ĆņŖż ņ▒äļäÉļĪ£ ĻĄ¼ņä▒); 2) cathode current collector (Ag mesh) ļ░Å anode current collector (Pt mesh); 3) ceramic sealant (Aremco, Cerama Bond 571). ņłśņåī ņŚ░ļŻī ļ░Å Ļ│ĄĻĖ░ņØś ņ£Āļ¤ēņØĆ MFC (mass flow controller) ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ Ļ░üĻ░ü 300 ļ░Å 800 cc/min ļĪ£ Ļ│ĀņĀĢĒĢśņśĆņ£╝ļ®░, 700 Ōäā ņś©ļÅäņŚÉņä£ ņĀäĻĖ░ĒÖöĒĢÖ ĒģīņŖżĒŖĖ ļ░Å ĒÖ® Ēö╝ļÅģ ņŚ┤ĒÖö ņŗżĒŚśņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. ņ┤łĻĖ░ NiO ĒÖśņøÉ Ļ│╝ņĀĢņŚÉņä£ļŖö 10% ņłśņåī (ņ¦łņåī balance) Ēś╝ĒĢ® Ļ░ĆņŖżļź╝ Ļ│ĄĻĖēĒĢśņśĆņ£╝ļ®░ ĻĘĖ Ēøä Ļ│Āņł£ļÅä (99.999%) ņłśņåīļź╝ Ļ│ĄĻĖēĒĢśņŚ¼ ņĀäņĢĢņØ┤ 1.1 V ņØ┤ņāü ņĢłņĀĢļÉśņŚłņØä ļĢī ņ┤łĻĖ░ ņä▒ļŖź (impedance ļ░Å power density) ļ░Å ņןĻĖ░ ņĀĢņĀäļźś ĒģīņŖżĒŖĖļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ņØś ļ¬©ļōĀ ņĀäĻĖ░ĒÖöĒĢÖĒģīņŖżĒŖĖļŖö Bio-Logic, SP-240 (galvanostat/potentiostat with impedance analyzer) ņןļ╣äļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņŗżņŗ£ĒĢśņśĆļŗż. Ļ░ĆņŖż Ļ│ĄĻĖē ļ░Å ņĀäĻĖ░ĒÖöĒĢÖ ĒģīņŖżĒŖĖņŚÉ ļīĆĒĢ£ ĻĄ¼ņä▒ļÅäļź╝ ĻĘĖļ”╝ 2 ņŚÉ ļéśĒāĆļé┤ņŚłļŗż.
ĒÖ® Ēö╝ļÅģ ņŚ┤ĒÖöņŚÉ ļīĆĒĢ£ ņĀäļźś ļ░ĆļÅäņØś ņśüĒ¢źņØä ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ 100 ppm ĒÖ®ĒÖöņłśņåīĻ░Ć ĒżĒĢ©ļÉ£ ņłśņåī ņŚ░ļŻīļź╝ Ļ│ĄĻĖēĒĢśņŚ¼ ļŗżņ¢æĒĢ£ ņĀäļźśļ░ĆļÅä (357 ~ 714 mA/cm2) ņŚÉņä£ ņĀäņĢĢ Ļ░ĢĒĢśņ£©,
V ĒÖ® Ēö╝ ļÅģ Ēøä - V ņ┤ł ĻĖ░ V ņ┤ł ĻĖ░ ├Ś 100 [ % ]
3. Ļ▓░Ļ│╝ ļ░Å Ļ│Āņ░░
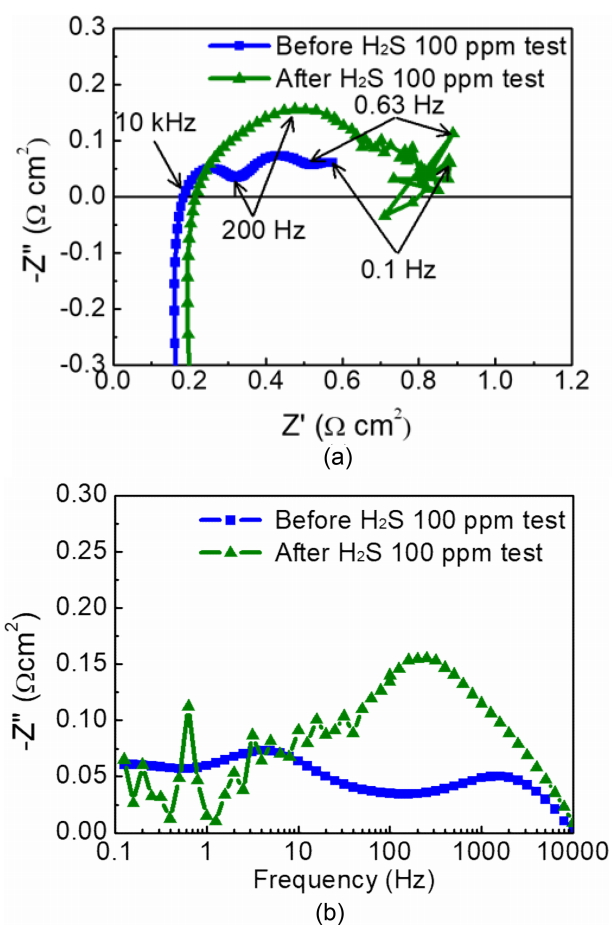
ņĀĢņĀäļźś ĒģīņŖżĒŖĖņŚÉ ņĢ× ņä£ impedance ņĖĪņĀĢņØä ņŗżņŗ£ĒĢśņśĆņ£╝ļ®░, ļČäņäØ Ļ▓░Ļ│╝ 100 ppm ĒÖ®ĒÖöņłśņåīĻ░Ć ĒżĒĢ©ļÉ£ ņłśņåī ņŚ░ļŻī Ļ│ĄĻĖē ņĀäĻ│╝ Ēøä ņĀĆĒĢŁņØś ņ░©ņØ┤ļŖö Ļ▒░ņØś ņŚåļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż (ĻĘĖļ”╝ 3(a)). Impedance Ēøä ņĖĪņĀĢ ĒĢ£ power density Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 3(b) ņŚÉ ļéśĒāĆļé┤ņŚłļŖöļŹ░, Ļ│Āņł£ļÅä (99.999%) ņłśņåī ļ░Å 100 ppm ĒÖ®ĒÖöņłśņåīĻ░Ć ĒżĒĢ©ļÉ£ ņłśņåī ņŚ░ļŻī Ļ│ĄĻĖē ņŗ£ Ļ░üĻ░ü peak power density Ļ░Ć ~ 0.933 ļ░Å ~ 0.901 W/cm2 ļĪ£ ĻĖ░ļĪØļÉśņ¢┤, ņ┤łĻĖ░ ĒŖ╣ņä▒ļ¦īņØä Ļ│ĀļĀżĒĢ£ļŗżļ®┤ ĒÖ®ĒÖöņłśņåīņŚÉ ņØśĒĢ£ ņä▒ļŖź Ļ░ÉņåīļŖö ļ»Ėļ»ĖĒĢśļŗżļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ņ┤łĻĖ░ ņä▒ļŖź ĒÅēĻ░Ć ņÖäļŻī Ēøä ĻĘĖļ”╝ 4(a) Ļ│╝ Ļ░ÖņØ┤ 100 ppm ĒÖ®ĒÖöņłśņåīĻ░Ć ĒżĒĢ©ļÉ£ ņłśņåī ņŚ░ļŻī ņĪ░Ļ▒┤ņŚÉņä£ ņĀĢņĀäļźś ĒģīņŖżĒŖĖ ((1) 714 mA/cm2, (2) 389 mA/cm2, (3) 357 mA/cm2) ļź╝ ļŗ©Ļ│äņĀüņ£╝ļĪ£ ņŗżņŗ£ĒĢśņśĆļŗż. ĻĘĖļ”╝ 4(b) ļŖö ĻĘĖļ”╝ 4(a) ņØś ņ┤łĻĖ░ ĻĄ¼Ļ░äņØä ĒÖĢļīĆĒĢ£ Ļ▓āņ£╝ļĪ£ņä£ 1ņ░© ņĀäņĢĢ Ļ░ĢĒĢśĻ░Ć ļ¦łļ¼┤ļ”¼ļÉśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņØ╝ņĀĢ ņŗ£Ļ░ä (ņĄ£ņåī 30ļČä ņØ┤ņāü) ņØ┤ ņåīņÜöļÉśļŖö Ļ▓āņØä ļ│╝ ņłś ņ׳ļŗż. ņ░ĖĻ│Ā ļ¼ĖĒŚīņŚÉ ņØśĒĢśļ®┤ ĒÖ®ĒÖöņłśņåīņØś ļåŹļÅäĻ░Ć ļé«ņØäņłśļĪØ ļŹö ņśżļ×£ ņŗ£Ļ░äņØ┤ ņåīņÜöļÉśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż [8,17,23]. Ļ│Āņł£ļÅä (99.999%) ņłśņåī ņŚ░ļŻīņŚÉņä£ ĒÖ®ĒÖöņłśņåīĻ░Ć ĒżĒĢ©ļÉ£ ņłśņåī ņŚ░ļŻīļĪ£ ņĀäĒÖśĒĢ£ ļÆż 10 ļČäņØś purging ņŗ£Ļ░äņØä Ļ░Ćņ¦ä Ēøä impedance ņÖĆ power density ņØś ņĖĪņĀĢņØä ņŗżņŗ£ĒĢśņśĆļŗż (ĻĘĖļ”╝ 3). ĒĢśņ¦Ćļ¦ī ņĢ×ņä£ ņ¢ĖĻĖēĒĢśņśĆļō»ņØ┤ 1ņ░© ņĀäņĢĢ Ļ░ĢĒĢś ņåīņÜö ņŗ£Ļ░äņØĆ 30ļČä ņØ┤ņāüņØ┤ļ»ĆļĪ£ ĻĘĖļ”╝ 3 ņĖĪņĀĢ ņŗ£ņĀÉņŚÉņä£ļŖö Ni ņ×ģņ×É Ēæ£ļ®┤ņŚÉ ĒÖ® ĒØĪņ░®ņØĆ Ļ▒░ņØś ņØ╝ņ¢┤ļéśņ¦Ć ņĢŖņĢśļŹś Ļ▓āņ£╝ļĪ£ ņČöņĖĪļÉ£ļŗż. ļö░ļØ╝ņä£ ĒÖ®ĒÖöņłśņåī ĒØĪņ░®ņŚÉ ņØśĒĢ£ ņä▒ļŖź Ļ░Éņåīļź╝ ņĀĢĒÖĢĒ׳ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņČ®ļČäĒĢ£ ĒØĪņ░® ņŗ£Ļ░äņØä ņåīņÜöĒĢ£ ļÆż impedance ņÖĆ power density ņÖĆ Ļ░ÖņØĆ ņä▒ļŖź ĒģīņŖżĒŖĖļź╝ ņŗżņŗ£ĒĢśļŖö Ļ▓āņØ┤ ļ░öļ×īņ¦üĒĢśļŗżĻ│Ā ĒĢĀ ņłś ņ׳ļŗż.
ņĀäļźś ļ░ĆļÅäņØś ņśüĒ¢źņØä ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ ĻĘĖļ”╝ 4(a) ņÖĆ Ļ░ÖņØ┤ 100 ppm ĒÖ®ĒÖöņłśņåīĻ░Ć ĒżĒĢ©ļÉ£ ņłśņåī ņŚ░ļŻī ņĪ░Ļ▒┤ņŚÉņä£ ņĀäļźś Ļ░ÆņØä ļŗ©Ļ│äņĀüņ£╝ļĪ£ ļé«ņČ░Ļ░Ćļ®░ ĒģīņŖżĒŖĖļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż. ņāüļīĆņĀüņ£╝ļĪ£ Ļ│ĀņĀäļźśļ░ĆļÅäņØĖ ~ 714mA/cm2 ņØś Ļ▓ĮņÜ░ 30 ļČä ļÅÖņĢł 0.806ņŚÉņä£ 0.679 VļĪ£ ļ¦żņÜ░ Ēü░ 1ņ░© ņĀäņĢĢ Ļ░ĢĒĢśĻ░Ć ņØ╝ņ¢┤ļé¼ņ£╝ļ®░ ļÆżņØ┤ņ¢┤ 0.638 VļĪ£ Ļ░ÉņåīĒĢśļ®░ 2ņ░© ņĀäņĢĢ Ļ░ĢĒĢśĻ░Ć ņØ╝ņ¢┤ļé¼ļŗż. 2ņ░© ņĀäņĢĢ Ļ░ĢĒĢśļŖö ņĢĮ 2 ņŗ£Ļ░äņØś Ļ│ĀņĀäļźśļ░ĆļÅä ĒģīņŖżĒŖĖ ĻĄ¼Ļ░ä (1)ņŚÉņä£ļŖö ņĢłņĀĢļÉśņ¦Ć ņĢŖļŖö ņ¢æņāüņØä ļéśĒāĆļé┤ņŚłļŗż. ņāüļīĆņĀüņ£╝ļĪ£ ļé«ņØĆ ņĀäļźś ļ░ĆļÅä (~ 389 mA/cm2)ņØś Ļ▓ĮņÜ░ ņĀäņĢĢ Ļ░ĢĒĢś ĒśäņāüņØĆ ļŗżņåī ņÖäĒÖö ļÉśņŚłņ£╝ļéś, 9 ņŗ£Ļ░ä ļÅÖņĢł 0.813 V ņŚÉņä£ 0.780 VļĪ£ Ļ░ÉņåīĒĢśļ®░ ļŖÉļ”¼ņ¦Ćļ¦ī ņŚ¼ņĀäĒ׳ ņĀäņĢĢ Ļ░ĢĒĢś ĒśäņāüņØĆ ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ņØīņØ┤ ĒÖĢņØĖļÉśņŚłļŗż. ĻĘĖ Ēøä Ļ│Āņł£ļÅä (99.999%) ņłśņåī ņŚ░ļŻī ņĪ░Ļ▒┤ņ£╝ļĪ£ ņĀäĒÖśĒĢśņŚ¼ ~ 357mA/cm2 ņĪ░Ļ▒┤ņŚÉņä£ ĒÜīļ│Ą ļŗ©Ļ│äļź╝ ņŗżņŗ£ĒĢśņśĆļŗż. Ļ│Āņł£ļÅä (99.999%) ņłśņåīļź╝ ņØ┤ņÜ®ĒĢ£ ĒÜīļ│Ą ļŗ©Ļ│äļŖö Ni ņ×ģņ×É Ēæ£ļ®┤ņŚÉ ĒØĪņ░®ļÉ£ ĒÖ®ņØä Ēāłņ░®ņŗ£ĒéżļŖö Ļ│╝ņĀĢņØ┤ļØ╝ ĒĢĀ ņłś ņ׳ļŗż. ĒÜīļ│Ą ĻĄ¼Ļ░äņŚÉņä£ļŖö ņĀäņĢĢ ļ¢©ļ”╝ ĒśäņāüņØĆ ņ׳ņ£╝ļéś ĒÖ®ĒÖö ņłśņåīņĪ░Ļ▒┤ņŚÉņä£ Ļ┤Ćņ░░ļÉśņŚłļŹś ņĀäņĢĢ Ļ░ĢĒĢś ĒśäņāüņØĆ ļéśĒāĆļéśņ¦Ć ņĢŖņĢśļŗż. ņĀĢņĀäļźś ĒģīņŖżĒŖĖ ņ┤łĻĖ░ ~ 714 mA/cm2 ņĪ░Ļ▒┤ņŚÉņä£ 0.8 V ņĀäņĢĢņØä ļéśĒāĆļāłņ¦Ćļ¦ī, ņŗżĒŚś ņóģļŻī ņ¦üņĀä (ĒÜīļ│Ą ļŗ©Ļ│äļź╝ Ļ▒░ņ╣£ Ēøä) ņŚÉļŖö 357 mA/cm2 ņĪ░Ļ▒┤ņŚÉņä£ 0.8 V ņĀäņĢĢņØä ļéśĒāĆļāłņ£╝ļ»ĆļĪ£ Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ ņä▒ļŖź ĒÜīļ│ĄņØĆ ļ»Ėļ»ĖĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż. ņĀĢņĀäļźś ĒģīņŖżĒŖĖ ņóģļŻī ĒøäņŚÉļŖö ņä▒ļŖź Ļ░ÉņåīņØś ņøÉņØĖ ļČäņäØņØä ņ£äĒĢ┤ņä£ impedance ļČäņäØņØä ņŗżņŗ£ĒĢśņśĆņ£╝ļ®░, ĻĘĖ Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 5(a) ņÖĆ ĻĘĖļ”╝ 5(b)ņŚÉ Ļ░üĻ░ü Nyquist plot Ļ│╝ Bode plot ņ£╝ļĪ£ ļéśĒāĆļé┤ņŚłļŗż. ĒģīņŖżĒŖĖ Ēøä Ļ│ĀņŻ╝Ēīī ņśüņŚŁ (200 ~ 1000 Hz) ņØś non-ohmic ņä▒ļČäņØś ņĀĆĒĢŁņØ┤ ļæÉļō£ļ¤¼ņ¦ĆĻ▓ī ņ”ØĻ░ĆĒĢ£ Ļ▓āņØä ļ│╝ ņłś ņ׳ļŖöļŹ░, ĒĢ┤ļŗ╣ ņŻ╝Ēīīņłś ņśüņŚŁņØĆ anode charge transfer resistance (ņĀäĒĢśņØ┤ļÅÖņĀĆĒĢŁ) ņÖĆ ļ░ĆņĀæĒĢ£ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż [27]. ņØīĻĘ╣ņŚÉņä£ņØś non-ohmic resistance (ļ╣äņś┤ņä▒ ņĀĆĒĢŁ) ņ”ØĻ░Ć ņøÉņØĖņØĆ Ēü¼Ļ▓ī ļæÉ Ļ░Ćņ¦ĆļĪ£ ļéśļłäņ¢┤ņä£ ņāØĻ░üĒĢĀ ņłś ņ׳ļŗż. ņä£ļĪĀņŚÉņä£ ņ¢ĖĻĖēĒĢśņśĆļō»ņØ┤ ĒÖ® Ēö╝ļÅģņŚÉ ņØśĒĢ£ ņĀäņĢĢ Ļ░ĢĒĢśļŖö ņ¦¦ņØĆ ņŗ£Ļ░äņŚÉ ņØ┤ļŻ©ņ¢┤ņ¦ĆļŖö 1ņ░© ļŗ©Ļ│ä (ĒÖ® ĒØĪņ░®Ļ│╝ Ļ┤ĆļĀ©) ņÖĆ ņāüļīĆņĀüņ£╝ļĪ£ ļŖÉļ”░ 2ņ░© ļŗ©Ļ│äļĪ£ ļéśļłäņ¢┤ņ¦ĆļŖöļŹ░, Ļ│ĀņĀäļźśļ░ĆļÅä (714 mA/cm2) ņĪ░Ļ▒┤ņŚÉņä£ļŖö 1ņ░©, 2ņ░© ņĀäņĢĢ Ļ░ĢĒĢś ļ¬©ļæÉ ņØ╝ņ¢┤ļé£ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż (ĻĘĖļ”╝ 4(a)). ĒØĪņ░® Ēśäņāü (1ņ░© ņĀäņĢĢ Ļ░ĢĒĢś ļŗ©Ļ│ä) ņØä ļäśņ¢┤ņä£ ņśüĻĄ¼ņĀüņØĖ ļ│ĆĒÖö (2ņ░© ņĀäņĢĢ Ļ░ĢĒĢś ļŗ©Ļ│ä) Ļ░Ć ļ░£ņāØĒĢśņśĆĻĖ░ ļĢīļ¼ĖņŚÉ Ļ│Āņł£ļÅä (99.999%) ņłśņåīļź╝ ņØ┤ņÜ®ĒĢ£ ņä▒ļŖź ĒÜīļ│ĄņØĆ Ļ▒░ņØś ņØ╝ņ¢┤ļéśņ¦Ć ņĢŖņØĆ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.
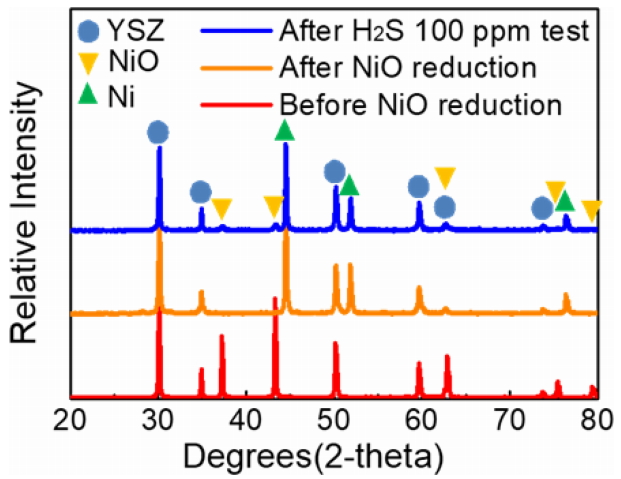
2ņ░© ņĀäņĢĢ Ļ░ĢĒĢśņØś ņøÉņØĖ ļČäņäØņØä ņ£äĒĢ┤ ņāłļĪ£ņÜ┤ ņģĆņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļÅÖņØ╝ĒĢ£ ņĪ░Ļ▒┤ (~ 714 mA/cm2)ņŚÉņä£ ļŗżņŗ£ ĒĢ£ ļ▓ł ĒÖ® Ēö╝ļÅģ ĒģīņŖżĒŖĖļź╝ ņŗżņŗ£ĒĢśņśĆļŗż. ĒÖ® Ēö╝ļÅģ ĒģīņŖżĒŖĖ ļÅÖņĢł ļ░£ņāØĒĢ£ ņØīĻĘ╣ ļ│ĆĒÖöļź╝ ļ│┤ņĪ┤ĒĢśĻĖ░ ņ£äĒĢ┤ ĒÜīļ│Ą Ļ│╝ņĀĢņØä Ļ▒░ņ╣śņ¦Ć ņĢŖĻ│Ā ņĀĢņĀäļźś ĒģīņŖżĒŖĖ Ēøä Ļ│¦ ļ░öļĪ£ Ar Ļ░ĆņŖżļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļāēĻ░üņŗ£ņ╝░ļŗż. ņØīĻĘ╣ ĻĖ░ļŖźņĖĄ XRD ļČäņäØņØä ņŗżņŗ£ĒĢśņŚ¼ 2ņ░© ņĀäņĢĢ Ļ░ĢĒĢś ņøÉņØĖņØä ĻĘ£ļ¬ģĒĢśĻ│Āņ×É ĒĢśņśĆņ£╝ļ®░, ĻĘĖ Ļ▓░Ļ│╝ļź╝ NiO ĒÖśņøÉ ņĀäĻ│╝ ĒøäņŚÉ ņĖĪņĀĢĒĢ£ ņØīĻĘ╣ ĻĖ░ļŖźņĖĄņØś XRD pattern Ļ│╝ ļ╣äĻĄÉĒĢśņśĆļŗż (ĻĘĖļ”╝ 6). ņØīĻĘ╣ ĻĖ░ļŖźņĖĄ ĒÖśņøÉ ĒøäņŚÉļŖö NiO ņŚÉ ĒĢ┤ļŗ╣ļÉśļŖö peak ļŖö ņé¼ļØ╝ņĪīņ£╝ļéś, ĒÖ®ĒÖöņłśņåī ĒģīņŖżĒŖĖ ĒøäņŚÉļŖö ļŗżņŗ£ NiO peak Ļ░Ć Ļ▓ĆņČ£ļÉ£ Ļ▓āņØä ļ│╝ ņłś ņ׳ļŗż. ņ”ē, ĻĘĖļ”╝ 4 ĒģīņŖżĒŖĖļź╝ ņ¦äĒ¢ēĒĢśļŖö ļÅÖņĢł Ni ņ×ģņ×ÉĻ░Ć ļŗżņŗ£ ņé░ĒÖöļÉśņŚłņØīņØä ņĢī ņłś ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ Ni ņ×ģņ×É ņé░ĒÖöĒśäņāüņØä ņóĆ ļŹö ņ×ÉņäĖĒ׳ ņĢīņĢäļ│┤Ļ│Āņ×É ĻĘĖļ”╝ 7 Ļ│╝ Ļ░ÖņØ┤ Ni, Zr, O ņøÉņåī ļ│äļĪ£ EDS mappingņØä ņŗżņŗ£ĒĢśņśĆļŗż. Zr ņśüņŚŁ (blue) ņŚÉļ¦ī ņĪ┤ņ×¼ĒĢ┤ņĢ╝ ĒĢśļŖö O ņØś ņśüņŚŁ (red) ņØ┤ Ni ņśüņŚŁ (green)ņØś Ļ░Ćņן ņ×Éļ”¼ņŚÉņä£ ņØ╝ļČĆ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░, ņØ┤ļŖö Ni ņ×ģņ×É Ēæ£ļ®┤ņŚÉņä£ ļČĆļČäņĀüņ£╝ļĪ£ ņé░ĒÖöĻ░Ć ņ¦äĒ¢ēļÉśņŚłņØīņØä ņØśļ»ĖĒĢ£ļŗż. NiO ĒśĢņä▒ ļ®öņ╗żļŗłņ”śņØĆ ļŗżņØīĻ│╝ Ļ░ÖņØ┤ ņäżļ¬ģ ļÉĀ ņłś ņ׳ļŗż. Ļ│ĀļåŹļÅä (~ 100 ppm) ĒÖ®ĒÖöņłśņåīņŚÉ ņØśĒĢ£ ļåÆņØĆ ĒÖ® ĒØĪņ░®ļźĀļĪ£ ņØĖĒĢ┤ ņ¢æĻĘ╣-ņĀäĒĢ┤ņ¦łļĪ£ļČĆĒä░ Ļ│ĄĻĖēļÉśļŖö ņé░ņåīņØ┤ņś©Ļ│╝ ņłśņåīņŚ░ļŻīĻ░Ć ļ░śņØæĒĢĀ ņłś ņ׳ļŖö ļ®┤ņĀü (ņé╝ņāüĻ│äļ®┤) ņØ┤ Ļ░ÉņåīĒĢśĻ▓ī ļÉśĻ│Ā [28], Ļ▓░ĻĄŁ ņłśņåī ļīĆņŗĀ Ni ņØ┤ ņé░ņåīņØ┤ņś©Ļ│╝ ļ░śņØæĒĢśņŚ¼ Ni ņé░ĒÖöļ¼╝ņØä ĒśĢņä▒ĒĢ£ Ļ▓āņ£╝ļĪ£ ņØ┤ĒĢ┤ĒĢĀ ņłś ņ׳ļŗż. ņĀäļźśļ░ĆļÅäĻ░Ć ļåÆņØäņłśļĪØ Ni ņé░ĒÖöļ¼╝ ĒśĢņä▒ņØ┤ ļŹöņÜ▒ ņ┤ēņ¦ä ļÉĀ Ļ▓āņØ┤ļ®░ ņØ┤ļŖö Ļ│¦ 2ņ░© ņĀäņĢĢ Ļ░ĢĒĢśņ£© ņ”ØĻ░ĆļĪ£ ņØ┤ņ¢┤ņ¦äļŗżĻ│Ā ĒĢĀ ņłś ņ׳ļŗż. Ļ│ĀļåŹļÅä (~ 100 ppm) ņØś ĒÖ®ĒÖöņłśņåīĻ░Ć ĒżĒĢ©ļÉ£ ņłśņåī ņŚ░ļŻī ļ░Å Ļ│ĀņĀäļźśļ░ĆļÅä (~ 714 mA/cm2)ņÖĆ Ļ░ÖņØĆ ņÜ┤ņĀä ņĪ░Ļ▒┤ņØĆ ĒØĪņ░® ĒśäņāüņØä ļäśņ¢┤ņä£ ņśüĻĄ¼ņĀüņØĖ ņŚ┤ĒÖö (Ni ņé░ĒÖö)ļź╝ ņØ╝ņ£╝Ēé¼ ņłś ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņŚ░ļŻīņĀäņ¦Ć ņןĻĖ░ ņĢłņĀĢņä▒ ļ®┤ņŚÉņä£ ņĀüĒĢ®ĒĢśņ¦Ć ņĢŖļŗżĻ│Ā ĒĢĀ ņłś ņ׳ļŗż. Ļ│ĀļåŹļÅä ĒÖ®ĒÖöņłśņåī ļ░Å Ļ│ĀļåŹļÅä ņ×æļÅÖ ņĪ░Ļ▒┤ņŚÉņä£ļÅä ņןĻĖ░ ļé┤ĻĄ¼ņä▒ņØä ĒÖĢļ│┤ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ĒÖ® ĒØĪņ░® ļ░®ņ¦Ćļź╝ ņ£äĒĢ£ ļ│äļÅäņØś ņ┤ēļ¦żļź╝ ņé¼ņÜ®ĒĢśĻ▒░ļéś ĒÖ®ĒÖöņłśņåīņØś ļåŹļÅäļź╝ 100 ppm ņØ┤ĒĢśļĪ£ Ļ░Éņåīņŗ£Ēé¼ ņłś ņ׳ļŖö Ļ░ĢĒÖöļÉ£ ņĀäņ▓śļ”¼ Ļ│ĄņĀĢ ĻĖ░ņłĀņØä ĒÖĢļ│┤ĒĢ┤ņĢ╝ ĒĢĀ Ļ▓āņØ┤ļŗż.
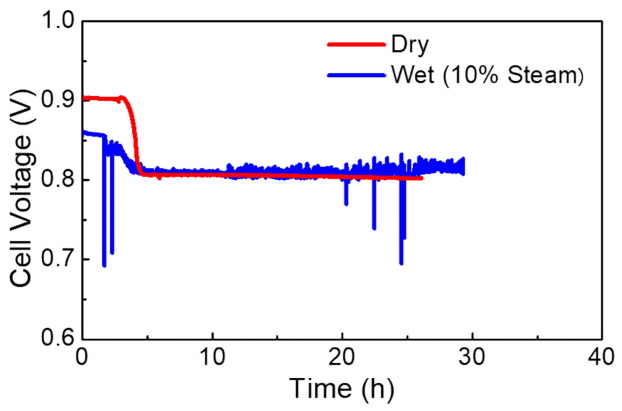
ņŚ░ļŻī Ļ░ĆņŖĄņŚÉ ņØśĒĢ£ ĒÖ® ĒØĪņ░® ļ░®ņ¦Ć (Ēāłņ░®) ĒÜ©Ļ│╝ļź╝ ĒÖĢņØĖĒĢśĻ│Āņ×É 10 ppm ĒÖ®ĒÖöņłśņåīĻ░Ć ĒżĒĢ©ļÉ£ ņłśņåī ņŚ░ļŻī (dry) ņÖĆ 10 ppm ĒÖ®ĒÖöņłśņåīĻ░Ć ĒżĒĢ©ļÉ£ 10% Ļ░ĆņŖĄļÉ£ ņłśņåī ņŚ░ļŻī (wet) ņĪ░Ļ▒┤ņŚÉņä£ Ļ░üĻ░ü ņĀĢņĀäļźś (500 mA/cm2) ĒģīņŖżĒŖĖļź╝ ņŗżņŗ£ĒĢśņśĆļŗż. 2ņ░© ņĀäņĢĢ Ļ░ĢĒĢśļź╝ ļ░®ņ¦ĆĒĢśĻ│Āņ×É ņāüļīĆņĀüņ£╝ļĪ£ ļé«ņØĆ ĒÖ®ĒÖöņłśņåī ļåŹļÅäņÖĆ ņĀäļźśļ░ĆļÅä ņĪ░Ļ▒┤ņŚÉņä£ ņŗżĒŚśņØä ņ¦äĒ¢ēĒĢśņśĆņ£╝ļ®░, ĻĘĖļ”╝ 8 ņŚÉ dryņÖĆ wet ņĪ░Ļ▒┤ņŚÉņä£ņØś ĒÖ® Ēö╝ļÅģņŚÉ ņØśĒĢ£ ņĀäņĢĢ ļ│ĆĒÖöļź╝ ļ╣äĻĄÉĒĢśņśĆļŗż. ņ┤łĻĖ░ ņĀäņĢĢ Ļ░ĢĒĢś ĻĄ¼Ļ░äņŚÉņä£ļŖö dry ņĪ░Ļ▒┤ņØś Ļ▓ĮņÜ░ 0.903 VņŚÉņä£ 0.807 VļĪ£ ļ│ĆĒÖöĒĢ£ ļ░śļ®┤ (0.096 V Ļ░Éņåī), wet ņĪ░Ļ▒┤ņØś Ļ▓ĮņÜ░ 0.835 VņŚÉņä£ 0.812 VļĪ£ ļ│ĆĒÖöĒĢśņśĆļŗż (0.023 V Ļ░Éņåī). ņØ┤ļ¤¼ĒĢ£ ņÖäĒÖö ĒÜ©Ļ│╝ļŖö ņłśņ”ØĻĖ░ļź╝ ņČöĻ░ĆņĀüņ£╝ļĪ£ Ļ│ĄĻĖēĒĢ©ņ£╝ļĪ£ņŹ© Ni ņ×ģņ×É Ēæ£ļ®┤ņŚÉ ĒØĪņ░®ļÉśņ¢┤ ņ׳ļŖö ĒÖ®ņØä ņØ┤ņé░ĒÖö ĒÖ® ĒśĢĒā£ļĪ£ ņé░ĒÖöĒĢśņŚ¼ ĒÖ® Ēāłņ░®ņØä ņ£ĀļÅäĒĢ£ Ļ▓░Ļ│╝ļĪ£ ļ│╝ ņłś ņ׳ļŗż. ņłśņ”ØĻĖ░ņŚÉ ņØśĒĢ£ ĒØĪņ░® ļ░®ņ¦Ć (Ēāłņ░®) ļ®öņ╗żļŗłņ”śņØĆ ļŗżņØīĻ│╝ Ļ░ÖņØĆ ļ░śņØæņŗØņ£╝ļĪ£ ņäżļ¬ģļÉĀ ņłś ņ׳ļŗż: (SNi+ 2H2OŌåÆ SO2+ 2H2). dry ņÖĆ wet ņĪ░Ļ▒┤ņŚÉņä£ ņ┤łĻĖ░ ņĀäņĢĢ Ļ░ÆņØś ņ░©ņØ┤ļź╝ ļ│┤ņśĆļŖöļŹ░, ņØ┤ļŖö ņłśņ”ØĻĖ░ Ļ│ĄĻĖēņ£╝ļĪ£ ļ░£ņāØĒĢ£ Nernst loss ņŚÉ ņØśĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż [1]. ļ│Ė ņŗżĒŚśņŚÉņä£ļŖö ņÖäĒÖöļÉ£ ņŗżĒŚś ņĪ░Ļ▒┤ņ£╝ļĪ£ ņØĖĒĢ┤ 2ņ░© ņĀäņĢĢ Ļ░ĢĒĢś ĒśäņāüņØĆ ļ»Ėļ»ĖĒĢśņśĆņ¦Ćļ¦ī, Ļ│ĀļåŹļÅä (~ 100 ppm) ņØś ĒÖ®ĒÖöņłśņåīĻ░Ć ĒżĒĢ©ļÉ£ ņłśņåī ņŚ░ļŻī ļ░Å Ļ│ĀņĀäļźśļ░ĆļÅä (~ 714 mA/cm2) ņŚÉņä£ļŖö 2ņ░© ņĀäņĢĢ Ļ░ĢĒĢś ĒśäņāüņØ┤ ņ¦Ćļ░░ņĀüņ£╝ļĪ£ ņ×æņÜ®ĒĢĀ Ļ▓āņØ┤ļ»ĆļĪ£ [15,23,24,29], ņłśņ”ØĻĖ░ Ļ│ĄĻĖēņŚÉ ņØśĒĢ£ ņŚ┤ĒÖö ļ░®ņ¦Ć ĒÜ©Ļ│╝ļŖö ņĢĮĒÖöļÉĀ Ļ▓āņ£╝ļĪ£ ņśłņāüļÉ£ļŗż. ļö░ļØ╝ņä£ ņłśņ”ØĻĖ░ Ļ│ĄĻĖē ĒÖ® Ēāłņ░® ĒÜ©Ļ│╝ļŖö 2ņ░© ņĀäņĢĢ Ļ░ĢĒĢś ĒśäņāüņØ┤ ļéśĒāĆļéśņ¦Ć ņĢŖļŖö ņĀĆļåŹļÅä ĒÖ®ĒÖöņłśņåī ļ░Å ņĀĆņĀäļźśļ░ĆļÅä ņÜ┤ņĀä ņĪ░Ļ▒┤ņŚÉņä£ļ¦ī ņ£ĀĒÜ©ĒĢĀ Ļ▓āņ×äņØä ņĢī ņłś ņ׳ļŗż.
4. Ļ▓░ ļĪĀ
ĒÖ® Ēö╝ļÅģ ņŚ┤ĒÖöņ£©Ļ│╝ ņŚ░ļŻīņĀäņ¦Ć ņ×æļÅÖ ņĪ░Ļ▒┤ Ļ░äņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ ņĀäļźśļ░ĆļÅäņÖĆ ņŚ░ļŻī Ļ░ĆņŖĄļÅäļź╝ ļ│ĆņłśļĪ£ ĒĢśņŚ¼ ĒģīņŖżĒŖĖļź╝ ņŗżņŗ£ĒĢśņśĆļŗż. 100 ppm ĒÖ®ĒÖöņłśņåīĻ░Ć ĒżĒĢ©ļÉ£ ņłśņåī ņŚ░ļŻīļź╝ ņŻ╝ņ×ģĒĢ£ ņ¦üĒøäņØś ņä▒ļŖź Ļ░ÉņåīļŖö ļ¦żņÜ░ ļ»Ėļ»ĖĒĢśņśĆņ£╝ļéś, ņןĻĖ░ ņĀĢņĀäļźś (~ 714 mA/cm2) ĒģīņŖżĒŖĖļź╝ ņ¦äĒ¢ēĒĢ©ņŚÉ ļö░ļØ╝ Ēü░ ĒÅŁņØś ņĀäņĢĢĻ░ĢĒĢś (- 0.127 V) Ļ░Ć ņØ╝ņ¢┤ļé¼ņ£╝ļ®░ ļÆż ņØ┤ņ¢┤ 2ņ░© ņĀäņĢĢ Ļ░ĢĒĢś (- 0.041 V) Ļ░Ć ņāüļīĆņĀüņ£╝ļĪ£ ļŖÉļ”░ ņåŹļÅäļĪ£ ņØ┤ļŻ©ņ¢┤ņĪīļŗż. ļ░śļ®┤ ņĀäļźś ļ░ĆļÅäļź╝ ~ 389mA/cm2 ņłśņżĆņ£╝ļĪ£ Ļ░ÉņåīĒĢśņśĆņØä ļĢīļŖö ņĀäņĢĢ Ļ░ĢĒĢśņ£©ņØĆ Ēü¼Ļ▓ī ņÖäĒÖöļÉśņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļź╝ ĒåĄĒĢ┤ ĒÖ® Ēö╝ļÅģ ņŚ┤ĒÖöņ£©ņØĆ ņĀĆļåŹļÅä ņĪ░Ļ▒┤Ļ│╝ļŖö ļŗ¼ļ”¼ Ļ│ĀļåŹļÅä (~ 100 ppm)ņØś ĒÖ®ĒÖöņłśņåī ņĪ░Ļ▒┤ņŚÉņä£ļŖö ņĀäļźśļ░ĆļÅäņŚÉ ļ╣äļĪĆĒĢ©ņØä ĒÖĢņØĖ ĒĢĀ ņłś ņ׳ņŚłĻ│Ā, ņŚ┤ĒÖöņ£©Ļ│╝ ņĀäļźśļ░ĆļÅäĻ░äņØś ļ╣äļĪĆ/ļ░śļ╣äļĪĆ Ļ┤ĆĻ│äļŖö ĒÖ®ĒÖöņłśņåī ļåŹļÅäņŚÉ ļö░ļØ╝ ļŗ¼ļØ╝ ņ¦ł ņłś ņ׳ņØīņØä ņĢī ņłś ņ׳ņŚłļŗż. ļśÉĒĢ£ Ļ│Āņł£ļÅä (99.999%) ņłśņåī ņŚ░ļŻīļź╝ ņØ┤ņÜ®ĒĢ£ ņä▒ļŖź ĒÜīļ│ĄņØĆ ļ»Ėļ»ĖĒĢśņśĆĻĖ░ņŚÉ ņśüĻĄ¼ņĀüņØĖ ņä▒ļŖź ņŚ┤ĒÖöĻ░Ć ņØīĻĘ╣ņŚÉņä£ ņ¦äĒ¢ēļÉśņŚłņØīņØä ņĢī ņłś ņ׳ņŚłļŗż. ĒģīņŖżĒŖĖ Ēøä XRD ļČäņäØņØä ĒåĄĒĢ┤ Ni ņØīĻĘ╣ņØś ņé░ĒÖö (NiO)ļź╝ ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░ ņØ┤ļŖö ĒÖ® ĒØĪņ░®ņŚÉ ņØśĒĢ┤ ņé╝ņāüĻ│äļ®┤ņØ┤ Ļ░ÉņåīĒĢ©ņ£╝ļĪ£ņŹ© ĒśĢņä▒ļÉ£ Ni ņ×ģņ×ÉņÖĆ ņé░ņåīņØ┤ņś© Ļ░äņØś ļ░śņØæļ¼╝ļĪ£ ņŚ¼Ļ▓©ņ¦äļŗż. ņØ┤ņÖĆ Ļ░ÖņØ┤ Ļ│ĀļåŹļÅä (~ 100 ppm) ņØś ĒÖ®ĒÖöņłśņåīĻ░Ć ĒżĒĢ©ļÉ£ ņłśņåī ņŚ░ļŻī ļ░Å Ļ│ĀņĀäļźśļ░ĆļÅä (~ 714 mA/cm2) ņĪ░Ļ▒┤ņØĆ ĒØĪņ░® ĒśäņāüņØä ļäśņ¢┤ņä£ ņśüĻĄ¼ņĀüņØĖ ņŚ┤ĒÖö (Ni ņé░ĒÖö)ļź╝ ļ░£ņāØņŗ£Ēé¼ ņłś ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņŚ░ļŻīņĀäņ¦Ć ņןĻĖ░ ņĢłņĀĢņä▒ ļ®┤ņŚÉņä£ ņĀüĒĢ®ĒĢśņ¦Ć ņĢŖļŗżĻ│Ā ĒĢĀ ņłś ņ׳ļŗż. ņŚ░ļŻī Ļ░ĆņŖĄ ĒÜ©Ļ│╝ļź╝ ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ 10 ppm ĒÖ®ĒÖöņłśņåīĻ░Ć ĒżĒĢ©ļÉ£ 10% wet ņłśņåī ņŚ░ļŻīļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĀĢņĀäļźś (500 mA/cm2) ĒģīņŖżĒŖĖļź╝ ņŗżņŗ£ĒĢśņśĆļŗż. ņłśņ”ØĻĖ░ļź╝ ņČöĻ░ĆņĀüņ£╝ļĪ£ Ļ│ĄĻĖēĒĢ©ņ£╝ļĪ£ņŹ© ņØ┤ņé░ĒÖö ĒÖ® ĒśĢĒā£ļĪ£ņØś Ēāłņ░® ĒśäņāüņØ┤ ņ┤ēņ¦äļÉ©ņ£╝ļĪ£ņŹ© 1ņ░© ņĀäņĢĢ Ļ░ĢĒĢśņ£©ņØ┤ Ļ░ÉņåīĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ ņłśņ”ØĻĖ░ Ļ│ĄĻĖē ĒÜ©Ļ│╝ļŖö 2ņ░© ņĀäņĢĢ Ļ░ĢĒĢśĒśäņāüņØ┤ ņ¢ĄņĀ£ļÉĀ ņłś ņ׳ļŖö ņĀĆļåŹļÅä (< 100 ppm) ņØś ĒÖ®ĒÖöņłśņåīĻ░Ć ĒżĒĢ©ļÉ£ ņłśņåī ņŚ░ļŻīņÖĆ ņĀĆņĀäļźśļ░ĆļÅä (< 714 mA/cm2) ņĪ░Ļ▒┤ņŚÉņä£ ņ£ĀĒÜ©ĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ļ│Ė ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ņä£ ņĀäļźśļ░ĆļÅä ļ░Å Ļ░ĆņŖĄļÅäņÖĆ Ļ░ÖņØĆ ĻĄ¼ņ▓┤ņĀüņØĖ ņÜ┤ņĀäņĪ░Ļ▒┤ņØ┤ ņ▓£ņŚ░ Ļ░ĆņŖż ļ░Å ļ░öņØ┤ņśż Ļ░ĆņŖżļź╝ ņŚ░ļŻīļĪ£ ņé¼ņÜ®ĒĢśļŖö ņŚ░ļŻīņĀäņ¦ĆņØś ņןĻĖ░ ņłśļ¬ģņØä Ļ▓░ņĀĢņ¦ōļŖö ņżæņÜöĒĢ£ ņØĖņ×Éņ×äņØä ĒÖĢņØĖ ĒĢĀ ņłś ņ׳ņŚłļŗż.