AbstractElectrodialysis was used to develop a highly efficient process for concentrating and recovering Li from the Li-containing waste solution that is generated after recovering Co and Ni from a leach solution of waste cathode materials of Li ion batteries. The optimum conditions were investigated by comparing the concentration of Li in the concentrated solution, water recovery rate, energy consumption and average flow rate. Limiting current density was also checked. The results showed that the concentration ratio of Li was enhanced up to 133.33% at an applied voltage of 10 V and volume ratio(VD/VC) of 4/1. In order to investigate the concentration ratio of Li based on large volume ratio, the total volume of the Li-containing solution was fixed, and the volume ratio of the dilute solution to the concentrate solution was adjusted to 1/1 to 10/1. The concentration ratio of lithium was increased in the initial stage and then decreased due to the osmotic phenomenon. Finally, an the analysis of the experimental results, including concentration ratio, average flux, and energy consumption, determined that the volume ratio(VD/VC) of 3/1 at 10 V of applied voltage was most efficient and the concentrate ratio of Li increased up to 160.61%.
1. 서 론리튬은 전기자동차, 스마트폰, 노트북 등의 이차전지 또는 에너지저장장치(Energy Storage System, ESS) 등에 핵심부품으로 쓰이는 자원으로 리튬이온배터리에 대한 연구가 활발하게 진행되고 있으며 전기자동차 시장 성장에 따른 리튬이온배터리의 수요 증가 및 공급부족 등으로 인해 2015년 이후 가격이 3.5배 이상 급등하였다 [1,2]. 우리나라는 리튬 부존량이 거의 없기 때문에 전량 수입에 의존하고 있는 실정이며, 세계적으로 수요대비 공급이 부족해지면 국내 산업에 큰 타격을 주게 된다. 따라서 국내 안정적인 수급 방법이 절실한 실정이다.
금속리튬은 광석보다 염수에 약 2배 더 많이 존재한다. 따라서 염수에서의 리튬 회수에 대한 연구가 활발히 진행되고 있으나 염수 내 Mg2+, Ca2+과 같은 불순물이 많아 정제공정이 요구되고, 리튬의 농도가 낮아 많은 양의 염수를 농축해야하기 때문에 에너지 소비량이 높고 장시간의 공정이 소요되어 가격 경쟁력 또한 낮은 편이다 [3-9]. 또한 산업에서 리튬이 사용될 때 주로 탄산리튬이 원료가 되며 용액 내 리튬을 탄산리튬으로 회수하기 위해선 농도가 일정 수준 이상이어야 한다 [10]. 따라서 염수보다 리튬의 함유량이 높고 불순물이 적은 리튬이온배터리 유가금속 추출 후 여액, 즉 리튬함유 원료용액을 사용하여 리튬을 효과적으로 재 자원화 할 수 있는 기술을 개발하고자 하였다.
일반적으로 염수 등 리튬함유 용액에서 리튬을 회수하는 공정으로는 증발농축법이 상용화되어 있으나 고에너지 공정이면서 회수율이 낮다는 단점이 있다. 최근에 개발된 용매추출법의 경우는 리튬의 농도가 1.0 g/L 이상에서 효과적이고, 추출제 사용에 의한 공정비용 증가와 유기상의 사용으로 환경오염 문제가 발생된다 [11-15]. 전기투석(electrodialysis)법은 전기장 내에서 이온교환막을 통해 이온을 선택적으로 통과시켜 목표성분의 농축 및 불순물 분리에 주로 쓰이는 공정으로 운전 도중에 부산물이 거의 발생하지 않고 추가적으로 재사용을 위한 화학적 처리를 하지 않아도 되는 환경 친화적 공정이다. 또한 전기에너지 외의 추가적인 에너지 변환이 요구되지 않기 때문에 에너지 효율 측면에서도 장점을 가지고 있어 미래지향적인 기술로 각광받고 있다. 따라서 본 연구에서는 전기투석법에 의한 리튬의 농축에 대한 기초 연구를 진행하였다.
2. 이론적 배경전기투석은 양극과 음극 사이의 전위차에 의하여 양이온은 음극으로 음이온은 양극으로 이동하게 되고 두 전극 사이에 양이온 교환막 또는 음이온 교환막을 설치하면 이온이 선택적으로 이동되어 이온의 농축과 분리 효과를 얻을 수 있다. 전기투석 공정에 의한 리튬의 농축에 대한 모식도를 그림 1에 나타내었다. 전기투석 공정 시 고려해야 할 점이 두 가지 있다. 그 중 하나는 한계전류밀도(limiting current density)로 전압을 연속적으로 증가시킬 때 전류값 또한 증가하다가 더 이상 증가하지 않는 구간이 발생하는 현상을 말하며, 이온교환막 계면과 용액 사이의 농도분극에 의해 나타난다. 한계전류 이상의 전류가 인가되면 물(H2O)이 분해되어 알칼리 용액이 되어 불순물인 Mg2+, Ca2+가 수산화물을 형성하고 침전물로서 석출되어 막을 오염시킬 수 있다. 또 하나는 막을 통한 물의 이동현상으로, 희석실에서 농축실로 물이 이동하여 농축율을 감소시키는 현상이다.
물이 이동하는 주요 원인으로 이온 농도차에 의한 삼투압 현상과 수화된 이온이 전위구배 하에 이동시 물도 함께 이동되는 전해삼투(electro-osmosis) 현상이 있다 [16,17]. 이러한 두 현상 모두 연구 및 산업현장에서 주요한 변수로써 공정 전 한계전류밀도를 미리 확인해두어야 하고, 공정 중 물 이동현상을 최소화 하는 것을 고려하여야 한다.
일반적으로 전기투석을 이용하여 염을 농축시키는 방법으로는 High Volume Ratio Concentration(HVRC)와 Multistage Concentration(MSC)을 통해 이루어진다. HVRC 방식은 농축실과 희석실의 부피비를 조절하여 원하는 성분을 농축하는 방식으로, 희석실에서 농축실로 염이 연속적으로 이동하여 농축하게 된다. MSC 방식은 2단 이상의 전기투석을 통해 고농도의 농축용액을 얻는 공정이다. 일반적으로 HVRC 방식에서 농축에 적합한 최적조건을 확립한 후 MSC 방식으로 고농도의 용액을 얻게 된다 [17]. 따라서 본 연구에서는 1차적으로 HVRC 방식을 이용하여 리튬함유 원료용액으로부터 리튬을 농축하고자 하였고, 농축실 내 리튬의 농도, 물 회수율(이동율), 평균 에너지 소비량, 평균 유량의 인자들을 고려하여 최적 조건을 도출하고자 하였다.
3. 실험 장치 및 방법3.1 실험 장치전기투석공정에 의하여 리튬을 농축시키기 위한 장치로 CJT-055 Electro Dialyzer(Chang Jo Tech. Co., Korea)을 사용하였으며 장치의 사진 및 주요사양을 그림 2과 표 1에 나타내었다. 농축실(concentrate tank), 희석실(dilute tank), 전극실(electrode tank), 정류기 등으로 카트리지는 10쌍의 NEOSEPTA CSE·ASE(ASTOM Co., Japan)에 추가로 1장의 CSE로 이루어져있고 각 교환막 사이에 비 절연물의 스페이서가 위치하여 가스켓 및 액실을 형성하고 있다. 이온교환막의 특성은 표 2에 나타내었다. 정류기는 DC, 전압 0~30 V, 전류 0~5 A의 범위 내에서 작동하나 카트리지 및 장치보호를 위한 전류의 상한선은 3 A이며 양극 및 음극으로는 백금이 코팅된 티타늄을 사용하였다.
3.2 실험 방법리튬 함유 원료용액 내 리튬의 농축을 위하여 농축실과 희석실에 리튬함유 원료용액을 사용하였고 전극실에는 0.3 M Na2SO4를 사용하였으며 표 3에 원료용액 내 조성을 나타내었으며 불순물 중 P, Mg, Ca 농도는 0.005 g/L 미만으로 Li, Na 대비 매우 낮았다. 또한 펌프 작동 후 카트리지 또는 튜브 내 존재하는 공기를 제거하기 위해 5분 동안 용액을 충분히 순환시킨 후 전압을 인가하였다. 이후 15분마다 농축실과 희석실의 전기전도도를 측정하였으며 희석실의 전기전도도가 1.00 mS/cm 이하가 될 때 실험을 종료하였다 [17,18]. 여기서 S(siemens)는 전도도의 단위로 전기저항의 단위 옴(Ω)의 역수이며 1 S = 1 A/V = 1/Ω 이다. 실험 종료 후 농축실, 희석실 및 전극실에서 각각 샘플을 채취하여 ICP-AES (Perkin Elmer/Optima-4300 DV)로 분석하였다. 농도가 낮은 P, Mg, Ca는 전기 투석 중 이온 이동이 일어나지 않아 실험 결과에서는 Li, Na, SO4에 대한 거동만 나타내었다. 전류와 전류밀도 사이의 관계식을 식 (1)에 나타내었고, 이온 농도, 실험 후 용액 부피, 공정에 소요된 시간 등을 이용하여 식(2) ∼ (4)에 의해 각 조건에서의 물 회수율, 평균 에너지 소비량, 평균유량은 Y. Zhou에 의해 제시된 식을 이용하여 계산하였다 [17]. 전류밀도와 전류 사이의 변환 식을 식 (4)에 나타내었다.
전기투석 장치에서 기록된 전류 값을 전류밀도 값으로 변화하기 위해 다음과 같은 식을 사용하였으며, I(A)는 전류, J(A/dm2)는 전류밀도, A는 이온교환막의 유효면적(dm2)을 나타낸다.
물 회수율(W, %)은 다음과 같은 식으로 구할 수 있으며 V0와 Vt는 각각 0분과 t분 후 희석실의 부피(L)를 나타낸다.
평균 에너지 소비량(E, kWh/m3)은 다음과 같은 식으로 구할 수 있으며 U(V)는 인가전압, I(A)는 인가된 전류, V(L)은 초기 리튬용액의 부피이다.
평균 유량(J, mol/m2h)은 다음과 같은 식으로 구할 수 있으며, m은 농축실에서 농축된 Li의 질량(g), N은 교대로 위치한 양이온 교환막과 음이온 교환막의 쌍 개수, A는 이온교환막의 유효면적(m2), M은 농축된 리튬의 분자량(g/mol), t는 투석 시간(hr)을 나타낸다.
4. 실험 결과 및 고찰4.1 한계전류밀도전기투석 시 용액중의 농도가 연속적으로 변하게 되는데 반응 도중에 한계전류밀도를 초과할 경우 전력이 필요이상으로 소비되는 것을 방지하고, 또한 용액 중 pH의 변화에 따라 막 표면에 스케일 형성에 의한 막 손상을 방지하기 위하여 용액농도에 따른 한계전류밀도를 측정하였다 [16]. 실험은 전압인가 후 1분 동안 안정화한 뒤 전류 밀도 값을 측정하였으며 전류-전압 곡선에서 기울기가 변하는 지점을 통해 한계전류를 알아보았고 이에 대한 결과를 그림 3에 나타내었다. 실험에 사용된 용액은 표 3의 조성을 가지는 리튬 함유 원료용액과, 표 4의 조성을 가지는 농도조절을 위한 모의용액을 제조하여 사용하였다. 일반적으로 한계전류밀도(ilim)와 이온 농도(Cb) 사이의 관계식은 식 (5)와 같이 확산계수(D), Faraday 상수(F), 이온교환 막 내 이동수(tm), 용액 내 이동수(ts), 확산층 두께(δ)에 의해 정의 될 수 있으며 [19,20], 이온 농도와 한계전류 값은 비례 관계이다. 전기투석이 진행되는 동안 탈염되어 용액 중 이온 농도가 감소함에 따라 한계전류가 나타날 수 있어 [21], 모의 용액 중 리튬 이온 농도를 5.0 g/L에서 0.1 g/L 수준까지 희석하여 인가전압에 따른 전류 밀도를 고찰하였다. 그림 3으로부터 인가전압 16 V 이하에서는 인가전압에 따라 전류밀도가 비례해서 증가하는 경향을 보였고, 또한 동일한 인가전압에서 이온 농도가 감소함에 따라 전류밀도도 감소하는 경향을 나타내기 때문에 한계전류밀도는 관찰되지 않았다. 또한, 실험 종료 전 후 농축실과 희석실의 pH를 확인한 결과 pH 6~7 사이로 큰 변화는 없었다.
4.2 인가전압 영향 고찰정전압 조건에서 전압에 따른 리튬 농축의 적정조건을 고찰하기 위하여 희석실, 농축실, 전극실에 용액을 각각 400 mL씩 사용하여 실험을 진행하였다. 전기투석 중 시간에 따른 전기전도도를 그림 4에 나타내었으며 이 때 D는 희석실, C는 농축실을 뜻한다. 표 5에는 실험 후 농축실에서의 Li+, Na+, SO42- 이온의 농도를 나타내었는데 인가전압이 높을수록 농축된 리튬의 농도가 높음을 보였다. 이후 식 (2)~(4)을 이용하여 에너지 소비량과 평균유량을 계산한 결과를 표 6에 나타내었으며 전압이 높을수록 전력 소비량이 많기 때문에 에너지 소비량이 높았으며 또한 공정에 소요되는 시간이 짧아 평균유량이 높았다. 여러 인자들을 고려하였을 때 12 V에서 가장 빠르게 리튬을 농축시킬 수 있고 물 회수율, 리튬 실험 후 농도 및 평균 유량이 가장 높았으나 음극에서 환원되는 수소기체에 의해 음극과 전극실 사이에 농도분극이 크게 일어나게 되고 전극실 속 이온이 음극에 환원되는 현상이 나타나 장치에 문제를 일으킬 수 있어 적절하지 않다. 12 V를 제외하고 전기투석에 소요되는 시간, 물 회수율, 평균 유량의 인자들을 고려하였을 때 10 V가 적정조건이며 에너지 소비량 측면에서는 8 V가 적정조건이다. 이 때 전기투석 시 물이 이동되는 현상에 의해 실험 후 농도가 감소하기 때문에 희석실과 농축실의 부피비를 조절하는 추가적인 조작이 요구된다.
4.3 부피비 변화 영향 고찰희석실과 농축실의 부피비 조절에 의한 리튬농축의 적정조건을 고찰하였다. 농축실과 전극실의 용액은 각각 400 mL씩 사용하였고, 부피비 조절을 위해 희석실은 400, 800, 1200, 1600 mL 씩 사용하였다. 8 V와 10 V의 정전압 조건에서 실험을 진행하였고 그림 5(a)에는 8 V일 때, 그림 5(b)에는 10 V일 때 시간에 따른 전기전도도를 나타내었으며 그림 6과 표 7에는 실험 후 농축실에서 Li+, Na+, SO42- 이온의 농도를 나타내었고 에너지 소비량, 평균 유량을 계산하여 그림 7(a), (b)에 나타내었다. 이 때 VD는 희석실의 부피, VC는 농축실의 부피를 뜻한다.
물 회수율은 8 V일 때 평균 25.07 %, 10 V 일 때 평균 30.85 %로 전압이 높을 때 전기투석 공정에 소요되는 시간이 감소하기 때문에 더 높은 물 회수율을 보였다. 그림 6에서 리튬 실험 후 농도는 8, 10 V의 정전압 조건에서 모두 부피비(VD/VC)에 비례하여 증가하였고 10 V 일 때 리튬의 실험 후 농도가 더 큰 폭으로 증가하였다. 그림 7(a)의 에너지 소비량은 모든 부피비 조건에서 10 V 일 때 더 높은 값을 보였고, 부피비에 비례하여 증가하였는데 이것은 공정에 소요되는 시간이 길어졌기 때문이라 사료된다. 또한 그림 7(b)의 평균 유량 또한 10 V 일 때 높았으며 부피비에 비례하여 감소하였고 부피비가 커질수록 막 면적당 희석실에서 농축실로 이동하는 이온의 양이 더 많아지기 때문이라 사료된다. 한편 CJMA/MA를 이온교환막으로 사용한 리튬 농축 연구에서는 부피비가 증가할수록 실험 후 농도 또한 증가함을 보였으나, NEOSEPTA CMX·AMX를 사용한 황산리튬 농축 연구에서는 부피비에 비례하여 농축된 황산리튬의 농도가 증가하다 한계에 도달하려는 현상을 보이고 있어 부피비를 더 증가시켜 농축 경향을 고찰할 필요가 있다 [17,22].
High volume ratio concentration(HVRC) 방식을 통해 리튬을 농축하기 위하여 희석실과 농축실의 부피비(VD/VC)를 1/1(900 mL / 900 mL) ~ 10/1(1,636 mL / 164 mL)까지 조절하여 전기투석 실험을 실시하였다. 이때 인가전압은 10 V 이었으며 전극실에는 0.3 M Na2SO4용액을 500 mL 사용하였다. 그림 8에 시간에 따른 전기전도도를 나타내었고, 그림 9와 표 8에는 실험 후 농축실에서 Li+, Na+, SO42- 이온의 농도를 나타내었다. 또한 에너지 소비량, 평균유량을 계산하여 그림 10(a), (b)에 나타내었다. 이 경우 물회수율은 평균 37.24%로 일정하였고, 리튬의 실험 후 농도는 부피비에 비례하여 증가하다가 감소하는 경향을 보였다. HVRC가 9/1(1,620 mL / 180 mL)과 10/1(1,636 mL /164 mL)일 때 실험 후 농도가 감소하는 이유는 용매인 물투과속도가 염 투과속도보다 빠르기 때문이다. 즉 실험 후기에 물이 삼투압 현상에 의해 투과되는 것이 지배반응이 된다 [17]. 그림 10(a)의 에너지 소비량은 부피비에 비례하여 증가하였고 그림 10(b)의 평균 유량은 감소하였다. 따라서 상기 실험결과로부터 리튬농축율, 에너지 소비량, 평균유량을 고려할 경우 부피비 3/1(1,350 mL / 450 mL)인 조건이 리튬 농축에 적정한 조건이라고 생각된다.
5. 결 론폐 리튬이온배터리에서 유가금속을 회수하고 남은 추출여액을 원료용액으로 하여 리튬을 분리·농축하기 위해 전기투석을 적용하여 기초연구를 실시한 결과, 다음과 같은 결론을 얻을 수 있었다.
1) 공정 안정성을 위해 한계전류밀도를 알아본 결과 용액 내 이온 농도가 감소할수록 전류 밀도 또한 감소하는 경향을 보였으나, 원료 용액 농도의 3% 수준에서도 한계전류밀도가 관찰되지 않았다.
2) 인가전압에 따른 전기투석 결과 공정 소요 시간, 물회수율, 평균 유량, 에너지 소비량을 공정 인자로 고려하였을 때 에너지 소비량 관점에서는 8 V가 효율적이나, 10 V 조건에서 공정 소요 시간이 짧고 물 회수율과 평균유량이 높기 때문에 공정 운전 전압은 10 V가 효율적이다.
3) 희석실의 부피를 증가시켜 희석실과 농축실의 부피비(VD/VC) 조절하였을 경우, 부피비가 증가하여도 물 투과속도보다 리튬의 투과 속도가 더 빨라 리튬의 농축율이 증가하였으며, 인가전압 10 V, 부피비가 4/1일 때 4.4 g/L까지 농축되었다.
4) High volume ratio concentration (HVRC) 방식을 사용하여 희석실과 농축실의 총 부피를 고정하고 부피비를 조절한 결과, 부피비(VD/VC) 7/1 이상에서는 물의 투과 속도가 염의 투과 속도보다 빨라져 리튬의 농축율이 오히려 감소하였다. 리튬의 농축율과 평균 유량이 높고 에너지 소비량은 낮은 부피비 3/1 조건이 가장 효율적이며, 이 경우 5.3 g/L의 농축된 리튬용액(농축율 : 160.61%)을 회수할 수 있었다.
Acknowledgments본 연구는 2019년도 산업통상자원부의 재원으로 한국에너지기술평가원(KETEP)의 지원을 받아 수행한 연구과제(No. 20185210100050)이며, 이에 감사드립니다.
Fig. 3.Determination of the limiting current density by plotting : current density vs. applied voltage. 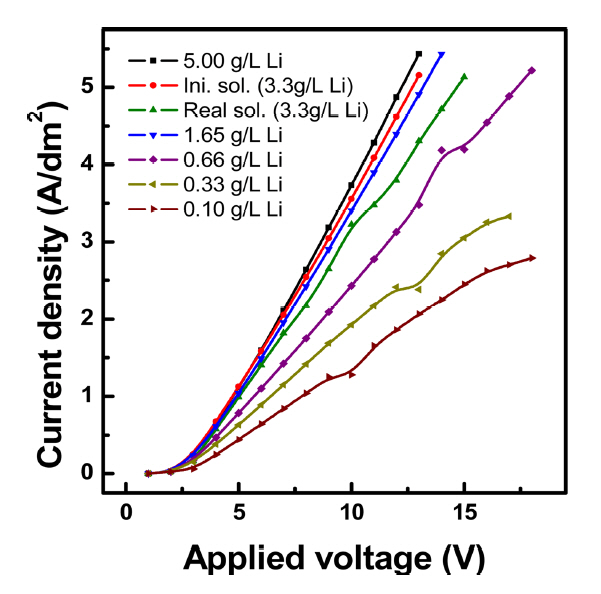
Fig. 4.Effect of applied voltage on the electrical conductivity(D : Dilute tank, C : Concentrate tank). 
Fig. 7.Effect of volume ratio and applied voltage on the (a) energy consumption and (b) average flux. 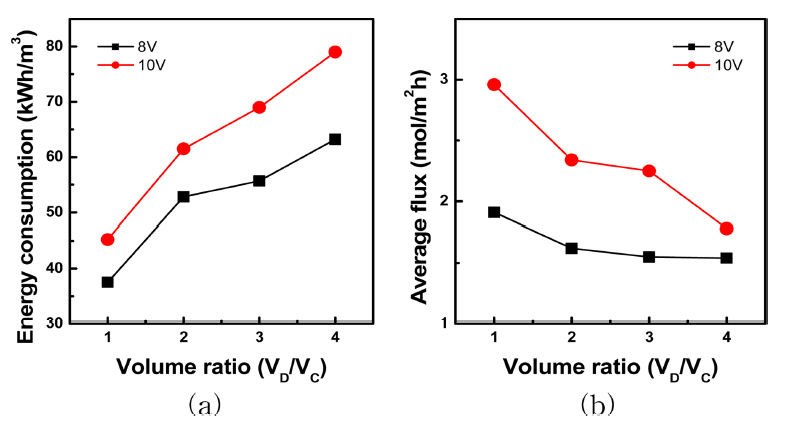
Fig. 10.Effect of volume ratio and applied voltage on the (a) energy consumption and (b) average flux. 
Table 1.Specifications of Electro Dialyzer Table 2.Characteristics of ion exchange membrane (NEOSEPTA) Table 3.Composition of Li-containing solution used in study (Unit : g/L)
Table 4.Composition of lithium containing solution used in study (Unit : g/L)
Table 5.Final concentration of Li+, Na+, SO42- (Unit : g/L)
Table 6.Effect of applied voltage on the energy consumption and average flux
Table 7.Final concentration of Li+, Na+, SO42- (Unit : g/L) REFERENCES1. H. W. Yang, J. H. Lee, S. C. Jung, S. T. Myung, W. S. Kang, and S. J. Kim, Korean J. Met. Mater. 54, 780 (2016).
2. Y. M. Yang, C. Loka, D. P. Kim, S. Y. Joo, S. W. Moon, Y. S. Choi, J. H. Park, and K. S. Lee, Met. Mater. Int. 23, 610 (2017).
6. Z. Y. Guo, Z. Y. Ji, Q. B. Chen, J. Liu, Y. Y. Zhao, F. Li, Z. Y. Liu, and J. S. Yuan, J. Clean. Prod. 193, 338 (2018).
7. J. K. Lee, S. G. Jeong, S. J. Koo, S. Y. Kim, and C. S. Ju, Korean Chem. Eng. Res. 51, 53 (2013).
8. A. Umeno, Y. Miyai, N. Takagi, R. Chitraker, K. Sakane, and K. Ooi, Ind. Eng. Chem. Res. 41, 4281 (2002).
9. T. G. Ryu, J. H. Shin, S. M. Ghoreishian, K. S. Chung, and Y. S. Huh, Hydrometallurgy. 184, 22 (2019).
10. J. E. Lee, Master’s Degree Thesis. 9–10, Daejin University, Pocheon (2019).
12. J. W. Ahn, H. J. Ahn, S. H. Son, and K. W. Lee, J. Korean Inst. Resources Recycling. 21, 58 (2012).
13. J. K. Lee, S. G. Jeong, S. J. Koo, S. Y. Kim, and C. S. Ju, Korean Chem. Eng. Res. 51, 53 (2013).
14. H. J. Ahn, J. W. Ahn, K. W. Lee, and H. T. Son, J. Korean Inst. Resources Recycling. 23, 21 (2014).
15. H. J. Ahn, Master’s degree thesis. 61–62, Daejin University, Pocheon (2014).
16. S. H. Kim and Ph. D. thesis, Ph. D. thesis. 25–27, Dankook University, Seoul (2000).
18. Y. H. Jung, S. H. Kang, and Y. K. Chang, Theories and Applications of Chemical Engineering. 7, 1341 (2001).
19. A. M. Peers, Discuss. Faraday Soc. 21, 124 (1956).
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||