1. 서 론
타이타늄은 지각 구성 원소 중 9번째로 풍부한 원소이며, 구조용 금속으로서는 알루미늄, 철, 마그네슘에 이어서 네 번째로 풍부한 원소로서 많은 광물 중에 존재한다 [1]. 타이타늄과 관련된 공업제품은 안료로서의 TiO2(이산화 타이타늄)와 금속원료로서의 스펀지 타이타늄이 주류이지만, 약 93%는 페인트, 제지, 플라스틱 등의 안료 및 충진제로 사용되고 있으며, 금속상태로 사용되는 것은 약 7% 정도에 불과하다 [2]. 이러한 TiO2의 원료에는 천연 루타일(rutile, TiO2≥95%)과 일메나이트(ilmenite, FeTiO3, TiO2 함유량 40~65%)가 있으나, 천연 루타일의 경우 매장량이 적어 현재는 일메나이트가 타이타늄 관련제품의 주원료로 사용되고 있다.
일메나이트는 루타일과 달리 철 및 기타 불순물을 다량 함유하여 TiCl4를 제조하기 위한 염화 공정에 직접 투입할 경우 철을 포함한 다량의 금속 염화물이 생성되어 배관의 막힘이 발생할 수 있고, 염소가스의 소비 효율도 낮아진다. 따라서 일메나이트를 이용하여 TiCl4를 직접 만드는 것은 곤란하며, 광석중의 Fe 등을 제거하여 고품위의 TiO2를 만들어야 한다. 일메나이트로부터 철 등을 제거하여 합성 루타일을 만드는 공정은 크게 습식과 건식방법이 있다 [2]. 습식으로는 환원 후 염산에 가압침출하는 Benilite법, 산화, 환원 후 NH4Cl 수용액에서 aeration 이후 산세를 거치는 Becher법 등이 있다. 건식법으로는 전기로에서 환원하여 선철과 약 80%의 TiO2가 함유된 슬래그를 분리한 후 슬래그 중의 저급 타이타늄 산화물을 TiO2로 산화시키기 위한 산화, 철을 제거하기 위한 환원, 산 침출 공정을 거치는 UGS process 등이 있다. 또한 선택적 염화에 의해서 Fe를 제거하는 방법이 있으며, 이러한 선택염화법에 대해서는 많은 연구결과가 보고되어 있다 [3-9]. 특히 선택적 염화에 의한 일메나이트의 정제는 단일 공정에 의해서 고품위의 TiO2를 얻을 수 있는 장점이 있기 때문에 많은 연구들이 이루어져 있으나, 선택염화반응은 생성물층을 통한 반응가스의 확산율속과 반응계면에서의 화학반응 율속이 복합적으로 작용하여 율속단계에 대해서 명확하게 규명되지 못하고 있다 [5-9].
따라서 본 연구에서는 일메나이트 중의 Fe를 선택염화시켜 제거하기 위해서 염화제로 염소가스(Cl2)를 사용하였으며, 환원제로는 코크스를 사용하여 환원제 첨가량, 염소가스의 분압, 반응온도 등이 Fe 제거에 미치는 영향에 대하여 조사하고, 반응율속단계와 활성화 에너지에 대해 검토하였다.
2. 실험방법
본 실험에 사용한 일메나이트 광석의 조성은 유도결합 플라즈마 방출 분광기(ICP-AES)를 통해 분석하여 표 1에 나타내었다. 불순물은 약 27 wt%의 Fe를 비롯하여 1 wt% 전후의 Si, Mn, Al, Mg 등이 산화물로서 존재한다. 그리고 X-선 회절분석(XRD: D/Max-2500, Rigaku)결과를 그림 1에 나타내었으며, 시료는 FeTiO3와 TiO2로만 존재하였다. 따라서 Fe가 모두 FeTiO3상으로 존재하는 것으로하여 계산하면 FeTiO3는 73.28 wt%, TiO2는 15.02 wt%이며, 나머지는 SiO2, MnO, Al2O3 등의 산화물로 구성되어 있다. 염화제로는 고순도의 염소가스(>99.9%)를 사용하였으며, 환원제로는 코크스(고정탄소 98.1%)를 사용하였다.
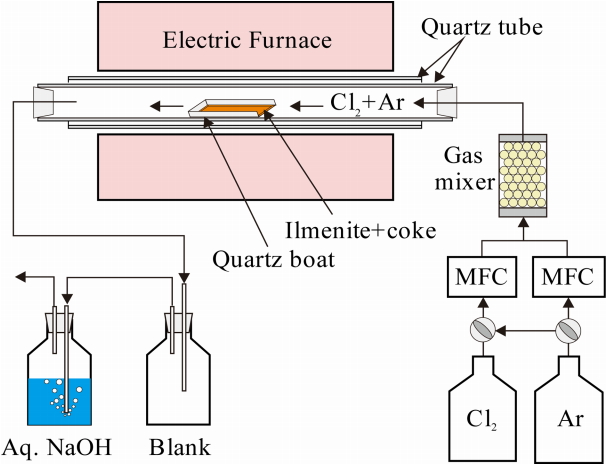
본 실험에 사용한 장치의 모식도를 그림 2에 나타내었다. 시료의 가열은 수평전기로를 사용하였으며, 석영관(55 mm ID, 1200 mm length)을 반응관으로 사용하였다. 가스 유량은 MFC(Mass Flow Controller: MPR-3000S and VIC-D210, KITS)로 제어하였다. 일메나이트 시료는 반응가스가 송입되는 방향이 open된 석영제 boat(L 100 mm, W 40 mm, D 20 mm)에 코크스와 함께 약 1 mm의 두께로 분산시켜 장입하였다.
승온하는 도중에는 Ar만 송입하였으며, 실험 온도인 1023~1173 K에 도달한 후 시료를 균열대에 장입하고 약 15분간 Ar가스로 치환해 주었다. 이후 Cl2가스 또는 Cl2와 Ar의 혼합 가스를 MFC로 유량을 제어한 후 혼합기를 통하여 반응관 내로 송입하였다. 일정시간 동안 반응한 후에는 Cl2는 잠그고, Ar 가스만 반응관 내로 송입하여 잔류하는 Cl2 가스를 제거하였으며, 필요에 따라서는 Ar 가스를 Cl2의 MFC로 공급하여 MFC와 혼합기에 잔류하는 염소가스를 제거하였다. 반응에 의해 생성하는 염화철과 미반응한 Cl2+CO 가스는 공병을 거친 후에 NaOH 수용액 중으로 송입하여 중화한 후에 외부로 배출하였다.
실험 종료후, 잔류하는 반응물을 회수하고 무게를 측정하고 ICP로 Ti와 Fe 농도를 분석하였다. 그리고 SEMEDS(scanning electron microscopy-energy dispersive spectrometer) 분석을 통해 입자내부의 Fe와 Ti의 분포를 조사하였다.
3. 결과 및 고찰
3.1. 염소가스에 의한 일메나이트 중 Fe의 선택염화
본 실험에 사용한 일메나이트 광석은 TiO2, FeTiO3로 구성되어 있으며, 일메나이트는 FeO와 TiO2가 식(1)과 같이 약하게 결합되어 있으므로, FeO와 TiO2의 혼합물로 간주할 수 있는 것으로 보고되어 있다 [7].
C(s)가 존재하는 경우에는 다음 식과 같이 나타낼 수 있다.
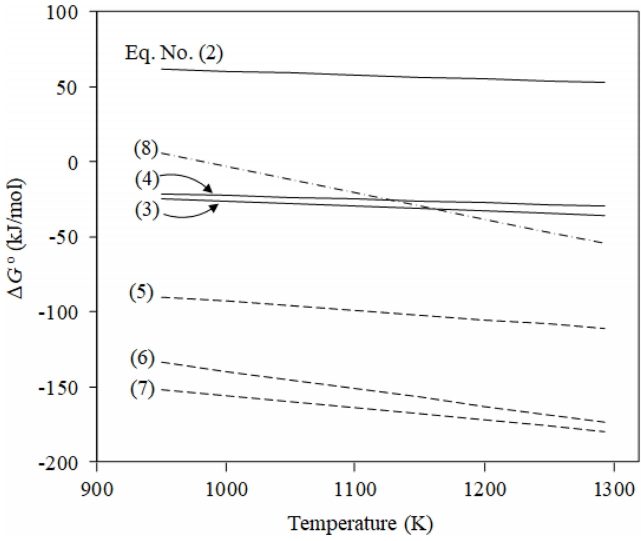
그림 3에는 식(2)~(7)의 ∆G0를 온도에 대하여 나타내었다. 식(2)의 경우 그림으로부터 1300 K까지는 ∆G0가 양의 값을 가지므로 Cl2에 의해서 염화반응이 일어나기 곤란한 것을 알 수 있다. 그러나 식(3)과 (4)의 경우 ∆G04는 음의 값을 나타내므로 염화반응이 일어날 수 있을 것으로 판단된다. 그리고 식(5)~(7)과 같이 C(s)가 존재하게 되면 주어진 온도범위에서 ∆G0가 전부 음의 값을 나타내므로 염화반응이 쉽게 일어날 수 있다는 것을 알 수 있다. 특히 환원제인 C가 존재하는 경우 식(3), (4) 보다 낮은 ∆G0 값을 나타내어 염화반응이 원활하게 일어날 수 있는 것을 알 수 있다.
3.2. Fe 제거율에 미치는 환원제량의 영향
식 (7)로부터 1 mol의 FeO(s)가 모두 염화되기 위해서는 C(s)이 1 mol 필요하며, 실험에 사용된 일메나이트 광석 10 g 중 FeO는 약 3.47 g에 해당하므로, FeO가 모두 환원되기 위해서는 C(s) 약 0.6 g이 필요하다. 그러나 고정층에서는 코크스와 광석 간 접촉이 제한적이기 때문에 코크스의 순도(고정탄소 98.1%)를 고려하여 계산 값보다 1.7~5배(nC⁄nO = 1.7∼5)의 코크스를 첨가하였다.
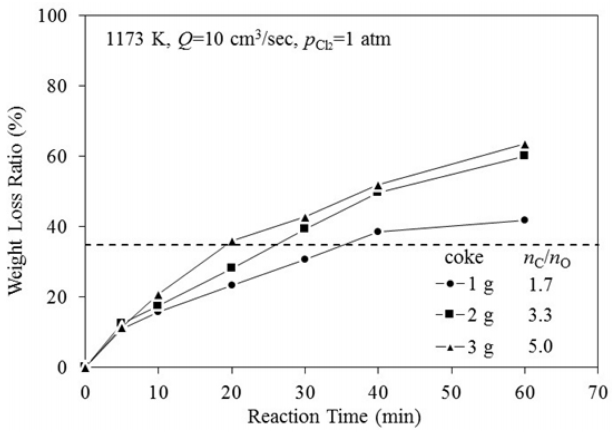
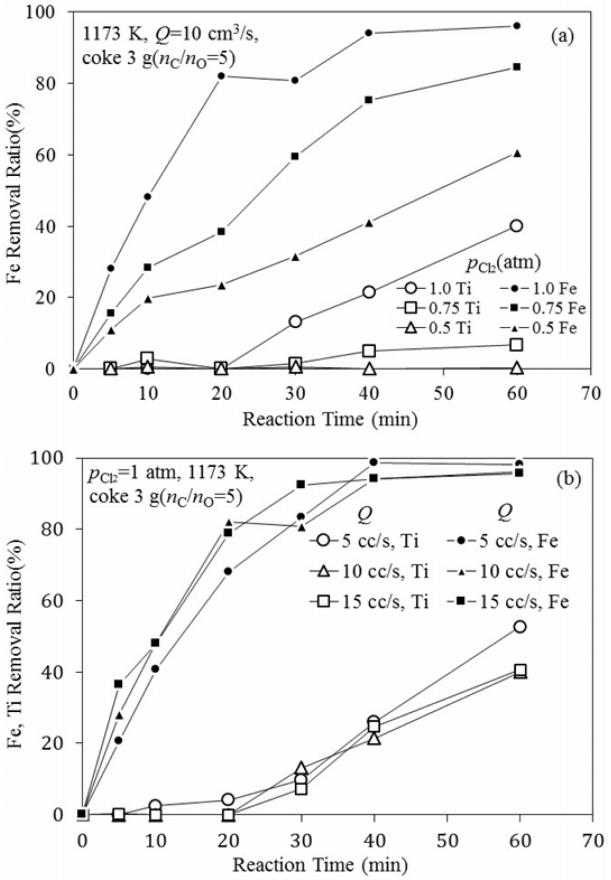
그림 4에는 1173 K, 염소 가스유량 Q=10 cm3/s의 조건에서 일메나이트의 무게 감소율에 미치는 코크스 첨가량의 영향을 나타내었다. 코크스 첨가량에 관계없이 5분 반응 후의 무게변화율은 유사한 수준이었으나, 반응시간이 경과함에 따라 점차 무게 감소율이 증가하였으며, 코크스 양이 증가할수록 무게 감소율이 더 높게 나타났다. 시료 중의 FeO가 약 34.72%이지만, 코크스 첨가량이 2 g(몰비 nC ⁄ nC = 3.3) 이상이 되면 이보다 높은 무게 감소율을 나타내어 시료 중의 TiO2도 일부 제거된 것으로 생각된다.
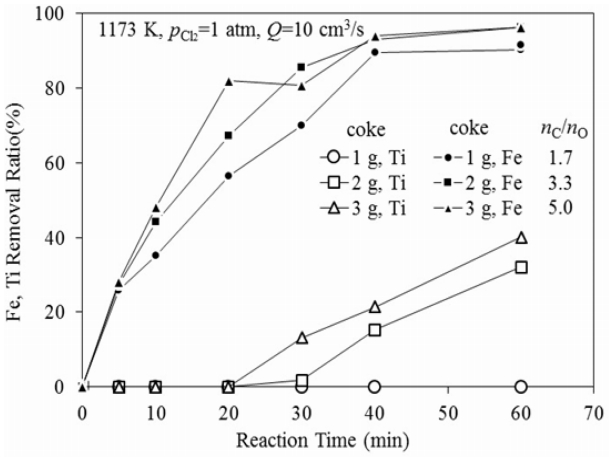
여기서 (wt % M)t는 일정시간 후 시료 중의 Fe나 Ti의 농도이며, (wt % M)0는 시료 중 Fe나 Ti의 초기농도를 나타낸다. 그림으로부터 Fe는 반응시작과 함께 식(6) 및 (7)의 염화반응에 의해 급격하게 제거되는 것을 알 수 있다. 그리고 코크스 첨가량이 증가할수록 Fe의 제거율과 제거속도가 증가하였다. 그러나 40분간 반응한 후에는 Fe의 제거율에는 변화가 없었다. 한편 Ti의 경우 코크스 첨가량이 nC⁄nO = 1.7인 경우에는 거의 변화가 없으나 코크스 첨가량이 nC⁄nO = 3.3 이상이 되면 약 20분 경부터 서서히 제거되기 시작하였다. 그리고 코크스 첨가량이 많을수록 Ti 제거속도도 증가하였다. 따라서 그림 4에서 코크스 첨가량이 nC⁄nO = 3.3 이상에서 FeO 함유량보다 많게 무게가 감소한 것은 환원제량의 증가에 따라 식(2)~(4)의 반응에 의해 생성되는 O2가 곧바로 제거되어 식(5)에 따라 TiO2까지 염화되어 제거되었기 때문인 것으로 판단되다.
그림 6에는 1173 K, pCl2=1 atm의 조건에서 코크스 3 g (nC⁄nO = 5)을 첨가한 경우 반응 시간에 따른 시료 표면의 형상 변화를 나타내었다. 반응 초기에는 표면에 각기둥 형태가 나타나다가 반응이 진행될수록 점점 각기둥 형상은 사라지고 미세한 기공이 관찰되었다. 그리고 60분 반응 후에는 망상 구조를 나타내었다. 이러한 형상은 삼방정 구조를 갖는 FeTiO3에서 Fe 산화물이 제거되었기 때문으로 생각된다. 또 이 조건에서는 그림 5에 나타낸 바와 같이 일메나이트 중의 Ti도 일부 제거되었기 때문에 표면에 큰 기공이 생성된 것으로 생각된다.
3.3 염소가스 분압과 전체 유량의 영향
그림 7(a)에는 Fe의 제거율 및 제거속도에 미치는 염소가스 분압의 영향을 나타내었다. 그림 7(a)와 같이 기체상(bulk gas)의 염소가스 분압이 증가함에 따라 Fe 제거율 및 제거속도는 크게 증가하였다. 염소분압이 높은 경우 반응초기부터 Fe의 제거율이 크게 증가하였고, 반응이 종료되는 시간 또한 빨랐다. 또 60분 반응 후 각 염소 분압 조건에서 Fe 제거율도 큰 차이를 보였다. 염소 분압이 증가할수록 Fe 제거속도와 제거율이 증가하는 것은 bulk gas와 입자 표면, 그리고 반응 계면에서의 농도차를 증가시키므로 bulk gas가 반응계면으로 확산될 때의 구동력을 증가시켰기 때문인 것으로 생각된다. 또한 그림 7(b)에는 Fe와 Ti의 속도에 미치는 전체 가스유량의 영향을 나타내었다. 그림 7(b)의 결과에서 나타난 것과 같이 전체 유량에 따른 Fe와 Ti 제거율의 차이가 크지 않으므로 본 실험의 반응조건에서의 전체 유량은 가스 경계층을 통한 반응가스의 물질이동을 무시하기에 충분한 것으로 생각된다.
3.4 반응 온도의 영향
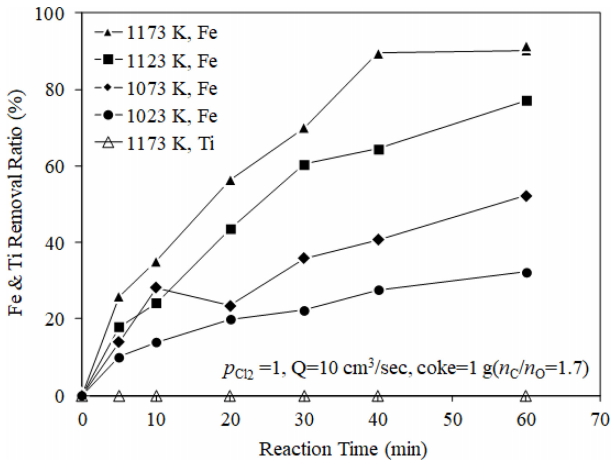
그림 8에는 pCl2=1atm의 조건에서 코크스를 1 g (nC⁄nO = 1.7) 첨가한 경우 반응온도에 따른 Fe와 Ti의 제거율 변화를 나타내었다. 반응온도가 높을수록 Fe 제거속도와 제거율이 현저하게 상승하였다. 그러나 Fe제거속도가 가장 높은 1173 K에서는 물론 그 이하의 온도에서도 60분까지 반응하였을 때 Ti은 전혀 변화가 없이 Fe만 선택적으로 염화되어 제거되는 것을 알 수 있다.
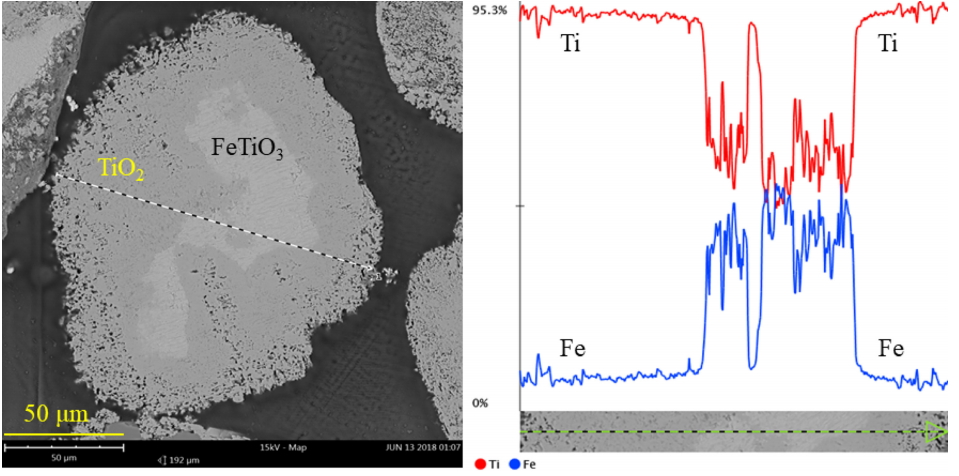
그림 9에는 1123 K, pCl2 = 1 atm의 조건에서 30분간 반응한 후의 시편 단면을 관찰한 결과를 나타내었다. 그림 5에 나타낸 바와 같이 입자 표면에는 비교적 조대한 기공이 생성되어 있으며, 입자 내부는 Fe 제거에 따른 미세한 기공이 생성되어 있다. 입자 단면을 선 분석한 결과 입자 표면 쪽에는 Ti가 관찰되었으며, 내부에는 Ti와 Fe이 유사한 수준으로 존재하였다. 따라서 표면 쪽은 Fe의 선택적 염화 제거에 의해 TiO2만 남았으며, 내부에는 미반응한 FeTiO3가 존재하는 것으로 판단된다.
염소가스에 의한 일메나이트 입자의 염화반응 거동을 설명하기 위해 그림 9로부터 반응 중 입자 크기에는 변화가 없고, 내부의 미 반응 핵의 크기가 감소한다는 가정 하에 속도론적으로 검토하였다. 기-고 반응은 입자 주위의 가스경계층을 통한 물질이동, 생성물층을 통한 반응가스의 확산, 그리고 반응계면에서의 화학반응 율속으로 생각할 수 있다. 각각의 율속과정에 따른 반응속도식은 다음과 같이 나타낼 수 있다.
1) 가스 경계층을 통한 물질이동 율속
2) 생성물 층을 통한 반응물질의 확산 율속
3) 반응계면에서의 화학반응 율속
여기서 x는 반응률(-), t는 반응시간(s), 그리고 kg, kd, kr은 각각 물질이동 율속, 확산 율속, 화학반응 율속의 겉보기 속도상수(s–1)를 나타낸다.
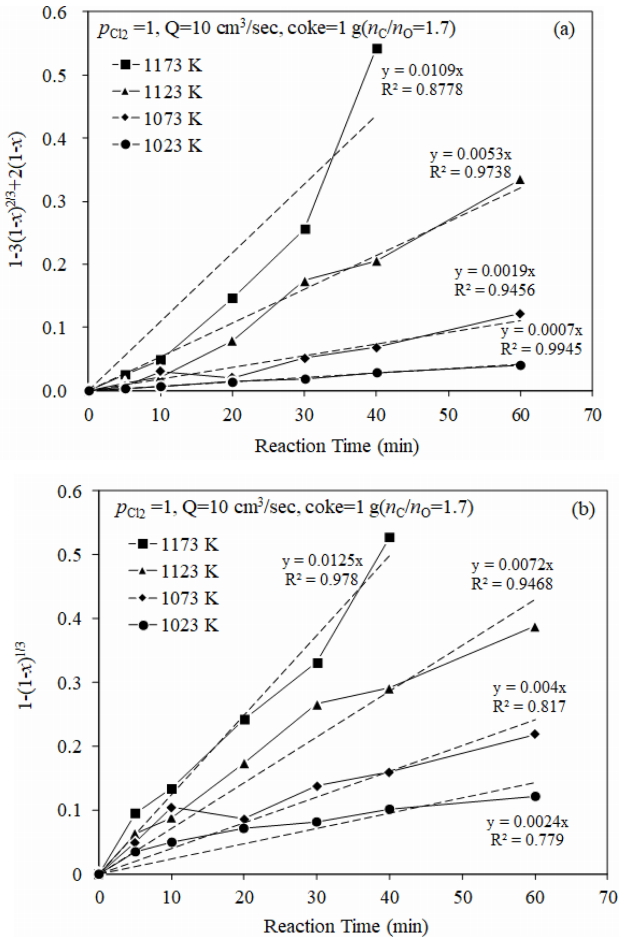
그림 8의 Fe 제거율을 식(10)~(12)의 반응률 x에 대입하고 반응시간 t에 대해 플롯트하여 직선성이 가장 우수한 것(결정계수 R2→1)이 율속단계로 된다.
그림 7(b)의 결과에서 가스 경계층을 통한 물질이동은 무시할 수 있었기 때문에, 그림 10에는 그림 8의 실험결과로부터 60 분까지의 반응률(단, 1173 K의 경우 40 분까지의 반응률)을 식(11)과 식(12)에 대입하여 염화반응속도를 계산하고 상관계수(R2)와 함께 나타내었다. 생성물층을 통한 확산 율속으로 가정하여 계산한 결과(a) 1173 K에서의 R2값이 0.8778 낮은 값을 나타내었으며, 그 이하의 온도에서는 0.94 이상의 비교적 높은 값을 나타내었다. 그리고 반응계면에서의 화학반응 율속으로 가정하여 계산한 결과(b) 1073 K 이하의 온도에서는 상관계수가 낮은 값을 나타내었다. 1123 K에서는 상관계수가 양쪽 모두 높은 값으로 나타났다. 따라서 1123 K를 기준으로 율속단계가 바뀌는 것으로 판단된다. 반응온도가 높을수록 반응속도가 높아져서 그림 6 및 그림 9에 나타낸 입자 표면 및 내부의 평균 기공 직경과 공극률이 커지므로 상대적인 생성물층을 통한 확산이 용이하여 계면에서의 화학반응이 율속단계가 되는 것으로 생각된다.
그림 11에는 그림 10에서 구한 겉보기 속도상수를 Arrhenius 플롯하여 나타내었다. 일메나이트의 선택염화에 의한 Fe제거의 활성화 에너지는 생성물층을 통한 확산율속인 1123 K 이하의 온도에서는 193.18 kJ/mol로 계산되었다. 화학반응 율속인 1123 K 이상에서는 그림 11로부터 확산율속인 경우보다 낮은 값으로 추정된다. 한편, Yun 등은 일메나이트광석(Ti: 54.2 wt%, Fe: 30.15 wt%)의 선택염화반응을 열중량 분석하고, 생성물층을 통한 확산율속으로 해석하여 활성화 에너지를 36.4 kJ/mol로 보고하였다 [6]. Fouga 등은 일메나이트 광석(Ti: 42.5 wt%, Fe: 51.6 wt%, 입자크기: <44 μm)의 선택염화반응을 열중량분석하고, 겉보기 활성화 에너지를 186 kJ/mol로 보고하였다 [7]. Rhee 등은 유동층 반응기에서 C+Cl2에 의한 함티탄 자철광(TiO2: 20.2 wt%) 중 Fe의 선택염화에서 화학반응 율속의 겉보기 활성화에너지는 131 kJ/mol, 확산율속에서는 86 kJ/mol로 보고하였다 [8]. Lakshmanan 등은 유동층 반응기에서 CO-Cl2 가스에 의한 일메나이트광석(TiO2: 59.28 wt%)의 선택염화 반응 속도를 고찰하였다. 973~1223 K에서 화학반응 율속으로 보고하였으며, 1123~1223 K에서는 42.65 kJ/mol, 973~1123 K에서는 21.95 kJ/mol로 온도 구간에 따라 다른 활성화 에너지값을 보고하였다 [9]. 이와같이 활성화에너지값에 많은 차이가 나는 것은 선택염화 반응의 율속단계가 반응 중에도 바뀔 수 있으나, 일률적으로 동일한 율속단계를 가정하여 활성화 에너지를 구하였기 때문으로 생각된다. 또한 율속단계와 활성화에너지는 사용한 일메나이트 광의 조성, 입자크기, 반응조건 등에 따라서 차이가 날 수 있다. 따라서 향후 이러한 부분에 대한 추가적인 연구가 필요할 것으로 판단된다.
4. 결 론
본 연구는 코크스를 환원제로 사용하고 Cl2 가스를 염화제로 사용하여 일메나이트 중 Fe를 선택적으로 염화시켜 제거하고, Fe 제거 속도에 미치는 반응 온도, 염소가스 분압, 코크스 첨가량의 영향을 조사하였다.
1) 코크스 첨가량이 증가할수록 Fe 제거 속도는 증가하였으나 코크스가 2 g 이상 첨가되면 Ti의 일부도 함께 제거되었다. 그리고 염소분압이 증가함에 따라 Fe의 제거 속도가 크게 증가하였으며, 코크스 1 g(nC⁄nO = 1.7)을 첨가하여 선택적 염화에 적절한 산소분압을 맞추었을 때 반응 온도의 증가에 따라 Fe의 제거 속도는 크게 증가하였으나 Ti는 제거되지 않았다. 따라서 일메나이트의 선택염화에는 산소분압과 염소분압의 제어가 큰 영향을 미쳤다.
2) 생성물 표면의 SEM 분석 결과 반응시간이 경과함에 따라 각기둥 형태가 점점 사라지면서 표면의 기공이 증가하였고, 최종적으로 망상 구조를 나타내었다. 그리고 입자 단면을 SEM-EDS로 분석한 결과 입자중심에 Fe가 제거되지 않은 부분이 존재하며, 표면에는 다공성의 TiO2 생성물층이 관찰되었다.
3) 미반응 핵 모델을 이용하여 속도론적으로 고찰한 결과 1123 K 이상의 반응온도에서는 화학반응 율속, 1123 K 이하의 반응온도에서는 생성물층을 통한 반응물질의 확산율속으로 나타났다. 이러한 결과는 고온일수록 입자 내의 기공과 공극률이 커져서 상대적으로 생성물층을 통한 확산이 용이하여 계면에서의 화학반응이 율속단계가 되는 것으로 생각된다. 확산 율속에서의 활성화에너지는 193.18 kJ/mol로 계산되었으며, 화학반응 율속의 활성화 에너지는 이보다 낮은 값으로 추정된다.