1. 서 론
희토류란 3A족인 원소기호 21번 스칸듐(Sc), 39번 이트륨(Y)에 57번 란타넘(La)에서 71번 루테튬(Lu)까지의 란탄계열 원소 15개를 더한 17원소를 총칭한다 [1,2]. 희토류 금속인 터븀(III)과 디스프로슘(III)은 고성능 자석의 소재로서 네오디뮴 자석에 첨가하면 고열에서도 자성을 잃지 않기 때문에 발전기나 전기차 모터의 효율을 향상시킨다 [3]. 최근 고성능 자석의 수요 급증으로 원광석과 2차 자원으로부터 고순도 희토류의 회수에 대한 연구가 많이 행해지고 있다 [4]. 침출용액으로부터 희토류성분을 분리하는 습식법에는 이온교환과 용매추출이 있다. 이온교환법은 1 g/L 이하 저농도의 희토류를 분리하는데 적합한 반면, 용매추출법은 비교적 조작이 쉽고 효율성이 높아 상용화되어 있다 [5-7].
묽은 염산용액에 함유된 희토류 분리 추출에는 D2EHPA, PC88A, Cyanex 272 등과 같은 유기인산계 추출제를 기반으로 한 공정이 상용화되어 있다. 그러나 상기 유기인산계 추출제에 의한 인접 희토류 성분간의 분리인자가 2미만이므로 분리에 많은 추출단수가 필요하다. 또한 추출구동력을 유지하기 위해 유기인산계의 비누화가 필요하므로 탈거 후 비누화에 필요한 수산화나트륨 비용저감에 개선의 여지가 많다. 유기인산계 추출제에서 희토류성분의 분리인자는 Cyanex 272 > PC88A > D2EHPA 순서로 높다 [8]. Cyanex 272의 경우 희토류 원소에 대한 선택 분리성은 우수하지만, 추출 효율이 낮고 고가라는 단점이 있다. 이러한 단점을 극복하기 위해 3차 아민과 Cyanex 272의 혼합용매를 사용한 희토류 분리에 대한 연구가 보고되어 있다 [9-11]. 한편 상용화 추출제의 높은 증기압, 제한된 선택성, 환경적 유해성을 극복하기 위한 청정용매로 이온성액체가 주목받고 있다. 이온성액체는 일반적인 유기용매와 달리 증기압이 낮고 금속이온의 특성 맞춤형 제조가 가능하여 최근 이온성액체를 활용한 희토류 분리에 많은 연구가 수행되고 있다. Padhan등의 연구에 따르면 Nd(III)와 Pr(III) 분리시 Cyanex 272와 Alqiuat 336으로 제조한 이온성액체를 사용하면 유기인산을 단독으로 사용한 조건에 비해 분리인자가 더 크다 [12,13].
터븀(III)과 디스프로슘(III)같이 원자번호가 인접한 두 희토류 성분을 용매추출만으로 분리하기 위해서는 수십단의 추출단수가 필요하다. 희토류 원자번호가 증가할수록 이온반경이 감소하여 전하밀도가 증가한다. 따라서 터븀(III)보다는 디스프로슘(III)이 유기인산계 추출제에 추출되려는 경향이 강하다. 이러한 추출경향의 차이를 이용하는 이온교환반응의 일종인 세정공정을 적용하면 비교적 적은 추출단수와 세정만으로 금속을 분리하는 것이 가능하다 [14,15]. 그러나 Cyanex 272를 기반으로 하는 추출제를 사용하여 터븀(III)과 디스프로슘(III)의 추출과 세정에 대한 분리 연구결과는 거의 발표된 바 없다.
본 논문에서는 염산용액에서 터븀(III)과 디스프로슘(III)을 분리하기 위해 Caynex 272를 기반으로 한 추출제를 사용하여 분리실험을 수행했다. 즉, Cyanex 272 단독과 Alamine 336을 혼합한 추출제, Cyanex 272와 Aliquat 336으로 제조한 이온성액체(R4NA)를 사용하여 용액의 pH에 따른 두 금속의 추출과 분리거동을 조사하였다. 상기 세 종류 추출제 가운데 금속 추출효율이 가장 높은 이온성액체를 사용하여 추출 및 세정에 의한 두 금속의 분리조건을 조사하였다. 또한 McCabe-Thiele 세정곡선으로부터 교차식(Cross current)으로 다단세정을 모사하여 99%이상의 순도를 지닌 디스프로슘(III)용액을 얻었다.
2. 실험재료 및 실험방법
2.1 실험재료
본 실험에서는 고순도의 염화터븀(TbCl3, Alfa aesar, USA, 99.9%)과 염화디스프로슘(DyCl3, Alfa aesar, USA, 99.9%)을 증류수에 용해시켜 두 금속이 함유된 혼합용액을 제조하였다. 혼합용액의 pH를 조절하기 위해 염산(Daejung chemicals & metals Co. Ltd., Korea, 35%)과 수산화나트륨(Duksan Co. Ltd., Korea, 93%)용액을 사용하였다. 추출제로는 Cyanex 272(Cytec Inc., USA, 85%)를 선택하여 3차 아민인 Alamine 336(BASF Co. Ltd., Germany, 95%)과 1:1의 비율로 혼합하여 혼합 추출제를 준비하였다. 한편 이온성액체는 Cyanex 272와 4차 아민인 Alaiquat 336(BASF Co. Ltd., Germany, 93%)을 Fortuny의 방법으로 제조하였다 [16]. 본 실험에서 모든 시약은 정제하지 않고 그대로 사용했고 등유(Deajung Chemicals & Metals Co. Ltd., Korea, 100%)를 희석제로 사용하였다.
2.2 실험방법
터븀(III)과 디스프로슘(III)의 농도가 각각 100 mg/L인 혼합용액을 추출실험에 사용하였다. 수상과 유기상의 부피가 동일한 조건에서 두 상의 혼합물을 분액여두에 넣고 상온에서 wrist action shaker를 이용하여 30분간 교반한 뒤 30분간 정치하여 수상과 유기상을 분리하였다. 추출반응 전후 수상의 pH는 pH미터(pH Meter, Orion Star A211, Thermo Fisher Scientific, USA)로 측정했다. 추출반응 후 수상에 존재하는 터븀(III)과 디스프로슘(III)의 농도는 ICP(Inductively Coupled Plasma-Optical Emission Spectormeter, Acros, Spectro, Germany)로 분석하였고, 유기상으로 추출된 금속 농도는 물질수지로 구했다. 금속의 추출율(Extraction percentage)과 분리인자(Separation factor)는 각각 다음 식으로 계산하였다 [17].
상기 식에서 mini는 초기 수상에서 금속의 질량을, meq는 평형 상태에서 수상 내 금속 질량을 나타낸다. 분리인자에서 DDy(III)와 DTb(III)는 디스프로슘(III)와 터븀(III)의 분배계수(Distribution coefficient)를 나타낸다.
3. 결과 및 고찰
3.1 터븀(III)과 디스프로슘(III)의 용매추출에 대한 미치는 평형 pH 영향
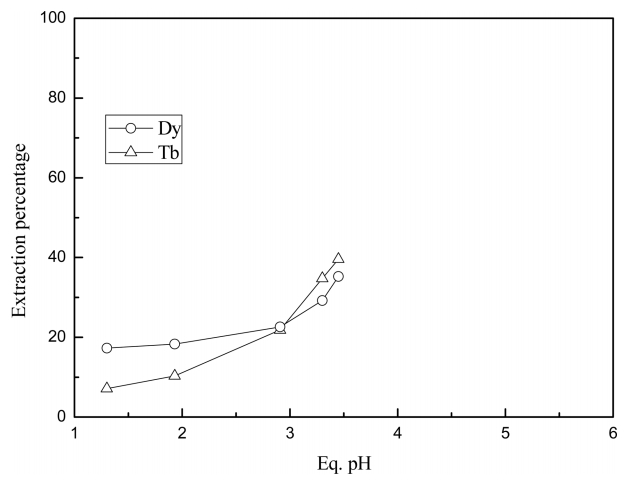
Cyanex 272를 기반으로 한 추출제를 사용시 평형 pH에 따른 터븀(III)과 디스프로슘(III)의 추출 및 분리거동을 조사했다. 이러한 목적을 위해 두 금속이온이 혼합된 염산용액의 초기 pH를 1.5부터 5까지 변화시켜 Cyanex 272 단독, Cyanex 272와 Alamine 336의 혼합추출제(R3NHA)와 Aliquat 336으로 제조한 이온성액체(R4NA)로 실험을 수행했다. 본 논문의 모든 실험에서 터븀(III)과 디스프로슘(III)의 농도가 각각 100 mg/L인 혼합용액을 사용하였다. 희토류금속 농도를 감안하여 추출제 농도는 모두 0.003 M로 고정시켰으며 실험결과를 그림 1, 2, 3에 나타냈다. Cyanex 272를 단독으로 사용시 결과인 그림 1에 의하면 평형 pH가 증가함에 따라 터븀(III)과 디스프로슘(III)의 추출률이 각각 10%에서 40%, 20%에서 38%까지 증가하였다. 평형 pH가 3이하의 조건에서는 디스프로슘(III)의 추출률이 터븀(III)의 추출률보다 약간 높았으나, 그 이상의 조건에서는 터븀(III)의 추출률이 미세하게 높았다. 일반적으로 희토류 금속이온의 원자번호가 증가할수록 이온반경이 감소하여 전하밀도가 증가하므로 디스프로슘(III)이 터븀(III)보다 추출률이 더 높아야 한다. 그림 1과 같이 평형 pH 3이상의 조건에서 터븀(III)의 추출률이 디스프로슘(III)의 추출률보다 약간 큰 것은 이러한 조건에서는 이온반경의 증감에 따른 전하밀도의 영향이 작다고 생각할 수 있다. 따라서 Cyanex 272를 단독으로 사용한 조건에서 두 금속의 분리는 매우 어렵다는 것을 그림 1에서 알 수 있다. Cyanex 272에 의한 희토류원소의 추출 반응은 다음과 같이 나타낼 수 있다 [5-7].
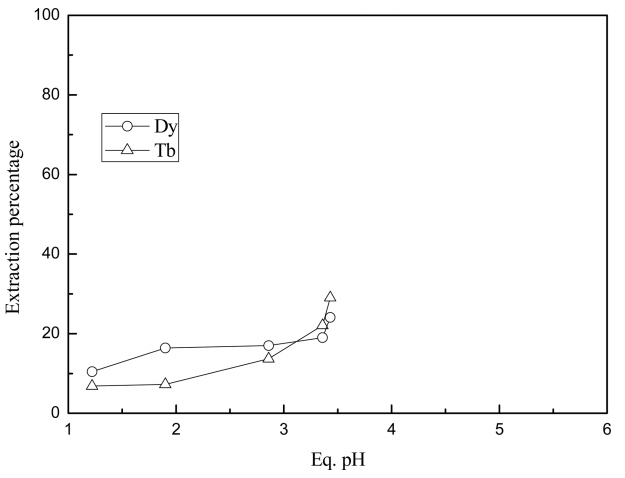
상기 식에서 (HA)2는 Cyanex 272의 중합체를 나타낸다. Cyanex 272와 Alamine 336의 혼합추출제에 의한 실험 결과를 그림 2에 나타냈다. 혼합추출제에서 두 추출제의 농도는 0.003 M로 동일하였다. 그림 1과 2를 비교하면 평형 pH의 증가에 따른 터븀(III)과 디스프로슘(III)의 추출률의 증가율은 Cyanex 272를 단독으로 사용한 조건이 혼합추출제 조건보다 컸다. 이는 Cyanex 272와 Alamine 336의 혼합추출제에서는 Alamine 336에 의한 수소이온의 추출로 평형 pH 3이상의 조건에서 두 금속의 추출에 큰 영향을 미치기 때문으로 생각된다. 한편 Cyanex 272와 혼합추출제를 사용한 조건에서 평형 pH 3이상인 조건에서 터븀(II)의 추출률이 디스프로슘(III)의 추출률보다 약간 높았다.
선행 연구결과에 의하면 Cyanex 272와 Alamine 336을 혼합한 추출제로 희토류성분을 추출시 상승효과가 나타났으며, 상승효과는 혼합추출제의 조성에 의존한다 [18,19]. 본 실험 결과에서 Alamine 336을 Caynex 272에 혼합하더라도 터븀(III)과 디스프로슘(III)에 추출에 상승효과가 나타나지 않는 것은 혼합추출제의 조성과 관련 있다. Cyanex 272는 약산이고 Alamine 336은 약염기이므로 혼합추출제에서 산-염기 반응에 의해 염이 생성될 수 있다. 이와 같이 염이 생성되는 경우 추출반응에 참여할 수 있는 유효 Cyanex 272의 농도가 감소할뿐 아니라 수소이온과 반응하여 평형 pH의 감소를 억제시킬 수 있는 Alamine 336의 유효농도도 감소한다. 따라서 이러한 조건에서는 Alamine 336을 혼합하더라도 터븀(III)과 디스프로슘(III)의 추출에 상승효과가 나타나지 않는다.
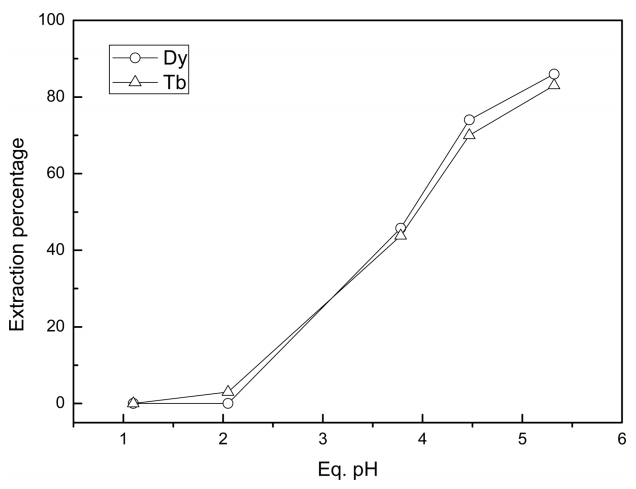
Cyanex 272와 Aliquat 336으로 제조한 이온성액체에 의한 추출결과를 그림 3에 나타냈다. 평형 pH 3이하에서는 두 금속이 거의 추출되지 않은 반면 평형 pH 4 이상에서 두 금속의 추출율이 급격하게 증가했다. 또한 이온성액체에서는 평형 pH가 초기 pH에 비해 모두 증가했다. 이온성 액체에 위한 희토류이온과 염산의 추출반응은 다음과 같이 나타낼 수 있다 [16].
평형 pH가 3 이하의 조건에서 터븀(III)과 디스프로슘(III)이 거의 추출되지 않는 것은 이온성액체가 터븀(III)과 디스프로슘(III)을 추출하지 않고 수소이온을 선택적으로 추출하는 것과 관련 있다 [16]. 이온성액체를 사용시에도 터븀(III)과 디스프로슘(III)의 평형 pH에 따른 추출률은 유사하므로 단순히 추출만으로 두 금속을 분리하기는 매우 어렵다. 그러나 Cyanex 272를 단독 또는 Alamine 336과의 혼합추출제로 사용하는 조건에 비해 이온성액체형태로 사용하는 경우 두 금속의 추출률이 80%까지 증가하여 더 높은 추출률을 얻었다.
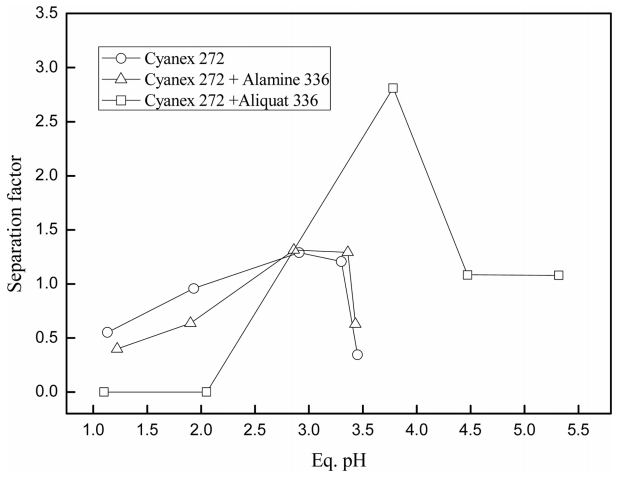
Cyanex 272 단독, Alamine 336과의 혼합추출제, Aliquat 336과의 이온성액체 형태로 사용시 터븀(III)과 디스프로슘(III)간의 평형 pH에 따른 분리인자의 변화를 그림 4에 나타냈다. Cyanex 272와 Alamine 336로 혼합한 추출제에서는 평형 pH 2.8에서 분리인자가 1.2로 가장 높았으나, 이온성액체의 경우 평형 pH 3.8에서 분리인자가 2.8로 가장 높았다. Cyanex 272의 세 형태에서 희토류성분의 추출률은 Cyanex 272 + Aliquat 336 > Cyanex 272 > Cyanex 272 + Alamien 336 순으로 높았다. 유기인산계 추출제를 사용하는 경우 수상의 터븀(III)과 디스프로슘(III)이 추출제의 수소이온과 교환되어 유기상으로 추출된다. 이때 추출제로부터 수상으로 이동한 수소이온에 의해 평형 pH가 낮아지므로 추출구동력이 감소하여 추출률이 작다. 수상에서 수소이온은 가장 강력한 산(acid)이므로 염기성인 이온성액체의 음이온과 산-염기 반응을 하려는 경향이 매우 강하다. 따라서 희토류 금속이온뿐 아니라 수소이온도 이온성액체에 추출되므로 평형 pH가 증가하여 추출구동력이 유지되면서 추출률도 높다. 분리인자 역시 이온성액체가 가장 높았으므로 이온성액체를 사용하여 추가실험을 진행했다.
3.2 이온성액체에 추출된 터븀(III)과 디스프로슘(III)의 세정에 의한 분리
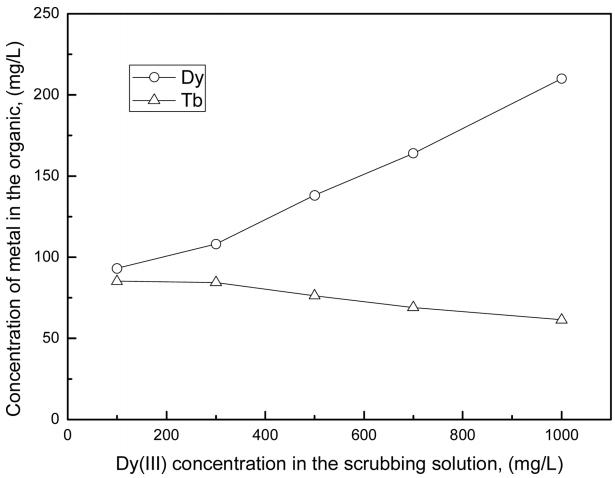
본 실험에서는 사용한 Cyanex 272의 세 형태중에서 이온성액체가 추출률이 가장 높았지만 분리 측면에서는 큰 효과가 없었다. 따라서 이러한 조건에서는 터븀(III)과 디스프로슘(III)을 모두 추출한 다음 세정으로 분리하는 것이 효과적일 수 있다. 따라서 세정에 의한 두 금속의 분리거동을 조사했다. 먼저 두 금속이 추출된 유기상을 준비하기 위해 초기 pH가 5인 희토류 혼합용액을 0.003 M의 이온성액체로 추출하였다. 이때 터븀(III)과 디스프로슘(III)의 추출률은 각각 83%과 86%로 유기상에서 두 금속의 농도는 83 mg/L과 86 mg/L이었다. 터븀(III)보다는 디스프로슘(III)이 전하밀도가 크므로 세정액으로 디스프로슘(III)의 농도를 100 mg/L에서 1000 mg/L까지 변화시켜 세정액과 유기상의 부피가 동일한 조건에서 세정실험한 결과를 그림 5에 나타냈다. 또한 세정액에서 디스프로슘(III)의 농도에 따른 터븀(III)의 세정율 및 디스프로슘(III)의 순도 변화를 표 1에 같이 나타냈다. 세정액에서 디스프로슘(III)의 농도가 100 mg/L에서 1000 mg/L으로 증가함에 따라 터븀(III)의 세정율은 2.9%에서 26.5%로 증가하였다. 한편 이온성액체에서의 디스프로슘(III)농도는 93 mg/L에서 210 mg/L까지 증가하여 순도가 52.3%에서 77.4%까지 증가했다. 본 세정 실험에서 일어나는 반응을 다음에 나타냈다.
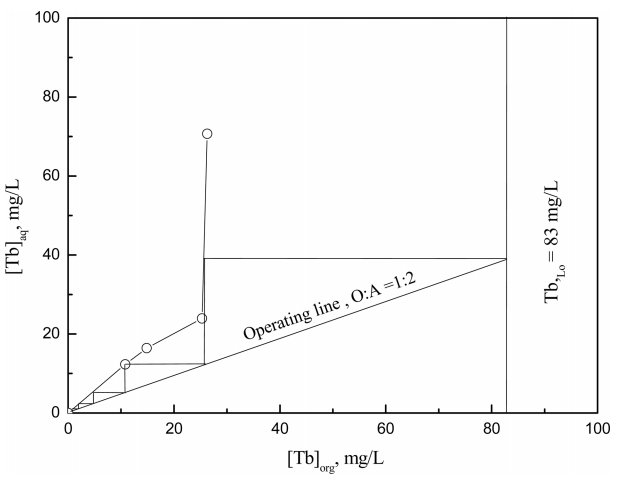
터븀(III)과 디스프로슘(III)을 분리하는 데 필요한 세정단수를 구하기 위해 McCabe-Thiele 세정곡선을 구했다. 이러한 목적을 위해 터븀(III)과 디스프로슘(III)이 추출된 0.003 M의 이온성액체와 디스프로슘(III)의 농도가 1000 mg/L인 세정액의 부피비를 7부터 1/5까지 변화시켰다. 본 실험에서 구한 McCabe-Thiele 세정곡선을 그림 6에 나타냈다. 이온성액체에서 터븀(III)의 농도가 83 mg/L인 경우 이온성액체와 세정액의 부피비(O/A)가 2인 조건에서 5단의 세정을 행하면 유기상에 함유된 터븀(III)을 99% 이상 세정하는 것이 가능하다.
3.3 다단식 세정 실험
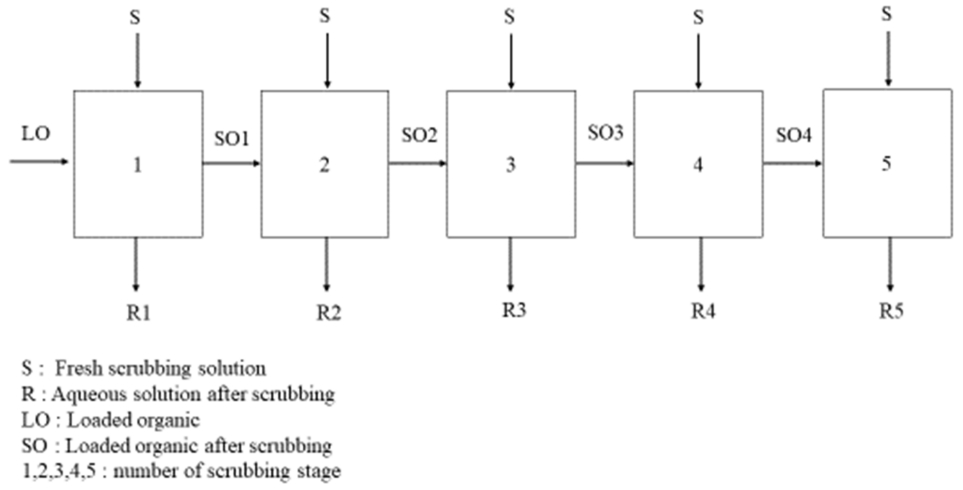
그림 6의 McCabe-Thiele세정곡선에 의하면 적어도 5단 이상의 세정을 행해야 터븀(III)이 83 mg/L이 함유된 이온성액체로부터 터븀(III)을 디스프로슘(III)으로 세정하는 것이 가능하다. 5단 이상을 역류식(Counter-current)으로 모사 실험하는 것은 어려우므로 본 논문에서는 교차식 세정방법으로 세정단수에 따른 터븀(III)의 세정율과 이온성액체에서 디스포르슘(III)의 순도 변화를 조사하였다. 교차식(Cross-current) 세정방법은 회분식 실험을 연속적으로 행하는 방법으로 세정액과 유기상의 접촉방법을 그림 8에 나타냈다. 금속이온이 추출된 유기상을 세정액으로 세정 후 유기상을 다시 새로운 세정액으로 세정하여 두 금속의 분리성을 향상시킨다. 먼저 희토류이온의 농도가 100 mg/L인 염산 혼합용액의 초기 pH를 5로 조절하여 0.003 M의 이온성액체로 추출하여 유기상을 준비하였다. 이때 이온성액체에 터븀(III)은 83%, 디스프로슘(III)은 86% 추출되었다. 1000 mg/L의 디스프로슘(III)용액으로 6단까지 교차식으로 세정시 세정단수에 따른 실험결과를 그림 7에 나타냈다. 세정단수가 6단으로 증가함에 따라 터븀(III)의 세정율은 24%에서 95%까지 증가했으며, 이온성액체에서 디스프로슘(III)의 농도는 686 mg/L까지 증가하였다. 6단의 교차식 세정 후 유기상에는 3.2 mg/L의 터븀(III)이 잔존하여 이온성액체에서 디스프로슘(III)의 순도는 99.5%에 도달하였다. 따라서 Cyanex 272와 Aliquat 336으로 제조한 이온성액체를 추출제로 사용하는 경우 터븀(III)과 디스프로슘(III)을 모두 추출한 다음 디스프로슘(III)용액을 세정액으로 사용하면 교차식 세정의 경우 6단에서 99%이상의 순도를 지닌 디스프로슘(III)이 함유된 이온성액체를 얻을 수 있다. 이온성액체로부터 디스프로슘(III)을 탈거하여 순수한 디스프로슘(III) 화합물을 제조할 수 있다.
4. 결 론
염산용액에서 터븀(III)과 디스프로슘(III)을 분리하기 위해 용매추출실험을 수행했다. 본 논문에서는 유기인산계 추출제인 Cyanex 272를 선택하여 Cyanex 272 단독, Alamine 336과 혼합추출제 그리고 Aliquat 336으로 제조한 이온성액체를 사용하여 용액의 pH에 따른 두 금속의 추출률과 분리거동을 조사하였다. 두 금속이 혼합된 염산용액의 초기 pH 1.5에서 5사이의 범위에서 상기 세 Cyanex 272 기반 추출제에 의한 터븀(III)과 디스프로슘(III)의 추출률은 매우 비슷하였다. 본 실험조건에서 추출률과 분리인자 측면에서 이온성액체가 Cyanex 272 단독과 혼합추출제보다 우수하였다. 두 금속을 추출로 분리하기는 어려우므로 세정에 의한 두 금속의 분리실험을 수행했다. 이온성액체에 추출된 터븀(III)을 디스프로슘(III)용액으로 세정하는 McCabe-Thiele 곡선을 구했다. 두 금속을 분리하기 위해 이온성액체에 추출된 터븀(III)을 디스프로슘(III)으로 6단의 교차식 세정 실험을 수행했다. 세정단수가 6단으로 증가함에 따라 이온성액체에 추출되었던 터븀(III)이 디스프로슘(III)에 세정되어 이온성액체에서 디스프로슘(III)의 순도가 50%에서 99.5%까지 증가하였다. 본 연구결과를 이용하여 Fe-Nd-B계 자석에 미량 함유된 터븀과 디스프로슘을 분리해서 고순도로 회수하는 공정의 개발이 가능하다.