1. ņä£ ļĪĀ
ĒģģņŖżĒģÉņØĆ ĻĖłņåŹ ņżæ ņ£ĄņĀÉ(3,422 ┬░C)Ļ│╝ ļ╣äļō▒ņĀÉ(5,555 ┬░C)ņØ┤ Ļ░Ćņן ļåÆņØĆ ņøÉņåīļĪ£ ņ”ØĻĖ░ņĢĢņØ┤ ņĢäņŻ╝ ļé«ņØĆ ņä▒ņ¦łņØä ļéśĒāĆļé┤ļ®░ ņāüņś©ņŚÉņä£ ļ¼╝, ņé░ņä▒/ņŚ╝ĻĖ░ņä▒ ņÜ®ņĢĪĻ│╝ ļ░śņØæĒĢśņ¦Ć ņĢŖļŖö ļåÆņØĆ ņĢłņĀĢņä▒ņØä Ļ░¢Ļ│Ā ņ׳ļŗż [1-2]. ņØ┤ļ¤¼ĒĢ£ Ļ│Āņś© ĒŖ╣ņä▒ ļ░Å ĒÖöĒĢÖņĀü ņĢłņĀĢņä▒ņ£╝ļĪ£ ņØĖĒĢ┤ ĒģģņŖżĒģÉņØĆ ņĀäĻĄ¼ ĒĢäļØ╝ļ®śĒŖĖ, XņäĀ ĒŖ£ļĖī, ņĢäĒü¼ ņÜ®ņĀæņÜ® ņĀäĻĘ╣ ņ×¼ļŻī, ņ┤łĒĢ®ĻĖł ņøÉņåī, ļ░®ņé¼ņäĀ ņ░©ĒÅÉņÜ® ļ¼╝ņ¦łļĪ£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ņ£╝ļ®░ Ļ│Āļ░ĆļÅä(19.25 g/cm3)ņÖĆ Ļ│ĀĻ▓ĮļÅä ĒŖ╣ņä▒ņ£╝ļĪ£ ņżæĒĢ®ĻĖł Ļ┤ĆĒåĄņ×É ņåīņ×¼ļĪ£ ņĀüņÜ®ļÉśĻ│Ā ņ׳ļŗż [3-5]. ļśÉĒĢ£ ļåÆņØĆ ņ£ĄņĀÉ, ļåÆņØĆ ņŚ┤ņĀäļÅäņ£©, ļé«ņØĆ ņé╝ņżæņłśņåī ņ×öļźś, ļé«ņØĆ ļČĆņŗØļźĀņÖĆ Ļ░ÖņØĆ ņןņĀÉņ£╝ļĪ£ ĒĢĄņ£ĄĒĢ®ļĪ£ņØś ĒöīļØ╝ņ”łļ¦ł ļīĆĒ¢ź ļ¼╝ņ¦łļĪ£ ĒģģņŖżĒģÉņØ┤ ņĀüĒĢ®ĒĢĀ Ļ▓āņ£╝ļĪ£ ĻĖ░ļīĆļÉśĻ│Ā ņ׳ļŗż [6-11]. ĒöīļØ╝ņ”łļ¦ł ļīĆĒ¢ź ļ¼╝ņ¦łņØĆ ņØ┤ņś© ņĪ░ņé¼, ļåÆņØĆ Ļ│ĀņŚ┤ ņ£ĀņåŹĻ│╝ Ļ░ÖņØĆ Ļ░ĆĒś╣ĒĢ£ ĒöīļØ╝ņ”łļ¦ł ņĪ░Ļ▒┤ņŚÉņä£ ņé¼ņÜ®ļÉśĻĖ░ ļĢīļ¼ĖņŚÉ ņĀüņÜ® Ļ░ĆļŖźĒĢ£ ņ×¼ļŻīĻ░Ć ņĀ£ĒĢ£ļÉĀ ņłśļ░¢ņŚÉ ņŚåļŖöļŹ░ Ēśäņ×¼ ļé«ņØĆ ļ│Ąņé¼ ņåÉņŗżļźĀ, ļåÆņØĆ ņ£ĄņĀÉ, ļé«ņØĆ ļ╣äņżæ, ņÜ░ņłśĒĢ£ ņŚ┤ņĀäļÅäņ£©ļĪ£ Ēāäņåī ņ×¼ļŻīĻ░Ć ĒöīļØ╝ņ”łļ¦ł ļīĆĒ¢ź ļ¼╝ņ¦łļĪ£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż [12]. ĒĢśņ¦Ćļ¦ī Ēāäņåī ņ×¼ļŻīļŖö ĒĢĄņ£ĄĒĢ®ļĪ£ņØś Ļ░ĆļÅÖ ņś©ļÅäņŚÉņä£ ļČĆņŗØņ£©ņØ┤ ļåÆņØĆ ņØ┤ņ£ĀļĪ£ ņżæņä▒ņ×ÉņŚÉ ņØśĒĢ£ ņŗ¼Ļ░üĒĢ£ ņŚ┤ņĀäļÅäņ£© ņĀĆĒĢśĻ░Ć ļ░£ņāØĒĢĀ ņłś ņ׳ņ¢┤ Ēāäņåī ņ×¼ļŻīņŚÉ ļīĆĒĢ£ ĒģģņŖżĒģÉ ļīĆņ▓┤ ĒĢäņÜöņä▒ņØ┤ ņ”ØļīĆļÉśĻ│Ā ņ׳ļŗż [6]. ĒöīļØ╝ņ”łļ¦ł ļīĆĒ¢ź ļ¼╝ņ¦łļĪ£ņä£ ĒģģņŖżĒģÉņŚÉ ļīĆĒĢ£ ĒÅēĻ░ĆļŖö ņŻ╝ļĪ£ Ļ▓ĮļÅä ĒŖ╣ņä▒ņØä ņ¦ĆĒæ£ļĪ£ ĒĢśņŚ¼ ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā ņ׳ļŖöļŹ░ Ļ▓ĮļÅä ĒŖ╣ņä▒ņØ┤ ņÜ░ņłśĒĢĀņłśļĪØ ĒöīļØ╝ņ”łļ¦ł ņĪ░Ļ▒┤ņŚÉņä£ ņØ┤ņś© ņĪ░ņé¼ņÖĆ ņŚ┤ ņŚÉļäłņ¦ĆņŚÉ ņØśĒĢ£ ļ¦łļ¬© ļ░£ņāØ Ļ░ĆļŖźņä▒ņØ┤ ņ×æņĢäņ¦ĆĻĖ░ ļĢīļ¼ĖņØ┤ļŗż [6-11].
ĒģģņŖżĒģÉņØĆ ĒÜīņżæņäØņŚÉ ļīĆĒĢ£ ņĀ£ļĀ© Ļ│╝ņĀĢĻ│╝ ņ┤łĻ▓ĮĒĢ®ĻĖł ņŖ¼ļ¤¼ņ¦Ć ņ×¼ĒÖ£ņÜ® Ļ│ĄņĀĢņØä ĒåĄĒĢ┤ ņĀ£ņĪ░ļÉśļŖöļŹ░ ņØ┤ļĢī ņĀäĒåĄņĀüņ£╝ļĪ£ ļ¬ć ļŗ©Ļ│äļź╝ Ļ▒░ņ╣śĻ▓ī ļÉ£ļŗż [13]. ļ©╝ņĀĆ ņŚ╝ņé░ ņ▓śļ”¼ļź╝ ĒåĄĒĢ┤ ņ╣╝ņŖśņØä ļ░░ņĀ£ĒĢ£ ĒÜīņżæņäØ Ēś╣ņØĆ ņ┤łĻ▓ĮĒĢ®ĻĖł ņŖ¼ļ¤¼ņ¦Ćļź╝ Ēāäņé░ļéśĒŖĖļź©(Na2CO3) ļśÉļŖö ņłśņé░ĒÖöļéśĒŖĖļź©(NaOH) ņÜ®ņĢĪņØä ņé¼ņÜ®ĒĢśņŚ¼ ņĀĢņĀ£ļÉ£ ĒģģņŖżĒģÉņé░ ļéśĒŖĖļź©(Na2WO4) ņÜ®ņĢĪņ£╝ļĪ£ ļ│ĆĒÖöņŗ£Ēé©ļŗż. ņØ┤Ēøä ĒģģņŖżĒģÉņé░ļéśĒŖĖļź© ņÜ®ņĢĪņØĆ ņØ┤ņś©ĻĄÉĒÖś Ļ│╝ņĀĢņØä Ļ▒░ņ│É ĒģģņŖżĒģÉĻ│╝ ļéśĒŖĖļź©ņØ┤ ļČäļ”¼ļÉśĻ│Ā, ņØ┤ņś©ĻĄÉĒÖś ņłśņ¦ĆņŚÉ ĒØĪņ░®ļÉśņ¢┤ ņ׳ļŖö ĒģģņŖżĒģÉņØĆ ņĢöļ¬©ļŗłņĢäņÖĆņØś ļ░śņØæņØä ĒåĄĒĢ┤ ĒģģņŖżĒģÉņé░ņĢöļ¬©ļŖä ņÜ®ņĢĪņ£╝ļĪ£ ļ│ĆĒÖöĒĢśĻ▓ī ļÉ£ļŗż. ņØ┤Ēøä ņĢöļ¬©ļŗłņĢäņŚÉ ļģ╣ņĢäņ׳ļŖö ĒģģņŖżĒģÉņØä Ļ▓░ņĀĢĒÖö ņŗ£ĒéżĻĖ░ ņ£äĒĢ£ ņ”Øļ░£ ļåŹņČĢ Ļ│╝ņĀĢņØä Ļ▒░ņ│É ņ¢╗ņ¢┤ņ¦ĆļŖö ļČäļ¦ÉņØä ĒģģņŖżĒģÉņé░ņĢöļ¬©ļŖä(APT, Ammonium paratungstate)ņØ┤ļØ╝ ĒĢśļ®░ ĒģģņŖżĒģÉņé░ņĢöļ¬©ļŖäņŚÉ ļīĆĒĢ£ 600 ┬░C ņŚ┤ņ▓śļ”¼ļź╝ ĒåĄĒĢ┤ ņĢöļ¬©ļŗłņĢäļź╝ ļČäĒĢ┤ĒĢśĻ▓ī ļÉśļ®┤ ņé░ĒÖö ĒģģņŖżĒģÉ(WO3)ņØ┤ ņāØņä▒ļÉśĻ▓ī ļÉ£ļŗż. ņĄ£ņóģņĀüņ£╝ļĪ£ ņé░ĒÖö ĒģģņŖżĒģÉņØä 850 ┬░C ņØ┤ņāüņØś ņś©ļÅäņÖĆ ĒÖśņøÉ ļČäņ£äĻĖ░(ņłśņåī ļśÉļŖö Ēāäņåī)ņŚÉņä£ ņŚ┤ņ▓śļ”¼ĒĢśĻ▓ī ļÉśļ®┤ ĒģģņŖżĒģÉņØ┤ ņ¢╗ņ¢┤ņ¦äļŗż. ĒģģņŖżĒģÉ ņĀ£ņĪ░ Ļ│╝ņĀĢņŚÉņä£ Ēł¼ņ×ģļÉśĻ│Ā ļ░£ņāØļÉśļŖö ļ¼╝ņ¦łņŚÉņä£ ņĢī ņłś ņ׳ļō»ņØ┤ ĒģģņŖżĒģÉ ņĀ£ņĪ░ Ļ│ĄņĀĢņŚÉņä£ļŖö ņĢöļ¬©ļŗłņĢäļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ĒÖśĻ▓ĮņĀüņ£╝ļĪ£ ņ£ĀĒĢ┤ĒĢ£ ņä▒ļČäņØ┤ ļŗżļ¤ē ļ░£ņāØĒĢśĻ▓ī ļÉ£ļŗż. ļö░ļØ╝ņä£ ĒÖśĻ▓Į ĻĘ£ņĀ£Ļ░Ć ņŚäĻ▓®ĒĢ£ ĻĄŁĻ░ĆņŚÉņä£ļŖö ĒģģņŖżĒģÉ ņĀ£ņĪ░ Ļ│ĄņĀĢņØ┤ ĒŚłĻ░ĆļÉśņ¦Ć ņĢŖĻ│Ā ļīĆļČĆļČäņØś ĒģģņŖżĒģÉņØĆ ņżæĻĄŁņŚÉņä£ ņāØņé░ļÉśĻ│Ā ņ׳ņ¢┤ ĻĄŁļé┤ ĒģģņŖżĒģÉ Ļ┤ĆļĀ© ņŚģņ▓┤ļōżņØĆ ņøÉļŻīļź╝ ņżæĻĄŁņŚÉņä£ ņĀäļ¤ē ņłśņ×ģĒĢśĻ│Ā ņ׳ļŖö ņŗżņĀĢņØ┤ļŗż [14].
ĒģģņŖżĒģÉņØĆ ņĢ×ņä£ ņ¢ĖĻĖēĒĢ£ ļ░öņÖĆ Ļ░ÖņØ┤ ņ£ĄņĀÉņØ┤ ļåÆņĢä ņØ╝ļ░śņĀüņØĖ ņÜ®ĒĢ┤ Ļ│╝ņĀĢņØä ĒåĄĒĢ┤ ņ×ēĻ││ņØä ņĀ£ņ×æĒĢĀ ņłś ņŚåļŗż. ļīĆņŗĀ ĒģģņŖżĒģÉ ļČĆĒÆłņØĆ ļČäļ¦É ņĢ╝ĻĖł Ļ│ĄņĀĢņØä ĒåĄĒĢ┤ņä£ ņĀ£ņĪ░ļÉśĻ▓ī ļÉśļŖöļŹ░ ļČäļ¦É ņĢ╝ĻĖł Ļ│ĄņĀĢņØĆ Ļ│Āņ£ĄņĀÉ ĻĖłņåŹņØ┤ļéś ņäĖļØ╝ļ»╣ņŖżļź╝ ņåīņ×¼ĒÖö ĒĢĀ ļĢī ĒÖ£ņÜ®ļÉśļŖö Ļ│ĄņĀĢņ£╝ļĪ£ ņøÉņ×¼ļŻīļŖö ļČäļ¦É ĒśĢĒā£ņØ┤ļ®░ ļČäļ¦ÉņŚÉ ļīĆĒĢ£ ņĢĢņČĢ ņä▒ĒśĢ Ēøä ņØ┤ļź╝ ņåīĻ▓░ņØ┤ļØ╝ļŖö Ļ│╝ņĀĢņØä ĒåĄĒĢ┤ ļŗ©ļŗ©ĒĢ£ ĒśĢņāüņØä ļ¦īļōżņ¢┤ ļé┤Ļ▓ī ļÉ£ļŗż [15-17]. ņåīĻ▓░ņØĆ ļČäļ¦É ņä▒ĒśĢņ▓┤ņŚÉ ļīĆĒĢ£ ņŚ┤ņ▓śļ”¼(ņÜ®ņ£Ą ņś©ļÅä ņØ┤ĒĢśņØś ņś©ļÅä)ļź╝ ĒåĄĒĢ┤ ņ╣śļ░ĆĒÖö ĒĢśļŖö Ļ│╝ņĀĢņ£╝ļĪ£ ļČäļ¦É ļé┤ ņ×ģņ×ÉļōżņØś ļČłņĢłņĀĢĒĢ£ Ēæ£ļ®┤ņĀü Ļ░ÉņåīĻ░Ć ĻĄ¼ļÅÖļĀźņ£╝ļĪ£ ņ×æņÜ®ĒĢśĻ▓ī ļÉ£ļŗż. ņ”ē, ļČäļ¦ÉņØ┤ ņä▒ĒśĢļÉ£ Ēøä ņŚ┤ņ▓śļ”¼ļź╝ ĒåĄĒĢ┤ ņä▒ĒśĢņ▓┤ ļé┤ ļ╣ł Ļ│ĄĻ░ä(ĻĖ░Ļ│Ą)ņØ┤ ņłśņČĢļÉśĻ│Ā ņé¼ļØ╝ņ¦Ćļ®┤ņä£ ļ░ĆļÅäĻ░Ć ļåÆņĢäņ¦ĆļŖö Ļ│╝ņĀĢņØ┤ ņåīĻ▓░ņØ┤ļ®░ ņåīĻ▓░ņØ┤ ņØ╝ņ¢┤ļéśļŖö ĻĖ░ĻĄ¼ļŖö ļ¼╝ņ¦łņØä ĻĄ¼ņä▒ĒĢśĻ│Ā ņ׳ļŖö ņøÉņ×ÉļōżņØś ĒÖĢņé░ņ×äņØ┤ ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņ×ÉļōżņŚÉ ņØśĒĢ┤ ņ”Øļ¬ģļÉśņŚłļŗż [18-19]. ņåīĻ▓░ ņżæ ņøÉņ×ÉļōżņØś ĒÖĢņé░ņØĆ ļČäļ¦É Ēæ£ļ®┤ņØ┤ļØ╝ ĒĢĀ ņłś ņ׳ļŖö ņ×ģĻ│äņØś ņŚŁĒĢĀņØ┤ ņżæņÜöĒĢ£ļŹ░ ņ×ģĻ│äļŖö ņåīĻ▓░ ņżæ ņ╣śļ░ĆĒÖöņÖĆ ņłśņČĢņØ┤ ņØ╝ņ¢┤ļéĀ ņłś ņ׳ļŖö ļ¼╝ņ¦ł ņØ┤ļÅÖņØś ņøÉņ▓£ņØ┤ ļÉ£ļŗż. ļö░ļØ╝ņä£ ņ×ģĻ│äņØś ĻĄ¼ņĪ░ļŖö ņåīĻ▓░ Ļ│╝ņĀĢņŚÉņä£ ļ¼╝ņ¦ł ņØ┤ļÅÖ ņåŹļÅäļź╝ Ļ▓░ņĀĢĒĢśĻ│Ā ņĀäņ▓┤ņĀüņØĖ ņåīĻ▓░ Ļ▒░ļÅÖņØä ņ¦Ćļ░░ĒĢśļŖö ņŻ╝ņÜö ņÜöņØĖņØ┤ ļÉśĻ▓ī ļÉ£ļŗż [15]. ņØ╝ļ░śņĀüņ£╝ļĪ£ Ēæ£ļ®┤ņØś ņøÉņ×É ļ░░ņŚ┤ņØ┤ ļČłĻĘ£ņ╣ÖĒĢśņŚ¼ ĻĄ¼ĒśĢ ĒśĢņāüņØä Ļ░¢ļŖö ļČäļ¦ÉņØ┤ ņåīĻ▓░ņä▒ņØ┤ ņÜ░ņłśĒĢśĻ│Ā ļ░śļīĆļĪ£ Ēæ£ļ®┤ņØś ņøÉņ×É ļ░░ņŚ┤ņØ┤ ĻĘ£ņ╣ÖņĀüņØ┤ņ¢┤ņä£ Ļ░üņ¦ä ĒśĢņāüņØä Ļ░¢ļŖö ļČäļ¦ÉņØĆ ņåīĻ▓░ņä▒ņØ┤ ļ¢©ņ¢┤ņ¦ĆļŖöļŹ░ ĻĘĖ ņØ┤ņ£ĀļŖö Ēæ£ļ®┤ņŚÉņä£ņØś ņøÉņ×É ĒÖĢņé░ņØ┤ ĻĄ¼ĒśĢņØś ļČäļ¦ÉņŚÉņä£ ņāüļīĆņĀüņ£╝ļĪ£ ņøÉĒÖ£ĒĢśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņØś ļ¼╝ņä▒ņØĆ ņåīĻ▓░ Ēøä ņĄ£ņóģ ļ░ĆļÅäņŚÉ ļö░ļØ╝ ļŗ¼ļØ╝ņ¦ĆĻ▓ī ļÉśļŖöļŹ░ ļ░ĆļÅäĻ░Ć ļåÆņØäņłśļĪØ ĒģģņŖżĒģÉ ņåīņ×¼ ĒŖ╣ņä▒(Ļ▓ĮļÅä)ņØ┤ ņÜ░ņłśĒĢśļŗż. ļö░ļØ╝ņä£ ĻĖ░Ļ│ĄņØ┤ ņĀ£Ļ▒░ļÉ£ ņÖäņĀä ņ╣śļ░ĆĒÖöļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ļź╝ ņĀ£ņĪ░ĒĢśļŖö Ļ▓āņØ┤ ĒģģņŖżĒģÉ ņåīĻ▓░ Ļ│╝ņĀĢņŚÉ ņ׳ņ¢┤ņä£ ņżæņÜöĒĢśļ®░ ĒģģņŖżĒģÉņØś ņåīĻ▓░ņä▒ņØĆ ņĢ×ņä£ ņ¢ĖĻĖēĒĢ£ Ļ▓āĻ│╝ Ļ░ÖņØ┤ ņøÉņ×¼ļŻīņØĖ ĒģģņŖżĒģÉ ļČäļ¦É ĒśĢņāüņØ┤ ĻĄ¼ĒśĢņØ╝ ļĢī ņÜ░ņłśĒĢĀ Ļ░ĆļŖźņä▒ņØ┤ Ēü¼ļŗż [6-11].
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒģģņŖżĒģÉ ņĀ£ņĪ░ Ļ│╝ņĀĢņŚÉņä£ ĒÖśĻ▓Į ņśżņŚ╝ Ļ░ĆļŖźņä▒ņØä ļé«ņČöĻĖ░ ņ£äĒĢ┤ ņĢöļ¬©ļŗłņĢäļź╝ ņé¼ņÜ®ĒĢśņ¦Ć ņĢŖĻ│Ā ĒģģņŖżĒģÉņé░ņĢöļ¬©ļŖä ĒśĢņä▒ ļŗ©Ļ│äĻ░Ć ņāØļץļÉ£ ņ╣£ĒÖśĻ▓Į ņ┤łĻ▓ĮĒĢ®ĻĖł ņŖ¼ļ¤¼ņ¦Ć ņ×¼ĒÖ£ņÜ® ļ░Å ĒģģņŖżĒģÉ ņĀ£ņĪ░ Ļ│ĄņĀĢņØä ņĀ£ņŗ£ĒĢśĻ│Āņ×É ĒĢ£ļŗż. ņĀ£ņŗ£ļÉśļŖö Ļ│ĄņĀĢņŚÉņä£ļŖö ĻĖ░ņĪ┤ Ļ│ĄņĀĢĻ│╝ ļŗ¼ļ”¼ ĒģģņŖżĒģÉņé░ņĢöļ¬©ļŖäņØś Ļ▓░ņĀĢĒÖö ļ░Å ņé░ĒÖö ĒģģņŖżĒģÉ ĒśĢņä▒ņØä ņ£äĒĢ£ ņŚ┤ņ▓śļ”¼ Ļ│╝ņĀĢņØ┤ ņāØļץļÉśĻ│Ā ĒģģņŖżĒģÉ ņé░(H2WO4)ņ£╝ļĪ£ļČĆĒä░ ĒģģņŖżĒģÉ ļČäļ¦ÉņØ┤ ĒśĢņä▒ļÉśĻ▓ī ļÉśņ¢┤ Ļ│ĄņĀĢ ļŗ©ņČĢ ĒÜ©Ļ│╝ļź╝ ĻĖ░ļīĆĒĢĀ ņłś ņ׳ļŗż. ļśÉĒĢ£ Ļ▓░ņĀĢĒÖöļÉ£ ņé░ĒÖö ĒģģņŖżĒģÉĻ│╝ ļŗ¼ļ”¼ ņ×ģņ×É ņä▒ņןņØ┤ ĒÖĢņŚ░ĒĢśņ¦Ć ņĢŖņØĆ ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ĒģģņŖżĒģÉ ļČäļ¦ÉņØ┤ ņĀ£ņĪ░ļÉśĻ▓ī ļÉśņ¢┤ ĒĢ®ņä▒ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦É ĒśĢņāüņØĆ ĻĖ░ņĪ┤ Ļ░üņ¦ä ĒśĢĒā£ņØś ĒģģņŖżĒģÉ ļČäļ¦ÉĻ│╝ ļŗ¼ļ”¼ ĻĄ¼ĒśĢņŚÉ Ļ░ĆĻ╣īņøīņ¦ł Ļ▓āņ£╝ļĪ£ ņśłņāüļÉśņŚłļŗż. Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ ĻĄ¼ĒśĢņŚÉ Ļ░ĆĻ╣īņÜ┤ ĒģģņŖżĒģÉ ļČäļ¦ÉņØĆ ņåīĻ▓░ņä▒ Ē¢źņāüņŚÉ ĻĖ░ņŚ¼ĒĢĀ Ļ▓āņ£╝ļĪ£ ņśłņĖĪļÉśņŚłņ£╝ļ®░ ņåīĻ▓░ņ▓┤ ĒŖ╣ņä▒(ļ░ĆļÅä ļ░Å Ļ▓ĮļÅä) ļ®┤ņŚÉņä£ ĻĖ░ņĪ┤ ņé░ĒÖö ĒģģņŖżĒģÉņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņÜ░ņłśĒĢĀ Ļ▓āņ£╝ļĪ£ ĻĖ░ļīĆļÉśņŚłļŗż.
2. ņŗżĒŚś ļ░®ļ▓Ģ
ĻĘĖļ”╝ 1ņØĆ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņĀ£ņŗ£ĒĢśļŖö ņ┤łĻ▓ĮĒĢ®ĻĖł ņŖ¼ļ¤¼ņ¦Ć ņ×¼ĒÖ£ņÜ® ļ░Å ĒģģņŖżĒģÉ ņĀ£ņĪ░ Ļ│ĄņĀĢņØä ļéśĒāĆļéĖ Ļ▓āņØ┤ļŗż. ņ┤łĻ▓ĮĒĢ®ĻĖł ņŖ¼ļ¤¼ņ¦ĆļŖö ņ┤łĻ▓ĮĒĢ®ĻĖł Ļ░ĆĻ│Ą ņżæņŚÉ ļ░£ņāØļÉśļ®░ Ļ░ĆĻ│Ą ņżæ Ēś╝ņ×ģļÉ£ ņĀłņéŁņ£ĀļŖö Ļ▒┤ņĪ░ Ļ│╝ņĀĢņØä ĒåĄĒĢ┤ ņĀ£Ļ▒░ļÉśņŚłļŗż.
2.1 ņ┤łĻ▓ĮĒĢ®ĻĖł ņŖ¼ļ¤¼ņ¦ĆļĪ£ļČĆĒä░ ĒģģņŖżĒģÉ ĒÜīņłś
ņĀłņéŁņ£ĀĻ░Ć ņĀ£Ļ▒░ļÉ£ ņ┤łĻ▓ĮĒĢ®ĻĖł ņŖ¼ļ¤¼ņ¦ĆļŖö Ēāäņé░ļéśĒŖĖļź©(Na2CO3)Ļ│╝ Ēś╝ĒĢ®ļÉśņŚłļŖöļŹ░ ņØ┤ ļĢī ņŖ¼ļ¤¼ņ¦ĆņÖĆ Ēāäņé░ļéśĒŖĖļź©ņØś ņ¦łļ¤ēļ╣äļŖö 1:0.6ņØ┤ņŚłņ£╝ļ®░ Ēś╝ĒĢ® Ēøä 930 ┬░CņŚÉņä£ 5ņŗ£Ļ░äņØś ņÜ®ņ£Ą Ļ│╝ņĀĢņØä ĒåĄĒĢ┤ ĒģģņŖżĒģÉņé░ļéśĒŖĖļź©ņØä ĒśĢņä▒ņŗ£ņ╝░ļŗż. Ļ│ĀņÜ® ņ£Ąņ£ĄņØ┤ ļüØļé£ ņÜ®ņ£Ąļ¼╝ņØä ņ”ØļźśņłśņŚÉ ņÜ®ĒĢ┤ņŗ£ĒéżĻ▓ī ļÉśļ®┤ ņłśņÜ®ņä▒ņØĖ ĒģģņŖżĒģÉņé░ļéśĒŖĖļź©ļ¦ī ņÜ®ĒĢ┤ļÉśĻ│Ā ņŚ¼Ļ│╝ ļ░Å ņäĖņĀĢņØä ĒåĄĒĢ┤ ņŖ¼ļ¤¼ņ¦ĆņŚÉ ĒżĒĢ©ļÉ£ ĻĖ░ĒāĆ ļČłņł£ļ¼╝ļōżņØä ņĀ£Ļ▒░ĒĢĀ ņłś ņ׳ļŗż. ĒģģņŖżĒģÉņé░ļéśĒŖĖļź© ņÜ®ņĢĪņ£╝ļĪ£ļČĆĒä░ ĒģģņŖżĒģÉ ņé░ņØä ņāØņä▒ņŗ£ĒéżĻĖ░ ņ£äĒĢ┤ ļ¼┤ĻĖ░ņé░ņØä Ēł¼ņ×ģĒĢśņŚ¼ Ļ▓░ņĀĢĒÖö Ļ│╝ņĀĢņØä Ļ▒░ņ│żĻ│Ā, ņØ┤Ēøä ļČłņł£ļ¼╝ ņäĖņ▓Ö Ļ│╝ņĀĢņØä Ļ▒░ņ╣£ Ēøä Ļ▒┤ņĪ░ ļ░Å Ēīīņćäļź╝ ĒåĄĒĢ┤ Ļ│Āņł£ļÅä ĒģģņŖżĒģÉ ņé░ ļČäļ¦ÉņØä ņ¢╗ņŚłļŗż.
2.2 ņłśņåī ĒÖśņøÉņŚÉ ņØśĒĢ£ ĒģģņŖżĒģÉ ļČäļ¦É ĒĢ®ņä▒
ņ┤łĻ▓ĮĒĢ®ĻĖł ņŖ¼ļ¤¼ņ¦ĆļĪ£ļČĆĒä░ ĒśĢņä▒ļÉ£ ĒģģņŖżĒģÉ ņé░ņØĆ ņłśņåī ļČäņ£äĻĖ░ ĒÖśņøÉņØä ĒåĄĒĢ£ ĒģģņŖżĒģÉ ļČäļ¦É ĒĢ®ņä▒ņÜ® ņøÉļŻīļĪ£ ņé¼ņÜ®ļÉśņŚłļŗż. ņØ┤ļĢī ņłśņåīļŖö ņ┤łĻ│Āņł£ļÅä ņłśņåī(> 99.999%)Ļ░Ć ņĀüņÜ®ļÉśņŚłņ£╝ļ®░ ņłśņåī ĒÖśņøÉ ņŗżĒŚś ņĀä ĒģģņŖżĒģÉ ņé░ņØĆ ņ£Āņä▒ ļ│╝ ļ░Ć(Model Pulverisette 5, Fritsch, Germany)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ļ│ĀņŚÉļäłņ¦Ć ļ░Ćļ¦ü Ļ│╝ņĀĢņØä ĒåĄĒĢ£ ļ»ĖņäĖĒÖöĻ░Ć ņäĀĒ¢ēļÉśņŚłļŗż. ļ░Ćļ¦ü ņÜ®ĻĖ░ļŖö ņŖżĒģīņØĖļ”¼ņŖż ņŖżĒŗĖ ņ×¼ņ¦łņØ┤ņŚłņ£╝ļ®░ ņ┤łĻ▓ĮĒĢ®ĻĖł ņ×¼ņ¦ł ļ│╝ņØä 20:1ņØś BPR (Ball to Powder ratio)ļĪ£ ĒģģņŖżĒģÉ ņé░Ļ│╝ ĒĢ©Ļ╗ś ņÜ®ĻĖ░ņŚÉ ņןņ×ģĒĢśņŚ¼ 200 PRMņØś ņåŹļÅäļĪ£ 5ņŗ£Ļ░äļÅÖņĢł ļ░Ćļ¦üņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. ņØ┤Ēøä ļ░Ćļ¦üņØ┤ ņÖäļŻīļÉ£ ĒģģņŖżĒģÉ ņé░ņØä 900~1200 ┬░CņØś ņś©ļÅäņŚÉņä£ 1ņŗ£Ļ░ä ļÅÖņĢł ņłśņåī ļČäņ£äĻĖ░ ņŚ┤ņ▓śļ”¼ĒĢśņŚ¼ ĒģģņŖżĒģÉ ļČäļ¦ÉņØä ĒĢ®ņä▒ĒĢśņśĆļŗż. ļśÉĒĢ£ ņāüņÜ® ņé░ĒÖö ĒģģņŖżĒģÉ(WO3, Fluka chemical, > 99% purity)ņØä ņøÉļŻīļĪ£ ļÅÖņØ╝ĒĢ£ ņŗżĒŚśņØä ņ¦äĒ¢ēĒĢśņŚ¼ ļ│Ė ņŚ░ĻĄ¼ņØś ņ┤łĻ▓ĮĒĢ®ĻĖł ņ×¼ĒÖ£ņÜ® Ļ│ĄņĀĢņØä ĒåĄĒĢ┤ ņ¢╗ņ¢┤ņ¦ä ĒģģņŖżĒģÉ ļČäļ¦ÉņØä ņāüņÜ® ņé░ĒÖö ĒģģņŖżĒģÉļĪ£ļČĆĒä░ ĒĢ®ņä▒ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦ÉĻ│╝ ļ╣äĻĄÉ ĒÅēĻ░ĆĒĢśņśĆļŗż.
ņ┤łĻ▓ĮĒĢ®ĻĖł ņŖ¼ļ¤¼ņ¦ĆļĪ£ļČĆĒä░ ĒÜīņłśļÉ£ ĒģģņŖżĒģÉ ņé░Ļ│╝ ĒģģņŖżĒģÉ ņé░ņŚÉ ļīĆĒĢ£ ņłśņåī ĒÖśņøÉņØä ĒåĄĒĢ┤ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦É ļé┤ ĒżĒĢ©ļÉ£ ĻĖłņåŹ ļČłņł£ļ¼╝ ĒĢ©ļ¤ēņØĆ ņ£ĀļÅä Ļ▓░ĒĢ® ĒöīļØ╝ņ”łļ¦ł ļČäĻ┤æ ļČäņäØļ▓Ģ(ICP-OES)ņØä ĒåĄĒĢ┤ ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░ XņäĀ ĒÜīņĀł ļČäņäØ ņןņ╣ś(SmartLab, Rigaku, Japan)ļź╝ ĒåĄĒĢ┤ ņāü ļČäņäØņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. XņäĀ ĒÜīņĀł ļČäņäØ ņןņ╣śļŖö Cu ĒāĆĻ▓¤(K╬▒: ╬╗ = 1.5418 ├ģ)ņØ┤ ņןņ░®ļÉśņ¢┤ ņ׳ņŚłņ£╝ļ®░ Si Ēæ£ņżĆ ņŗ£ļŻīļź╝ ĒåĄĒĢ£ ļ│┤ņĀĢņØ┤ ļČäņäØ ņĀä ņäĀĒ¢ēļÉśņŚłļŗż. ĒĢ®ņä▒ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦É ĒśĢņāüņØĆ ņĀäĻ│ä ļ░®ņČ£ ņŻ╝ņé¼ ņĀäņ×É Ēśäļ»ĖĻ▓Į(FE-SEM; Quanta 650, FEI, USA)ņØä ĒåĄĒĢ┤ ĒÖĢņØĖļÉśņŚłļŗż.
2.3 ļ░®ņĀä ĒöīļØ╝ņ”łļ¦ł ņåīĻ▓░ņŚÉ ņØśĒĢ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ ņĀ£ņĪ░
ņłśņåī ĒÖśņøÉņØä ĒåĄĒĢ┤ ĒĢ®ņä▒ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦ÉņØĆ ļ░®ņĀä ĒöīļØ╝ņ”łļ¦ł ņåīĻ▓░ ņןņ╣ś(AGUS, SPS-210Sx, Japan)ņŚÉņä£ ņåīĻ▓░ņ▓┤ ņĀ£ņ×æņØä ņ£äĒĢ£ ņøÉļŻīļĪ£ ņé¼ņÜ®ļÉśņŚłļŗż. ļ░®ņĀä ĒöīļØ╝ņ”łļ¦ł ņåīĻ▓░ņØä ņ£äĒĢ┤ ĒØæņŚ░ļŗżņØ┤(outer diameter 35 mm; inner diameter 10 mm; height 40 mm)ņŚÉ ĒģģņŖżĒģÉ ļČäļ¦ÉņØä ņČ®ņĀäĒĢśņŚ¼ ņåīĻ▓░ ņןņ╣ś ļé┤ļČĆņŚÉ ņןņ░®ĒĢśĻ│Ā ņ¦äĻ│ĄļÅäļź╝ ņĢĮ 40 mTorrļĪ£ ņ£Āņ¦ĆĒĢśņśĆļŗż. ļČäļ¦ÉņØ┤ ņČ®ņĀäļÉ£ ĒØæņŚ░ ļŗżņØ┤ņŚÉ 80 MPaņØś ņĢĢļĀźņØä Ļ░ĆĒĢśļ®┤ņä£ ņŖ╣ņś© ņåŹļÅä: ļČäļŗ╣ 100 ┬░C, ņĄ£ņóģ ņś©ļÅä: 1700 ┬░C, ņ£Āņ¦Ć ņŗ£Ļ░ä: 5 ļČäņØś ņĪ░Ļ▒┤ņŚÉņä£ ļ░®ņĀä ĒöīļØ╝ņ”łļ¦ł ņåīĻ▓░ņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. ļ░®ņĀä ĒöīļØ╝ņ”łļ¦ł ņåīĻ▓░ ņןņ╣śņŚÉņä£ ņś©ļÅäļŖö Ļ┤æĒĢÖ Ļ│Āņś©Ļ│ä(optical pyrometer)ļź╝ ĒåĄĒĢ┤ ņĖĪņĀĢĒĢśņśĆĻ│Ā ņåīĻ▓░ņØ┤ ņÖäļŻīļÉ£ Ēøä ĒØæņŚ░ ļŗżņØ┤ļŖö ļČäļŗ╣ 25 ┬░CņØś ņåŹļÅäļĪ£ 1ņŗ£Ļ░ä ņØ┤ļé┤ņŚÉ ņāüņś©ņ£╝ļĪ£ ļāēĻ░üĒĢśņśĆļŗż.
ņåīĻ▓░ļÉ£ ĒģģņŖżĒģÉņØĆ ļ»ĖņäĖņĪ░ņ¦ü Ļ┤Ćņ░░Ļ│╝ ĻĖ░Ļ│äņĀü ĒŖ╣ņä▒ ĒÅēĻ░Ćļź╝ ņ£äĒĢ┤ 6, 3, 1 ╬╝m ņ×ģļÅäņØś ļŗżņØ┤ņĢäļ¬¼ļō£ ņŖ¼ļ¤¼ļ”¼ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ Ēæ£ļ®┤ ņŚ░ļ¦łĒĢśņśĆļŗż. Ēæ£ļ®┤ ņŚ░ļ¦łļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ļŖö ņ×ģĻ│ä Ļ┤Ćņ░░ņØä ņ£äĒĢ┤ ĒÖöĒĢÖņĀü ļ░®ļ▓ĢņØä ĒåĄĒĢ┤ ņŚÉņ╣ŁĒĢśņśĆļŖöļŹ░ ņé¼ņÜ®ļÉ£ ņŚÉņ╣ŁņĢĪņØĆ ļ¼┤ļØ╝ņ╣┤ļ»Ė ņŚÉņ╣ŁņĢĪņ£╝ļĪ£ ņ”Øļźśņłś 100 mlņŚÉ ņłśņé░ĒÖöņ╣╝ļź© 10 g, ĒÄśļ”¼ņŗ£ņĢłĒÖö ņ╣╝ļź© 10 gņØä ņÜ®ĒĢ┤ĒĢśņŚ¼ ļ¦īļōżņ¢┤ņĪīņ£╝ļ®░ Ļ░ü ņŗ£ĒÄĖļŗ╣ ņŚÉņ╣ŁņØĆ 60ņ┤ł ļÅÖņĢł ņ¦äĒ¢ēĒĢśņśĆļŗż. ļ»ĖņäĖņĪ░ņ¦üņØĆ ņĀäĻ│ä ļ░®ņČ£ ņŻ╝ņé¼ ņĀäņ×É Ēśäļ»ĖĻ▓ĮņØä ĒÖ£ņÜ®ĒĢśņŚ¼ Ļ┤Ćņ░░ļÉśņŚłĻ│Ā ņĀäņ×É Ēøäļ░® ņé░ļ×Ć ĒÜīņĀłļ▓Ģ(EBSD, Electron Backscatter Diffraction)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņåīĻ▓░ņ▓┤ ļ»ĖņäĖņĪ░ņ¦ü ņāü ĒģģņŖżĒģÉ ņ×ģņ×É Ēü¼ĻĖ░ļź╝ ĒÖĢņØĖĒĢśņśĆļŗż. ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņØś ĻĖ░Ļ│äņĀü ĒŖ╣ņä▒ņØĆ ļ╣äņ╗żņŖż Ļ▓ĮļÅä ņĖĪņĀĢņØä ĒåĄĒĢ┤ ĒÖĢņØĖļÉśņŚłļŖöļŹ░ ĒĢśņżæ: 1 kg, ņ£Āņ¦Ć ņŗ£Ļ░ä: 15ņ┤łņØś ņĪ░Ļ▒┤ņŚÉņä£ ĒÅēĻ░ĆĒĢśņśĆļŗż.
3. Ļ▓░Ļ│╝ ļ░Å Ļ│Āņ░░
3.1 ņ┤łĻ▓ĮĒĢ®ĻĖł ņŖ¼ļ¤¼ņ¦ĆļĪ£ļČĆĒä░ ĒÜīņłśļÉ£ ĒģģņŖżĒģÉ ņé░ņØś ņłśņåī ĒÖśņøÉ
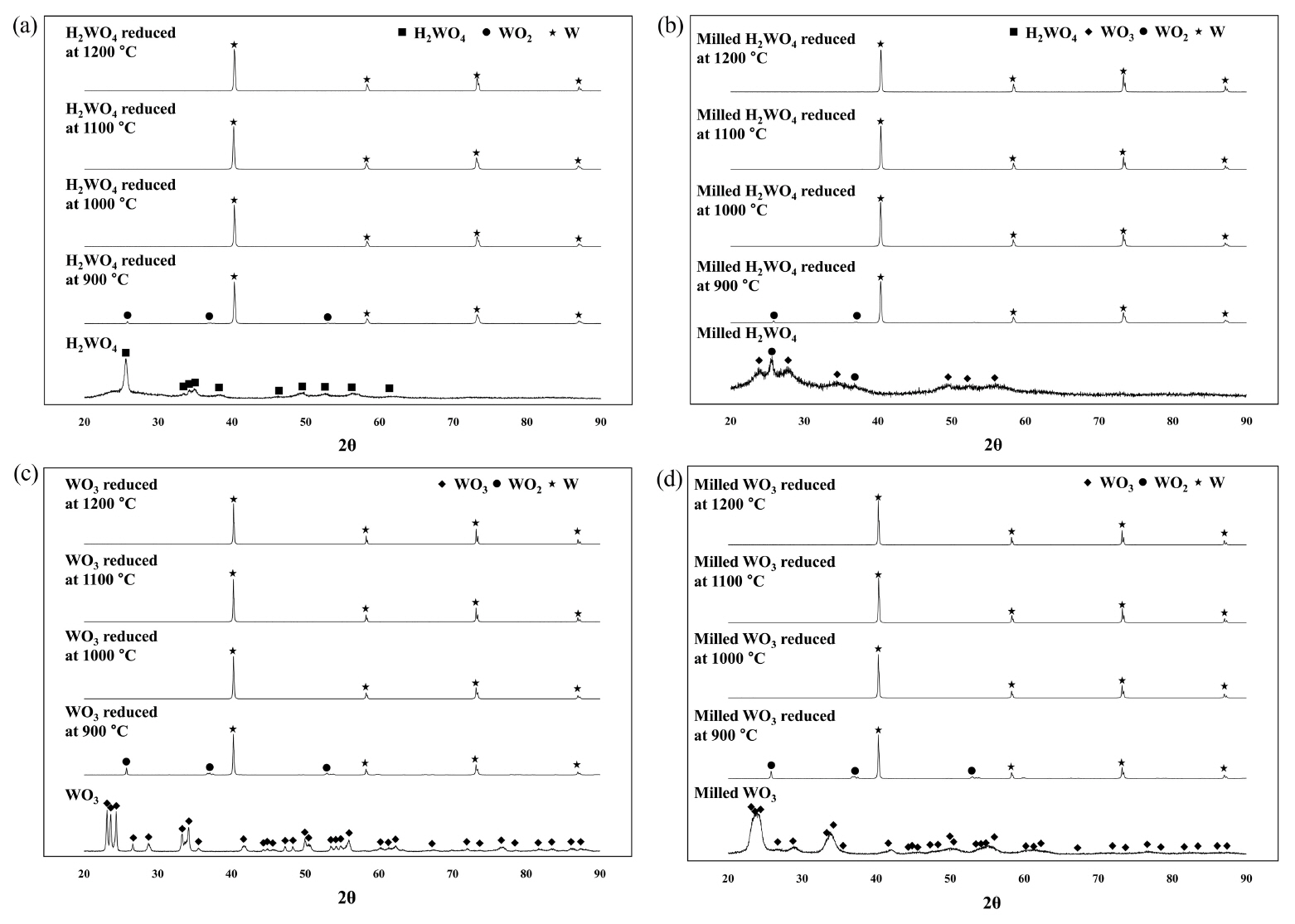
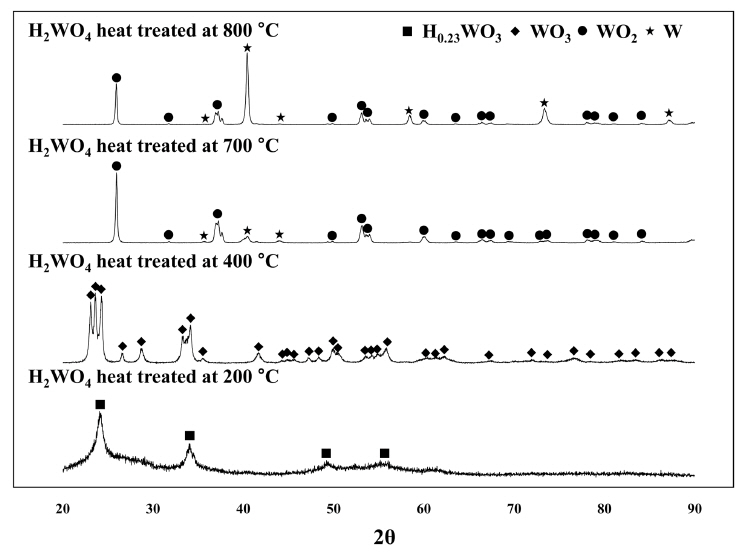
ĻĘĖļ”╝ 2ļŖö ņ┤łĻ▓ĮĒĢ®ĻĖł ņŖ¼ļ¤¼ņ¦ĆļĪ£ļČĆĒä░ ĒÜīņłśļÉ£ ĒģģņŖżĒģÉ ņé░Ļ│╝ ņāüņÜ® ņé░ĒÖö ĒģģņŖżĒģÉņŚÉ ļīĆĒĢ£ ņłśņåī ĒÖśņøÉ Ēøä ĒśĢņä▒ļÉ£ ņāüņØä ĒÖĢņØĖĒĢ£ Ļ▓āņ£╝ļĪ£ ņøÉļŻīņŚÉ ņāüĻ┤ĆņŚåņØ┤ 900 ┬░C ņØ┤ņāüņØś ņś©ļÅäņŚÉņä£ ĒģģņŖżĒģÉņØ┤ ĒśĢņä▒ļÉśļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. 900 ┬░CņŚÉņä£ ņŚ┤ņ▓śļ”¼ļÉ£ ļČäļ¦ÉņØś Ļ▓ĮņÜ░ ņØ╝ļČĆļČä ņé░ĒÖöļ¼╝ņØ┤ WO2 ĒśĢĒā£ļĪ£ ļé©ņĢäņ׳ļŖö Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŖöļŹ░ ņØ┤ļź╝ ĒåĄĒĢ┤ ĒģģņŖżĒģÉ ņé░ ņłśņåī ĒÖśņøÉņØĆ H2WO4ŌåÆ WO3ŌåÆ WO2ŌåÆ WņØś ņł£ņ£╝ļĪ£ ņØ╝ņ¢┤ļé£ļŗżļŖö Ļ▓āņØä ņśłņāüĒĢĀ ņłś ņ׳ļŗż [20]. ņ”ē, ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ H2OņØś ļČäĒĢ┤ļĪ£ WO3Ļ░Ć ņāØņä▒ļÉśĻ│Ā ņØ┤Ēøä ņłśņåīņŚÉ ņØśĒĢ£ ĒÖśņøÉņØ┤ ņ¦äĒ¢ēļÉśņ¢┤ WO3ņØś WO2ļĪ£ņØś ļ│ĆĒÖśņØ┤ ņØ╝ņ¢┤ļéśļ®░ WO2 ņāüņŚÉņä£ ĒģģņŖżĒģÉņØ┤ ĒśĢņä▒ļÉśļŖö Ļ▓āņØ┤ļŗż. ĻĘĖļ”╝ 3ņØś ņĀĆņś© ņŚ┤ņ▓śļ”¼ Ļ│╝ņĀĢņŚÉ ņØśĒĢ£ ĒģģņŖżĒģÉ ņé░ņØś ņāü ļ│ĆĒÖöļź╝ ĒåĄĒĢ┤ ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ H2OĻ░Ć ļČäĒĢ┤ļÉśļŖö ņś©ļÅäļŖö 200~300 ┬░CņØ┤ļ®░ 400~700 ┬░CņØś ņś©ļÅäņŚÉņä£ WO3Ļ░Ć WO2ļĪ£ ĒÖśņøÉļÉśĻ│Ā 900 ┬░C ņØ┤ņāüņØś ņś©ļÅäņŚÉņä£ WO2Ļ░Ć ĒģģņŖżĒģÉņ£╝ļĪ£ ņÖäņĀäĒĢśĻ▓ī ļ│ĆĒÖöĒĢśļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ĻĘĖļ”╝ 2ņŚÉņä£ ņĢī ņłś ņ׳ļō»ņØ┤ ĒģģņŖżĒģÉ ņé░ņØś Ļ▓ĮņÜ░ ļ░Ćļ¦üņØä ĒåĄĒĢ┤ ņØ╝ļČĆ H2OņØś ļČäĒĢ┤Ļ░Ć ļ░£ņāØĒĢśņŚ¼ ņé░ĒÖö ĒģģņŖżĒģÉņØ┤ ņāØņä▒ļÉśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŖöļŹ░ ņØ┤ļŖö ņŗżĒŚśņŚÉņä£ ņĀüņÜ®ļÉ£ Ļ│ĀņŚÉļäłņ¦Ć ļ░Ćļ¦ü Ļ│╝ņĀĢ ņżæ Ļ│Āņś© ĒÖśĻ▓ĮņØ┤ ņ£Āļ░£ļÉśņŚłĻĖ░ ļĢīļ¼ĖņØ┤ļŗż [21]. ļŗżļ¦ī ĒģģņŖżĒģÉ ņé░Ļ│╝ ņé░ĒÖö ĒģģņŖżĒģÉņŚÉņä£ ļÅÖņØ╝ĒĢśĻ▓ī ņłśņåī ĒÖśņøÉ ņś©ļÅäļŖö ļ░Ćļ¦ü ņĀüņÜ® ņŚ¼ļČĆņŚÉ ļö░ļźĖ ļ│ĆĒÖöļŖö ņŚåļŖö Ļ▓āņ£╝ļĪ£ ĒÖĢņØĖļÉśņ¢┤ ĒģģņŖżĒģÉ ņé░Ļ│╝ ņé░ĒÖö ĒģģņŖżĒģÉņØś ņ×ģļÅäĻ░Ć ņłśņåī ĒÖśņøÉ ņś©ļÅäņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØĆ ļ»Ėļ╣äĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż. Ēæ£ 1ņØĆ ņ┤łĻ▓ĮĒĢ®ĻĖł ņŖ¼ļ¤¼ņ¦ĆļĪ£ļČĆĒä░ ĒśĢņä▒ļÉ£ ĒģģņŖżĒģÉ ņé░Ļ│╝ ņłśņåī ĒÖśņøÉņØä ĒåĄĒĢ┤ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦ÉņŚÉ ĒżĒĢ©ļÉ£ ĻĖłņåŹ ļČłņł£ļ¼╝ ĒĢ©ļ¤ēņØä ļČäņäØĒĢ£ Ļ▓░Ļ│╝ļĪ£ ĻĄŁļé┤ ĒģģņŖżĒģÉ ļČäļ¦É ņĀ£ņĪ░ņŚģņ▓┤ņØĖ ļīĆĻĄ¼ĒģŹ ņĀ£ĒÆłĻ│╝ ļ╣äĻĄÉĒ¢łņØä ļĢī ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦É ļé┤ ņ╣╝ņŖś, ņ╣╝ļź©, ļéśĒŖĖļź©Ļ│╝ Ļ░ÖņØĆ ļČłņł£ļ¼╝ ĒĢ©ļ¤ēņØĆ ņāüļīĆņĀüņ£╝ļĪ£ ņĀüņØĆ Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ņØ┤ļź╝ ĒåĄĒĢ┤ ĒģģņŖżĒģÉ ĒŖ╣ņä▒ņŚÉ ļīĆĒĢ£ ļČłņł£ļ¼╝ņØś ņśüĒ¢źņØĆ ļ¼┤ņŗ£ Ļ░ĆļŖźĒĢĀ Ļ▓āņ£╝ļĪ£ ņśłņĖĪļÉśņŚłļŗż.
ĻĘĖļ”╝ 4ļŖö ņłśņåī ĒÖśņøÉņØä ĒåĄĒĢ┤ ĒĢ®ņä▒ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦ÉņØś ĒśĢņāüņØä ĒÖĢņØĖĒĢ£ Ļ▓āņ£╝ļĪ£ ļ░Ćļ¦ü Ļ│ĄņĀĢņØĆ ņłśņåī ĒÖśņøÉ ņś©ļÅäņŚÉļŖö ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ļ¬╗ĒĢśņśĆņ£╝ļéś ĒĢ®ņä▒ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦ÉņØś ņ×ģļÅäļŖö ļ░Ćļ¦ü Ļ│ĄņĀĢ ņĀüņÜ® ņŚ¼ļČĆņŚÉ ļö░ļØ╝ Ēü¼Ļ▓ī ļŗ¼ļØ╝ņ¦ĆļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ņ”ē, ļ░Ćļ¦ü Ļ│ĄņĀĢņØ┤ ņĀüņÜ®ļÉśņ¦Ć ņĢŖņØĆ ĒģģņŖżĒģÉ ņé░Ļ│╝ ņé░ĒÖö ĒģģņŖżĒģÉņØś Ļ▓ĮņÜ░ ņłśņåī ĒÖśņøÉ Ēøä ĒĢ®ņä▒ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦ÉņØś Ēü¼ĻĖ░Ļ░Ć 1 ╬╝m ņłśņżĆņØ┤ņŚłņ£╝ļéś ņøÉņ×¼ļŻīĻ░Ć ļ░Ćļ¦üņØä ĒåĄĒĢ┤ ļČäņćäļÉ£ Ļ▓ĮņÜ░ ļČäļ¦É ņ×ģļÅäļŖö ļīĆļץņĀüņ£╝ļĪ£ ļČäņćäļÉśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ņŚÉ ļ╣äĒĢ┤ 1/2 ņłśņżĆņ£╝ļĪ£ Ļ░ÉņåīĒĢśņŚ¼ ņ┤łļ»ĖņäĖ ļČäļ¦ÉņØ┤ ĒĢ®ņä▒ļÉ£ Ļ▓āņØ┤ļŗż. ņØ┤ļź╝ ĒåĄĒĢ┤ ļ░Ćļ¦üņŚÉ ņØśĒĢ£ ļ»ĖņäĖĒÖöļŖö ĒÖśņøÉ ņś©ļÅäļ│┤ļŗżļŖö ĒģģņŖżĒģÉ ļČäļ¦É ņ×ģļÅäņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö ņÜöņØĖņ£╝ļĪ£ ņ×æņÜ®ĒĢśļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ĻĘĖļ”╝ 4(a)ņŚÉņä£ ĒģģņŖżĒģÉ ņé░ņØś ĒśĢĒā£ļŖö ĻĘĖļ”╝ 4(c)ņØś Ļ░üĒśĢ ņé░ĒÖö ĒģģņŖżĒģÉĻ│╝ ļŗ¼ļ”¼ 100 nm ņłśņżĆņØś ņ×æņØĆ Ļ▓░ņĀĢļ”ĮļōżņØ┤ ņØæņ¦æļÉ£ ĻĄ¼ĒśĢņŚÉ Ļ░ĆĻ╣īņÜ┤ Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ņØ┤ļŖö ĒģģņŖżĒģÉ ņé░ņØ┤ ĒśĢņä▒ļÉśļŖö Ļ│╝ņĀĢņŚÉņä£ Ļ│Āņś©(600 ┬░C) Ļ▓░ņĀĢĒÖö ļŗ©Ļ│äĻ░Ć ņŚåņŚłĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ņØ┤ļ¤¼ĒĢ£ ĒģģņŖżĒģÉ ņé░ņØś ĒśĢņāüņ£╝ļĪ£ ņØĖĒĢ┤ ĒģģņŖżĒģÉ ņé░ņØś ņłśņåī ĒÖśņøÉņØä ĒåĄĒĢ┤ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦É ņŚŁņŗ£ Ļ░üņ¦ä ĒśĢĒā£Ļ░Ć ņĢäļŗī ĻĄ¼ĒśĢņŚÉ Ļ░ĆĻ╣īņÜ┤ ĒśĢņāüņØä ļéśĒāĆļé┤ļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ļ░śļ®┤ ņé░ĒÖö ĒģģņŖżĒģÉņØś Ļ▓ĮņÜ░ ņĀ£ņĪ░ Ļ│╝ņĀĢņŚÉņä£ Ļ│Āņś©ņØś Ļ▓░ņĀĢĒÖö ļŗ©Ļ│äļź╝ Ļ▒░ņ╣£ ņØ┤ņ£ĀļĪ£ ĻĘĖļ”╝ 4(c)ņÖĆ Ļ░ÖņØ┤ Ļ░üņ¦ä ĒśĢĒā£ļź╝ ļéśĒāĆļé┤Ļ│Ā ņ׳ņ£╝ļ®░ ņłśņåī ĒÖśņøÉņØä ĒåĄĒĢ┤ ĒśĢņä▒ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦ÉņØś ĒśĢĒā£ ņŚŁņŗ£ ĒģģņŖżĒģÉ ņé░ņØä ņøÉļŻīļĪ£ ĒĢ®ņä▒ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦ÉņŚÉ ļ╣äĒĢ┤ Ļ░üņ¦ä ĒśĢĒā£ņ×äņØä ņĢī ņłś ņ׳ļŗż.
3.2 ļ░®ņĀä ĒöīļØ╝ņ”łļ¦ł ņåīĻ▓░ņŚÉ ņØśĒĢ┤ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ ļ»ĖņäĖņĪ░ņ¦ü ļČäņäØ
ĻĘĖļ”╝ 5ņÖĆ 6ņØĆ ĒģģņŖżĒģÉ ņé░Ļ│╝ ņé░ĒÖö ĒģģņŖżĒģÉņØä ņłśņåī ĒÖśņøÉĒĢśņŚ¼ ĒĢ®ņä▒ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦ÉņØä ņøÉļŻīļĪ£ ņ¢╗ņ¢┤ņ¦ä ņåīĻ▓░ņ▓┤ņØś ļ»ĖņäĖņĪ░ņ¦üņØä ļéśĒāĆļéĖļŗż. ļ»ĖņäĖņĪ░ņ¦üņØä ĒåĄĒĢ┤ ņĢī ņłś ņ׳ļŖö Ļ▓āņØĆ ĒĢ®ņä▒ ņś©ļÅäņŚÉ ļö░ļźĖ ņåīĻ▓░ņ▓┤ ļé┤ ĒģģņŖżĒģÉ ņ×ģņ×ÉņØś Ēü¼ĻĖ░ ņ░©ņØ┤ļŖö Ēü¼ņ¦Ć ņĢŖņ¦Ćļ¦ī ļ░Ćļ¦üņŚÉ ņØśĒĢ£ ĒģģņŖżĒģÉ ļČäļ¦É ņ×ģļÅä ļ│ĆĒÖöĻ░Ć ņåīĻ▓░ņ▓┤ ļ»ĖņäĖņĪ░ņ¦üņŚÉ Ēü░ ņśüĒ¢źņØä ļ»Ėņ╣£ļŗżļŖö Ļ▓āņØ┤ļŗż. ņØ┤ļŖö ĻĘĖļ”╝ 4ņØś ļČäļ¦É ĒśĢņāüņŚÉņä£ ņĢī ņłś ņ׳ļō»ņØ┤ ĒĢ®ņä▒ ņś©ļÅäņŚÉ ļö░ļźĖ ĒģģņŖżĒģÉ ļČäļ¦É ņ×ģļÅä ļ│ĆĒÖöļŖö Ēü¼ņ¦Ć ņĢŖĻ│Ā ļ░Ćļ¦ü ņĀüņÜ® ņŚ¼ļČĆņŚÉ ļö░ļźĖ ĒģģņŖżĒģÉ ļČäļ¦É ņ×ģļÅä ļ│ĆĒÖöļŖö Ēü░ Ļ▓āņØ┤ ņøÉņØĖņ£╝ļĪ£ ļ░Ćļ¦ü Ļ│ĄņĀĢņØ┤ ļČäļ¦É ņ×ģļÅäļ┐É ņĢäļŗłļØ╝ ņåīĻ▓░ņ▓┤ ļ»ĖņäĖņĪ░ņ¦ü ņāü ņ×ģņ×É Ēü¼ĻĖ░ ļ│ĆĒÖöņŚÉ ļīĆĒĢ┤ņä£ļÅä ĒÜ©Ļ│╝ņĀüņØĖ ņĀ£ņ¢┤ ņłśļŗ©ņ×äņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŗż. ĻĘĖļ”╝ 6ņØś ņé░ĒÖö ĒģģņŖżĒģÉņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ļŖö ļ»ĖņäĖņĪ░ņ¦üņŚÉņä£ ņĢī ņłś ņ׳ļō»ņØ┤ ĻĘĖļ”╝ 5ņØś ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņ¢╗ņ¢┤ņ¦ä ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ Ļ│äļ®┤ņŚÉ ņāüļŗ╣ĒĢ£ ĻĖ░Ļ│ĄņØ┤ ļČäĒżĒĢśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŗż. ņØ┤ļź╝ ĒåĄĒĢ┤ ņåīĻ▓░ņä▒ņŚÉ ņ׳ņ¢┤ņä£ ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ĒĢ®ņä▒ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦ÉņØ┤ ņé░ĒÖö ĒģģņŖżĒģÉņ£╝ļĪ£ļČĆĒä░ ĒĢ®ņä▒ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦ÉņŚÉ ļ╣äĒĢ┤ ņÜ░ņłśĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉśņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ ņåīĻ▓░ņä▒ņŚÉņä£ņØś ņ░©ņØ┤ļŖö Ēæ£ 2ņŚÉ ļéśĒāĆļéĖ ļ░ĆļÅä ņĖĪņĀĢ Ļ▓░Ļ│╝ņŚÉņä£ ņłśņ╣śņĀüņ£╝ļĪ£ ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŖöļŹ░ ņåīĻ▓░ ņĀä ņä▒ĒśĢ ļŗ©Ļ│äņŚÉņä£ņØś ļ░ĆļÅäļŖö ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦ÉņØ┤ ņé░ĒÖö ĒģģņŖżĒģÉņ£╝ļĪ£ ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦ÉņŚÉ ļ╣äĒĢ┤ ļåÆļŗżĻ│Ā ĒĢĀ ņłś ņŚåņ¦Ćļ¦ī ņåīĻ▓░ Ēøä ņāüļīĆļ░ĆļÅäņØś Ļ▓ĮņÜ░ ļ░Ćļ¦ü ņĀüņÜ® ņŚ¼ļČĆ, ĒÖśņøÉ ņś©ļÅäņŚÉ ņāüĻ┤Ć ņŚåņØ┤ ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ĒĢ®ņä▒ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦ÉņØ┤ ņé░ĒÖö ĒģģņŖżĒģÉņ£╝ļĪ£ļČĆĒä░ ĒĢ®ņä▒ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦ÉņŚÉ ļ╣äĒĢ┤ ļåÆņØĆ Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ņØ┤ļŖö ĻĘĖļ”╝ 4ņØś ļČäļ¦É ĒśĢņāüņŚÉņä£ ņĢī ņłś ņ׳ļō»ņØ┤ ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ĒĢ®ņä▒ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦ÉņØś ĒśĢņāüņØ┤ ĻĄ¼ĒśĢņŚÉ Ļ░ĆĻ╣īņøī ņé░ĒÖö ĒģģņŖżĒģÉņ£╝ļĪ£ļČĆĒä░ ĒĢ®ņä▒ļÉ£ Ļ░üņ¦ä ĒśĢĒā£ ĒģģņŖżĒģÉ ļČäļ¦ÉņŚÉ ļ╣äĒĢ┤ ņåīĻ▓░ņä▒ņØ┤ ņÜ░ņłśĒ¢łĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ņ”ē, ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņ¢╗ņ¢┤ņ¦ä ĒģģņŖżĒģÉ ļČäļ¦ÉņØś Ļ▓ĮņÜ░ Ēæ£ļ®┤ņØś ņøÉņ×É ļ░░ņŚ┤ņØ┤ ļČłĻĘ£ņ╣ÖĒĢśĻ│Ā Ļ░üņ¦ä ĒśĢĒā£ņØś ĒģģņŖżĒģÉ ļČäļ¦ÉņŚÉ ļ╣äĒĢ┤ ņåīĻ▓░ Ļ│╝ņĀĢņŚÉņä£ ņøÉņ×É ĒÖĢņé░ņØ┤ ņÜ®ņØ┤ĒĢśņŚ¼ ņåīĻ▓░ņä▒ņØ┤ ņÜ░ņłśĒĢśĻ▓ī ļÉ£ Ļ▓āņØ┤ļŗż. ņØ┤ļ¤¼ĒĢ£ ņøÉņ×É ĒÖĢņé░ņØś ņÜ®ņØ┤ĒĢ©ņØĆ ņåīĻ▓░ ņżæ ņ╣śļ░ĆĒÖöļ┐É ņĢäļŗłļØ╝ ņ×ģņ×É ņä▒ņןņŚÉ ļīĆĒĢ£ ĻĄ¼ļÅÖļĀźņ£╝ļĪ£ ņ×æņÜ®ņØä ĒĢĀ ņłś ņ׳ņ¢┤ ņåīĻ▓░ņä▒ņØ┤ ņÜ░ņłśĒĢ£ ņ×¼ļŻīņŚÉņä£ļŖö ņ×ģņ×É ņä▒ņןņØ┤ ĒÖ£ļ░£Ē׳ ņØ╝ņ¢┤ļéśĻ▓ī ļÉ£ļŗż [15]. ĻĘĖļ”╝ 5ņØś ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņØś ņ×ģņ×É Ēü¼ĻĖ░Ļ░Ć ĻĘĖļ”╝ 6ņØś ņé░ĒÖö ĒģģņŖżĒģÉņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņØś ņ×ģņ×É Ēü¼ĻĖ░ļ│┤ļŗż ĒÖĢņŚ░Ē׳ Ēü░ Ļ▓āņØĆ ņØ┤ļ¤¼ĒĢ£ ņØ┤ņ£Ā ļĢīļ¼Ėņ£╝ļĪ£ ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ļČäļ¦ÉĻ│╝ ņé░ĒÖö ĒģģņŖżĒģÉņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ļČäļ¦ÉņØś Ēü¼ĻĖ░ ņ░©ņØ┤Ļ░Ć Ēü¼ņ¦Ć ņĢŖņØīņŚÉļÅä ņåīĻ▓░ņ▓┤ņŚÉņä£ ņ×ģņ×É Ēü¼ĻĖ░ ņ░©ņØ┤Ļ░Ć ņ╗żņ¦ä Ļ▓āņØä ĒåĄĒĢ┤ ļČäļ¦É ĒśĢņāüĻ│╝ ņåīĻ▓░ņä▒ Ļ░ä ņ¦üņĀæņĀüņØĖ Ļ┤ĆĻ│äļź╝ ņ£ĀņČöĒĢĀ ņłś ņ׳ļŗż.
3.3 ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ Ļ▓ĮļÅä ĒŖ╣ņä▒ ļ│ĆĒÖö
ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņŚÉņä£ ļ░ĆļÅäļŖö ĻĖ░Ļ│äņĀü ĒŖ╣ņä▒ņŚÉ ņ¦üņĀæņĀüņØĖ ņśüĒ¢źņØä ļ»Ėņ╣śĻ▓ī ļÉśĻ│Ā ĒŖ╣Ē׳, Ļ▓ĮļÅä ĒŖ╣ņä▒ņØĆ ļ░ĆļÅäņŚÉ ļ╣äļĪĆĒĢśņŚ¼ Ē¢źņāüļÉśĻ▓ī ļÉ£ļŗż [8]. ļśÉĒĢ£ ņåīĻ▓░ņ▓┤ņØś Ļ▓ĮņÜ░ Ļ▓ĮļÅä ĒŖ╣ņä▒ņØĆ ļ»ĖņäĖņĪ░ņ¦ü ņāü ņ×ģņ×É Ēü¼ĻĖ░ņŚÉ ļ░śļ╣äļĪĆĒĢśņŚ¼ ļ│ĆĒÖöĒĢśĻ▓ī ļÉśļŖöļŹ░ ņ×ģņ×É Ēü¼ĻĖ░Ļ░Ć ņ×æņØäņłśļĪØ Ļ│äļ®┤ ļ®┤ņĀüņØĆ ņ╗żņ¦ĆĻ│Ā Ļ│äļ®┤ņØĆ ņåīņä▒ ļ│ĆĒśĢņŚÉ ĒĢäņÜöĒĢ£ ņĀäņ£ä ņØ┤ļÅÖņØä ļ░®ĒĢ┤ĒĢśņŚ¼ ņ×ģņ×É Ēü¼ĻĖ░Ļ░Ć ņ×æņØäņłśļĪØ ņåīņä▒ ļ│ĆĒśĢņŚÉ ļīĆĒĢ£ ņĀĆĒĢŁņä▒ņØś ņ▓ÖļÅäņØĖ Ļ▓ĮļÅä ĒŖ╣ņä▒ņØ┤ Ē¢źņāüļÉśļŖö Ļ▓āņØ┤ļŗż [22]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņØś Ļ▓ĮņÜ░ņŚÉļÅä ļ░ĆļÅäņÖĆ ņ×ģņ×É Ēü¼ĻĖ░Ļ░Ć Ļ▓ĮļÅä ĒŖ╣ņä▒ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö ņŻ╝ņÜö ņØĖņ×ÉĻ░Ć ļÉśĻ▓ī ļÉ£ļŗż. ĻĘĖļ”╝ 7ņØä ļ│┤ļ®┤ ļ░Ćļ¦üņØ┤ ņĀüņÜ®ļÉśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ ļ░ĆļÅäņØś ņÜ░ņ£äņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņØś Ļ▓ĮļÅäĻ░Ć ņé░ĒÖö ĒģģņŖżĒģÉņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņØś Ļ▓ĮļÅäļ│┤ļŗż ļé«ņØĆļŹ░ ņØ┤ļŖö ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉņØś Ļ▓ĮņÜ░ ņåīĻ▓░ ņżæ ĒÖĢņŚ░ĒĢ£ ņ×ģņ×É ņä▒ņןņØ┤ ņØ╝ņ¢┤ļé¼ĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ņ”ē, ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉņŚÉņä£ļŖö ņÜ░ņłśĒĢ£ ņåīĻ▓░ņä▒ņ£╝ļĪ£ ļ░ĆļÅäĻ░Ć ļåÆņØĆ ĒģģņŖżĒģÉņØ┤ ņĀ£ņĪ░ļÉśņŚłņ¦Ćļ¦ī Ļ│╝ļÅäĒĢ£ ņ×ģņ×É ņä▒ņןņ£╝ļĪ£ Ļ│Āļ░ĆļÅäļĪ£ ņØĖĒĢ£ Ļ▓ĮļÅä Ē¢źņāü ĒÜ©Ļ│╝Ļ░Ć ņĀĆĻ░ÉļÉśĻ│Ā ņśżĒ׳ļĀż ņé░ĒÖö ĒģģņŖżĒģÉņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉņŚÉ ļ╣äĒĢ┤ ļé«ņØĆ Ļ▓ĮļÅäļź╝ ļéśĒāĆļéĖ Ļ▓āņØ┤ļŗż. ĻĘĖļ”╝ 8ņØĆ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ ļ»ĖņäĖņĪ░ņ¦ü ņāü ņ×ģņ×É Ēü¼ĻĖ░ļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ ņłśĒ¢ēļÉ£ EBSD ļČäņäØ Ļ▓░Ļ│╝ņØ┤ļŗż. ņ×ģņ×É ļé┤ļČĆņŚÉņä£ Ļ┤Ćņ░░ļÉśļŖö ļ»ĖņäĖĒĢ£ ņ×ģņ×ÉļŖö ņåīĻ▓░ņ▓┤ ņŗ£ĒÄĖ Ēæ£ļ®┤ Ļ░ĆĻ│Ą ņŗ£ ļ░£ņāØļÉ£ ļöżĒöīļĪ£ ņØĖĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤ņØ┤ļ®░ EBSD Ļ▓░Ļ│╝ņŚÉņä£ ņĢī ņłś ņ׳ļō»ņØ┤ ļ░Ćļ¦üņØ┤ ņĀüņÜ®ļÉśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņØś ņ×ģņ×ÉļŖö ņĢĮ 15 ╬╝m ņłśņżĆņ£╝ļĪ£ ņåīĻ▓░ ņżæ ĒÖĢņŚ░ĒĢ£ ņ×ģņ×É ņä▒ņןņØ┤ ņ׳ņŚłņØīņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ļŗż. ļ░śļ®┤ņŚÉ ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņŚÉņä£ ļ░Ćļ¦üņØ┤ ņĀüņÜ®ļÉ£ Ļ▓ĮņÜ░ņŚÉļŖö ņ×ģņ×É Ēü¼ĻĖ░Ļ░Ć Ļ░ÉņåīļÉśņ¢┤ ņåīĻ▓░ ņżæ ņ×ģņ×É ņä▒ņןņŚÉ ņØśĒĢ£ Ļ▓ĮļÅä ĒŖ╣ņä▒ ņĀĆĒĢśĻ░Ć ņ¢┤ļŖÉ ņĀĢļÅä ļ│┤ņÖäļÉśĻ▓ī ļÉ£ļŗż. Ļ▓░ĻĄŁ ļ░Ćļ¦üņØ┤ ņĀüņÜ®ļÉśņ¢┤ ņ×ģņ×É ņä▒ņןņŚÉ ņØśĒĢ£ Ļ▓ĮļÅä Ļ░Éņåī ĒÜ©Ļ│╝ļź╝ ļé«ņČś Ļ▓ĮņÜ░ ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņØś Ļ▓ĮļÅäĻ░ÆņØĆ ņé░ĒÖö ĒģģņŖżĒģÉņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņØś Ļ▓ĮļÅäĻ░Æļ│┤ļŗż ļåÆņĢśĻ│Ā ļśÉĒĢ£ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņŚÉņä£ ļ░£Ēæ£ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņØś ņĄ£Ļ│Ā Ļ▓ĮļÅäĻ░ÆņØĖ 389 HVļ│┤ļŗż ņÜ░ņłśĒĢ£ ņĄ£ļīĆ 471 HVņØś Ļ▓ĮļÅä ĒŖ╣ņä▒ņØä ļéśĒāĆļé┤ļŖö Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż.
4. Ļ▓░ ļĪĀ
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒģģņŖżĒģÉņé░ņĢöļ¬©ļŖä ļŗ©Ļ│äĻ░Ć ņāØļץļÉ£ ņ┤łĻ▓ĮĒĢ®ĻĖł ņŖ¼ļ¤¼ņ¦Ć ņ×¼ĒÖ£ņÜ® Ļ│ĄņĀĢņØä ņĀ£ņŗ£ĒĢśĻ│Ā ņĀ£ņŗ£ļÉ£ Ļ│ĄņĀĢņØä ĒåĄĒĢ┤ ņĀ£ņĪ░ļÉśļŖö ĒģģņŖżĒģÉņØś Ē¢źņāüļÉ£ ĻĖ░Ļ│äņĀü ĒŖ╣ņä▒ņØä ļ│┤ņŚ¼ņŻ╝Ļ│Āņ×É ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņØś ņ┤łĻ▓ĮĒĢ®ĻĖł ņ×¼ĒÖ£ņÜ® Ļ│ĄņĀĢņØĆ ĒģģņŖżĒģÉņé░ņĢöļ¬©ļŖä ļŗ©Ļ│äĻ░Ć ņāØļץļÉśņ¢┤ ņ╣£ĒÖśĻ▓ĮņĀüņØ┤Ļ│Ā ņøÉĻ░Ć ņĀłĻ░ÉņØ┤ Ļ░ĆļŖźĒĢ£ Ļ│ĄņĀĢņØ┤ņŚłĻ│Ā ņĀ£ņĪ░ļÉśļŖö ĒģģņŖżĒģÉņØĆ ņåīĻ▓░ņä▒ ļ░Å ĻĖ░Ļ│äņĀü ĒŖ╣ņä▒ņØ┤ ĻĖ░ņĪ┤ Ļ│ĄņĀĢņØä ĒåĄĒĢ┤ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņÜ░ņłśĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņĀ£ņŗ£ļÉ£ ĒģģņŖżĒģÉ Ļ│ĄņĀĢ ļ░Å ņåīņ×¼ Ļ┤ĆļĀ©ĒĢśņŚ¼ Ļ▓░ļĪĀņØĆ ļŗżņØīĻ│╝ Ļ░ÖņØ┤ ņÜöņĢĮĒĢĀ ņłś ņ׳ļŗż.
1. ņĢöļ¬©ļŗłņĢäļź╝ ņé¼ņÜ®ĒĢśņ¦Ć ņĢŖĻ│Ā ĒģģņŖżĒģÉ ņé░ņØä ĒśĢņä▒ņŗ£Ēé© Ēøä ĒģģņŖżĒģÉ ņé░ņŚÉ ļīĆĒĢ£ ņłśņåī ĒÖśņøÉņØä ĒåĄĒĢ┤ ĒģģņŖżĒģÉ ļČäļ¦ÉņØä ĒĢ®ņä▒ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņØś Ļ│ĄņĀĢņØĆ ņĢöļ¬©ļŗłņĢäļź╝ ņé¼ņÜ®ĒĢśņ¦Ć ņĢŖĻ│Ā ĒģģņŖżĒģÉ ņé░ņĢöļ¬©ļŖäņØś ņé░ĒÖö ĒģģņŖżĒģÉ ļ│ĆĒÖś ļŗ©Ļ│äĻ░Ć ņāØļץļÉśņ¢┤ ņ╣£ĒÖśĻ▓ĮņĀüņØ┤Ļ│Ā Ļ│ĄņĀĢ ļ╣äņÜ® ņĀłĻ░ÉņØ┤ Ļ░ĆļŖźĒĢ£ Ļ│ĄņĀĢņ£╝ļĪ£ ņ┤łĻ▓ĮĒĢ®ĻĖł ņ×¼ĒÖ£ņÜ®ļ┐É ņĢäļŗłļØ╝ ĒģģņŖżĒģÉ Ļ┤æņäØ ņĀ£ļĀ© Ļ│ĄņĀĢņŚÉņä£ļÅä ņ£ĀņÜ®ĒĢśĻ▓ī ĒÖ£ņÜ®ļÉĀ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
2. Ļ░£ļ░£ļÉ£ Ļ│ĄņĀĢņŚÉņä£ļŖö ĒģģņŖżĒģÉ ņé░ņŚÉ ļīĆĒĢ£ ņłśņåī ĒÖśņøÉņØä ĒåĄĒĢ┤ ĒģģņŖżĒģÉ ļČäļ¦ÉņØä ĒĢ®ņä▒ĒĢśĻ▓ī ļÉśļ®░ ĻĖ░ņĪ┤ ĒģģņŖżĒģÉ ļČäļ¦É ĒĢ®ņä▒ Ļ│╝ņĀĢņŚÉņä£ ņøÉļŻīļĪ£ ņé¼ņÜ®ļÉśļŖö Ļ▓░ņĀĢņ¦ł ņé░ĒÖö ĒģģņŖżĒģÉĻ│╝ ļŗ¼ļ”¼ ĒģģņŖżĒģÉ ņé░ņØĆ ņ┤łļ»ĖņäĖ Ļ▓░ņĀĢļ”ĮņØś ņØæņ¦æņ▓┤ ĒśĢĒā£ļĪ£ ĻĄ¼ĒśĢņŚÉ Ļ░ĆĻ╣īņÜ┤ ĒśĢņāüņØä ļéśĒāĆļé┤ņ¢┤ ĒĢ®ņä▒ļÉ£ ĒģģņŖżĒģÉ ļČäļ¦É ĒśĢņāüņØĆ ĻĄ¼ĒśĢņŚÉ Ļ░ĆĻ╣īņÜ┤ Ļ▓āņ£╝ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż.
3. ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ĒĢ®ņä▒ļÉ£ ĻĄ¼ĒśĢņŚÉ Ļ░ĆĻ╣īņÜ┤ ĒģģņŖżĒģÉ ļČäļ¦ÉņØĆ ņé░ĒÖö ĒģģņŖżĒģÉņ£╝ļĪ£ļČĆĒä░ ņ¢╗ņ¢┤ņ¦ä Ļ░üņ¦ä ĒśĢĒā£ņØś ĒģģņŖżĒģÉ ļČäļ¦ÉņŚÉ ļ╣äĒĢ┤ ņåīĻ▓░ņä▒ņØ┤ ņÜ░ņłśĒĢśņśĆļŖöļŹ░ Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ļŖö ņé░ĒÖö ĒģģņŖżĒģÉņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņŚÉ ļ╣äĒĢ┤ ņåīĻ▓░ ļ░ĆļÅäĻ░Ć ļåÆņĢśļŗż. ļÅÖņŗ£ņŚÉ ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉņØś Ļ▓ĮņÜ░ ņ×ģņ×É ņä▒ņןņŚÉ ļīĆĒĢ£ ĻĄ¼ļÅÖļĀźļÅä ņ╗ż ņåīĻ▓░ņ▓┤ ļ»ĖņäĖņĪ░ņ¦ü ņāü ņ×ģņ×É Ēü¼ĻĖ░Ļ░Ć ņĪ░ļīĆĒĢ£ Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż.
4. ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņØś Ļ▓ĮņÜ░ ļåÆņØĆ ļ░ĆļÅäņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņé░ĒÖö ĒģģņŖżĒģÉņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņŚÉ ļ╣äĒĢ┤ Ļ▓ĮļÅä ĒŖ╣ņä▒ņØ┤ ņŚ┤ņäĖņśĆļŗż. ņØ┤ļŖö ņåīĻ▓░ ņżæ ĻĖēĻ▓®ĒĢ£ ņ×ģņ×É ņä▒ņןņ£╝ļĪ£ ņØĖĒĢ┤ ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņØś Ļ▓ĮļÅä ĒŖ╣ņä▒ņØ┤ ņĀĆĒĢśļÉśņŚłĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ļ░Ćļ¦ü Ļ│ĄņĀĢ ļÅäņ×ģņØä ĒåĄĒĢ┤ ņåīĻ▓░ņ▓┤ ļ»ĖņäĖņĪ░ņ¦ü ņāü ņ×ģņ×É Ēü¼ĻĖ░ļź╝ Ļ░Éņåīņŗ£ņ╝░ņØä ļĢī ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņØś Ļ▓ĮļÅä ĒŖ╣ņä▒ņØä Ļ░£ņäĀĒĢĀ ņłś ņ׳ņŚłļŗż. ņ”ē, ĒģģņŖżĒģÉ ņé░ņ£╝ļĪ£ļČĆĒä░ ņ¢╗ņ¢┤ņ¦ä ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņØś Ļ▓ĮņÜ░ ņåīĻ▓░ņ▓┤ ļ»ĖņäĖņĪ░ņ¦ü ņāü ņ×ģņ×É Ēü¼ĻĖ░ļź╝ ņĀ£ņ¢┤ĒĢĀ ņłś ņ׳ļŗżļ®┤ Ļ│Āļ░ĆļÅä ĒŖ╣ņä▒ņ£╝ļĪ£ ņØĖĒĢ┤ ĻĖ░ņĪ┤ ņé░ĒÖö ĒģģņŖżĒģÉņ£╝ļĪ£ļČĆĒä░ ņ¢╗ņ¢┤ņ¦ä ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņŚÉ ļ╣äĒĢ┤ Ļ▓ĮļÅä ĒŖ╣ņä▒ņØ┤ ņÜ░ņäĖĒĢśĻ▓ī ļÉ£ļŗż. Ļ▓░ĻĄŁ, ņ×ģļÅäĻ░Ć ņĀ£ņ¢┤ļÉ£ ĒģģņŖżĒģÉ ņåīĻ▓░ņ▓┤ņØś Ļ▓ĮņÜ░ Ļ▓ĮļÅäĻ░ÆņØ┤ ņĄ£ļīĆ 471 HVļĪ£ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņŚÉņä£ ņĀ£ņŗ£ļÉ£ ĒģģņŖżĒģÉņØś Ļ▓ĮļÅä ĒŖ╣ņä▒(389 HV)ņØä ļŖźĻ░ĆĒĢśņŚ¼ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņĀ£ņŗ£ļÉ£ Ļ│ĄņĀĢņØä ĒåĄĒĢ┤ ņĀ£ņĪ░ļÉ£ ĒģģņŖżĒģÉ ņåīņ×¼ņØś ņÜ░ņłśņä▒ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż.