1. ņä£ ļĪĀ
ĒīöļØ╝ļōÉņØĆ ņÜ░ņłśĒĢ£ ņłśņåīĒł¼Ļ│╝ņä▒ņ£╝ļĪ£ ņØĖĒĢ┤ ņłśņåī ņĀĢņĀ£ļź╝ ņ£äĒĢ£ ņłśņåīļČäļ”¼ļ¦ē ņĀ£ņĪ░ņŚÉ Ļ░üĻ┤æļ░øļŖö ņ×¼ļŻīņØ┤ļŗż [1-3]. ĻĘĖļ¤¼ļéś ĒīöļØ╝ļōÉņØś ļ╣äņŗ╝ Ļ░ĆĻ▓®ņ£╝ļĪ£ ņØĖĒĢ┤ ĒīöļØ╝ļōÉ ļ░Å ĒīöļØ╝ļōÉĒĢ®ĻĖłņØä ĻĖ░ļ░śņ£╝ļĪ£ ĒĢ£ ļČäļ”¼ļ¦ēņØĆ Ļ▓ĮņĀ£ņĀüņØ┤ņ¦Ć ņĢŖņ£╝ļ®░, Ļ│Āņś©ņŚÉņä£ ņāüļ│ĆĒÖöļĪ£ ņØĖĒĢ£ ņłśņåīņĘ©ņä▒ ļō▒ņØś ļ¼ĖņĀ£ņĀÉņØ┤ ņ׳ļŗż [4]. ļö░ļØ╝ņä£ ĒīöļØ╝ļōÉņØä ļīĆņ▓┤ĒĢĀ ņłś ņ׳ļŖö ĻĖłņåŹĒĢ®ĻĖłņŚÉ ĒīöļØ╝ļōÉņØä ņ¢ćĻ▓ī ņĮöĒīģĒĢ£ ļČäļ”¼ļ¦ēņØ┤ ņŻ╝ļ¬®ļ░øĻ│Ā ņ׳ļŗż [5]. ĒīöļØ╝ļōÉņØĆ ņŖżĒŹ╝Ēä░ļ¦ü, ĒÖöĒĢÖņ”Øņ░®(CVD) [6], ņĀäĒĢ┤ļÅäĻĖł, ļ¼┤ņĀäĒĢ┤ļÅäĻĖł [7], spray pyrolysis ļō▒ņØś ļ░®ļ▓Ģņ£╝ļĪ£ ņłśņåīļČäļ”¼ļ¦ēņŚÉ ņĮöĒīģĒĢĀ ņłś ņ׳ņ£╝ļ®░, ĒīöļØ╝ļōÉ ļÅäĻĖłņŗ£ ļ░£ņāØĒĢ£ ļÅäĻĖłĒÅÉņĢĪņŚÉļŖö 0.1 g/L ļ»Ėļ¦īņØś ĒīöļØ╝ļōÉņØ┤ ĒĢ©ņ£ĀļÉśņ¢┤ ņ׳ļŗż. Ļ│╝Ļ▒░ ļÅäĻĖłĒÅÉņłśņŚÉ ĒżĒĢ©ļÉ£ ļ»Ėļ¤ēņØś ĒīöļØ╝ļōÉņØĆ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ĒÜīņłśĒĢśĻĖ░ ņ¢┤ļĀżņøī ĒÅÉņłśņÖĆ ĒĢ©Ļ╗ś ļ▓äļĀżņĪīņ£╝ļéś, ņĢäņŚ░ĻĖłņåŹļČäļ¦ÉņØä ņ▓©Ļ░ĆĒĢśļ®┤ ņØ┤ņś©ĒÖöĻ▓ĮĒ¢ź ņ░©ņØ┤ņŚÉ ņØśĒĢ┤ ĒīöļØ╝ļōÉņØä ĒÖśņøÉņŗ£ņ╝£ ņēĮĻ▓ī ļåŹņČĢĒĢĀ ņłś ņ׳ļŗż. ņØ┤ ļĢī ņ╣śĒÖśņĀ£ļĪ£ ņ▓©Ļ░ĆĒĢ£ ņØ╝ļČĆ ņĢäņŚ░ĻĖłņåŹņØ┤ ĒÖśņøÉļÉ£ ĒīöļØ╝ļōÉ ĻĖłņåŹ ļé┤ļČĆņŚÉ ņ×öņĪ┤ĒĢśļŖöļŹ░, ņØ┤ļŖö ņÖĖļČĆļź╝ ļæśļ¤¼ņŗĖĻ│Ā ņ׳ļŖö ĒīöļØ╝ļōÉņØ┤ ļ©╝ņĀĆ ņ╣©ņČ£ļÉśņ¢┤ņĢ╝ ņÜ®ĒĢ┤ļÉĀ ņłś ņ׳ļŗż. ļö░ļØ╝ņä£ ņ╣śĒÖś(cementation)ļÉ£ ĻĖłņåŹņŚÉņä£ Ļ│Āņł£ļÅäņØś ĒīöļØ╝ļōÉņØä ĒÜīņłśĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ļ░śļō£ņŗ£ ņ╣śĒÖśļ¼╝ņØś ņ╣©ņČ£Ļ│╝ņĀĢņØ┤ ĒĢäņÜöĒĢśļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ĻĘĆĻĖłņåŹņØĖ ĒīöļØ╝ļōÉņØĆ ņ╣©ņČ£ņØ┤ ņ¢┤ļĀżņÜ░ļ®░, ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ņĪ░Ļ▒┤ņŚÉņä£ ņĢäņŚ░ņØĆ ņÖäņĀäĒ׳ ņ╣©ņČ£ļÉśļ»ĆļĪ£ ņ╣©ņČ£ņĢĪņŚÉņä£ ļæÉ ĻĖłņåŹņØä ļČäļ”¼ĒĢ┤ņĢ╝ ĒĢ£ļŗż [8].
ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉņä£ ĒīöļØ╝ļōÉ ņ╣©ņČ£ņØä ņ£äĒĢ┤ ņé░ĒÖöņĀ£ļź╝ ņ▓©Ļ░ĆĒĢ£ ņŚ╝ņé░ ļ░Å ĒÖ®ņé░ ņÜ®ņĢĪņŚÉ ļīĆĒĢ┤ ņĪ░ņé¼Ē¢łļŗż [8]. ĻĖ░ņĪ┤ņŚÉļŖö ĒÅÉņ×ÉņøÉņŚÉņä£ ĒīöļØ╝ļōÉņØä ĒÜīņłśĒĢśĻĖ░ ņ£äĒĢ┤ ņŚ╝ņé░ ļ░Å ņÖĢņłśļź╝ ņŻ╝ļĪ£ ņé¼ņÜ®Ē¢łņ£╝ļéś, 5 M ĒÖ®ņé░ņÜ®ņĢĪņŚÉ ņé░ĒÖöņĀ£ļĪ£ NaClOļź╝ ņ▓©Ļ░ĆĒĢśļ®┤ ĒīöļØ╝ļōÉņØś ņ╣©ņČ£ņØ┤ Ļ░ĆļŖźĒĢśļŗż [8]. ļö░ļØ╝ņä£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ©╝ņĀĆ ĒĢ®ņä▒ ĒÖ®ņé░ņ╣©ņČ£ņĢĪņØä ņĀ£ņĪ░ĒĢ┤ ņāüņÜ®ĒÖö ņČöņČ£ņĀ£ņŚÉ ņØśĒĢ£ ĒīöļØ╝ļōÉĻ│╝ ņĢäņŚ░ņØś ļČäļ”¼ņŚÉ ļīĆĒĢ┤ ņĪ░ņé¼Ē¢łļŗż. ņØ┤ ļĢī ņŗżņĀ£ ņ╣śĒÖśļÉ£ ĒīöļØ╝ļōÉ ĻĖłņåŹņØś ņĪ░ņä▒ņØä Ļ│ĀļĀżĒĢ┤ ņ╣śĒÖśņĀ£ņØĖ ņĢäņŚ░ņØś ļåŹļÅäļź╝ ļåÆĻ▓ī ņäżņĀĢĒ¢łņ£╝ļ®░, ĒīöļØ╝ļōÉ(II)Ļ│╝ ņĢäņŚ░(II)ņØś ļåŹļÅäļŖö Ļ░ü 0.1Ļ│╝ 0.5 g/LļĪ£ Ļ│ĀņĀĢĒ¢łļŗż. ĒīöļØ╝ļōÉĻ│╝ ņĢäņŚ░ņØś ļČäļ”¼ļź╝ ļ¬®ņĀüņ£╝ļĪ£ ņÜ®ļ¦żņČöņČ£ņŗ£ ĒÖ®ņé░Ļ│╝ ņČöņČ£ņĀ£ņØś ļåŹļÅäĻ░Ć ņČöņČ£ļźĀņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢ┤ ņĪ░ņé¼Ē¢łĻ│Ā, ĒīöļØ╝ļōÉņØä ņäĀĒāØņĀüņ£╝ļĪ£ ņČöņČ£ĒĢśļŖö Cyanex 301, LIX 63, LIX 84-I, Aliquat 336ņŚÉ ļīĆĒĢ┤ ĒāłĻ▒░ ņŗżĒŚśņØä ņłśĒ¢ēĒ¢łļŗż. ĒāłĻ▒░ ņŗżĒŚśņŚÉļŖö ļ¼┤ĻĖ░ņé░ ļ░Å ļ¼ĖĒŚīņŚÉ ļ│┤Ļ│ĀļÉ£ ĒāłĻ▒░ņĀ£ļź╝ ņé¼ņÜ®Ē¢łņ£╝ļ®░, ĒāłĻ▒░Ļ░Ć ņ¢┤ļĀżņÜ┤ Cyanex 301ņØś Ļ▓ĮņÜ░ ņŚ╝ņé░Ļ│╝ ĒÖ®ņé░ņŚÉ ņé░ĒÖöņĀ£ļź╝ ņ▓©Ļ░ĆĒĢ£ ĒĢ®ņä▒ņÜ®ņĢĪņ£╝ļĪ£ ĒāłĻ▒░ļź╝ ņŗ£ļÅäĒ¢łļŗż. ĒĢ®ņä▒ņÜ®ņĢĪņŚÉņä£ ņ¢╗ņØĆ ņĄ£ņĀüņĪ░Ļ▒┤ņØä ĒīöļØ╝ļōÉ ņ╣śĒÖśļ¼╝ņØś ņŗżņĀ£ ĒÖ®ņé░ņ╣©ņČ£ņĢĪņŚÉ ņĀüņÜ®Ē¢łņ£╝ļ®░, ĒĢ®ņä▒ņÜ®ņĢĪĻ│╝ ņŗżņĀ£ ņ╣©ņČ£ņĢĪņŚÉņä£ ļæÉ ĻĖłņåŹņØś ņČöņČ£Ļ│╝ ļČäļ”¼ Ļ▓░Ļ│╝ļź╝ ļ╣äĻĄÉĒ¢łļŗż.
2. ņŗżĒŚśņ×¼ļŻī ļ░Å ņŗżĒŚśļ░®ļ▓Ģ
2.1 ņŗżĒŚśņ×¼ļŻī
ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ ņÜ®ļ¦żņČöņČ£ņŚÉ ņØśĒĢ£ ĒīöļØ╝ļōÉĻ│╝ ņĢäņŚ░ņØś ņČöņČ£ Ļ▒░ļÅÖņØä ņĪ░ņé¼ĒĢśĻĖ░ ņ£äĒĢ┤ ĒÖ®ņé░ĒīöļØ╝ļōÉ(PdSO4, Aldrich, 98%)Ļ│╝ ĒÖ®ņé░ņĢäņŚ░ņłśĒÖöļ¼╝(ZnSO4┬Ę7H2O, Duksan Pure Chemical Co., LTD., 99%)ņØä ņ”ØļźśņłśņŚÉ ņÜ®ĒĢ┤ņŗ£ņ╝£ ļæÉ ĻĖłņåŹņØ┤ Ēś╝ĒĢ®ļÉ£ ņÜ®ņĢĪņØä ņżĆļ╣äĒ¢łļŗż. ĻĖłņåŹņØś ļåŹļÅäļŖö ĒīöļØ╝ļōÉ 0.1 g/L, ņĢäņŚ░ 0.5 g/LļĪ£ Ļ│ĀņĀĢĒ¢łļŗż. ļśÉĒĢ£ ņÜ®ņĢĪņØś ņé░ļÅäļŖö ĒÖ®ņé░(H2SO4, Daejung Co., 95%)ņ£╝ļĪ£ ņĪ░ņĀłĒ¢łļŗż. ņé░ņä▒ ņČöņČ£ņĀ£ļĪ£ D2EHPA (Cytec Ind., 95%), PC 88A(Cytec Ind., 95%), Cyanex 272 (Cytec Ind., 85%), Cyanex 301 (Cytec Ind., 70%), Versatic acid 10 (Cytec Ind.), LIX 63 (Cytec Ind., 70%), LIX 84 (BASF Co., 99.9%)ļź╝ ņé¼ņÜ®Ē¢łĻ│Ā, ņżæņä▒ ņČöņČ£ņĀ£ļĪ£ TBP (Yakuri Pure Chemical Co., 98%), TOP (Samchum Co., 99%), DOS (Alfa Aesar, 97%), TOPO (Samchum Co., 99%)ļź╝ ņé¼ņÜ®Ē¢łņ£╝ļ®░, ņØīņØ┤ņś© ņČöņČ£ņĀ£ļĪ£ Alamine 300 (TOA, Samchum Co., 97%), Alamine 336 (BASF Co., 95%), Aliquat 336 (BASF Co. LTd., 93%)ņØä ņé¼ņÜ®Ē¢łĻ│Ā, ĒؼņäØņĀ£ļĪ£ļŖö ļō▒ņ£Ā(Daejung Co.)ļź╝ ņé¼ņÜ®Ē¢łļŗż. Aliquat 336ņØś Ļ▓ĮņÜ░ ņÜ®ļ¦żņČöņČ£ņŗ£ ņĀ£ 3ņāüņØś ĒśĢņä▒ņØä ņ¢ĄņĀ£ĒĢśĻĖ░ ņ£äĒĢ┤ Ļ░£ņ¦łņĀ£ļĪ£ 10%ņØś 1-decanol (Daejung Co., >98%)ņØä ņ▓©Ļ░ĆĒ¢łļŗż. ĒāłĻ▒░ņÜ®ņĢĪņØĆ ĒÖ®ņé░, ņŚ╝ņé░(HCl, Daejung Co., 35%), ņ¦łņé░(HNO3, Daejung Co., 60%)ņÜ®ņĢĪņŚÉ Ļ│╝ņé░ĒÖöņłśņåī(H2O2, Daejung Co., >30%), ņ░©ņĢäņŚ╝ņåīņé░ļéśĒŖĖļź©(NaClO, Sigma-Aldrich, 10-15%), ņŚ╝ņåīņé░ļéśĒŖĖļź©(NaClO3, Daejung Co., >98%)ņØä ņ▓©Ļ░ĆĒĢ┤ ņĀ£ņĪ░Ē¢łņ£╝ļ®░, ņØ┤ņÖĖņŚÉļÅä NH3 (Junsei Co., 28%) ņÜ®ņĢĪ, NH4Cl (Duksan Co., >99%), thiourea ((NH2)2CS, Daejung Co., >96%), NaOH (Daejung Co., >98%), NaCl (Tedia Company, Inc., 99%)ņØä ņé¼ņÜ®Ē¢łļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉ ņé¼ņÜ®ļÉ£ ļ¬©ļōĀ ņŗ£ņĢĮņØĆ ļČäņäØļō▒ĻĖēņØ┤ļ®░, ņČöņČ£ņĀ£ ļ░Å ļō▒ņ£ĀļŖö ļ│äļÅäņØś ņĀĢņĀ£ņŚåņØ┤ ņé¼ņÜ®Ē¢łļŗż. ļÅäĻĖłĒÅÉņĢĪņŚÉņä£ ņĢäņŚ░ņ£╝ļĪ£ ņ╣śĒÖśļÉ£ ĒīöļØ╝ļōÉĻĖłņåŹņØĆ ĻĄŁļé┤ņØś ĒĢ£ ņŚģņ▓┤ļĪ£ļČĆĒä░ ņĀ£Ļ│Ąļ░øņĢśņ£╝ļ®░, ņ╣śĒÖśļÉ£ ĒīöļØ╝ļōÉĻĖłņåŹņØĆ ļČłņł£ļ¼╝ņØä ņĀ£Ļ▒░ĒĢśĻĖ░ ņ£äĒĢ┤ ņ¦äĒĢ£ ņŚ╝ņé░ņÜ®ņĢĪņ£╝ļĪ£ ņłśĒÜī ņäĖņ▓ÖĒ¢łļŗż.
2.2 ņŗżĒŚśļ░®ļ▓Ģ
ņÜ®ļ¦żņČöņČ£ņŗżĒŚśņØä ĒåĄĒĢ┤ ĒīöļØ╝ļōÉ(II)Ļ│╝ ņĢäņŚ░(II)ņØś ļČäļ”¼ņŚÉ ĒÜ©Ļ│╝ņĀüņØĖ ņČöņČ£ņĀ£ļź╝ ņäĀņĀĢĒĢśĻĖ░ ņ£äĒĢ┤ ĒĢ®ņä▒ņÜ®ņĢĪņØä ņĀ£ņĪ░ĒĢ┤ ņŗżĒŚśĒ¢łļŗż. ĒĢ®ņä▒ņÜ®ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II)Ļ│╝ ņĢäņŚ░(II)ņØś ļåŹļÅäļŖö Ļ░üĻ░ü 0.1Ļ│╝ 0.5 g/LļĪ£ Ļ│ĀņĀĢĒ¢łņ£╝ļ®░ ĒÖ®ņé░Ļ│╝ ņČöņČ£ņĀ£ ļåŹļÅäļź╝ ļ│ĆĒÖöņŗ£ņ╝£ ĻĖłņåŹņØś ņČöņČ£Ļ▒░ļÅÖņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņĪ░ņé¼Ē¢łļŗż. ĒĢ£ĒÄĖ ļÅäĻĖłĒÅÉņĢĪņŚÉņä£ ņĢäņŚ░ļČäļ¦ÉļĪ£ ņ╣śĒÖśĒĢ£ ĒīöļØ╝ļōÉņØś ņŗżņĀ£ ņ╣©ņČ£ņĢĪņØä ņ¢╗ĻĖ░ ņ£äĒĢ┤ ĒīöļØ╝ļōÉ ņ╣śĒÖśļČäļ¦ÉņØä 2 g/LņØś Ļ┤æņĢĪļåŹļÅäņĪ░Ļ▒┤ņ£╝ļĪ£ 25 oCņØś 5 M ĒÖ®ņé░ņÜ®ņĢĪņŚÉ 1.5% NaClOļź╝ ņ▓©Ļ░ĆĒĢ┤ 2ņŗ£Ļ░ä ļÅÖņĢł ņ╣©ņČ£ĒĢ┤ ņÖäņĀäĒ׳ ņÜ®ĒĢ┤ņŗ£ņ╝░ļŗż. ņāüĻĖ░ ņĪ░Ļ▒┤ņŚÉņä£ ņ¢╗ņØĆ ņ╣©ņČ£ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II)Ļ│╝ ņĢäņŚ░(II)ņØś ļåŹļÅäļŖö Ļ░üĻ░ü 1.926 g/LņÖĆ 0.074 g/LņØ┤ņŚłļŗż.
ņÜ®ļ¦żņČöņČ£ ņŗżĒŚśņØĆ Burrell wrist action shaker (model 75, USA)ļź╝ ņé¼ņÜ®ĒĢ┤ ņØ╝ņĀĢ ļČĆĒö╝ņØś ņłśņāü ļ░Å ņ£ĀĻĖ░ņāüņØä 50 mL Ļ┤æĻĄ¼ļ│æņŚÉ ļäŻĻ│Ā 30ļČäĻ░ä ĻĄÉļ░śĒĢ┤ ņłśĒ¢ēĒ¢łņ£╝ļ®░, ĻĄÉļ░śĒøä Ēś╝ĒĢ®ņÜ®ņĢĪņØä ļČäņĢĪĻ╣öļĢīĻĖ░ņŚÉņä£ 30ļČäĻ░ä ņĀĢņ╣śĒĢśņŚ¼ ņłśņāüĻ│╝ ņ£ĀĻĖ░ņāüņ£╝ļĪ£ ļČäļ”¼Ē¢łļŗż. ņØ┤ļĢī ļČäļ”¼ĒĢ£ ņ£ĀĻĖ░ņāüņØĆ ĒāłĻ▒░ņŗżĒŚśņŚÉ ņé¼ņÜ®Ē¢łļŗż. ņČöņČ£Ēøä ņłśņāüņŚÉ ņ×öņĪ┤ĒĢśļŖö ĻĖłņåŹļåŹļÅäļŖö ICP-OES (Arcos, Spectro, Germany)ļĪ£ ņĖĪņĀĢĒ¢łĻ│Ā, ņ£ĀĻĖ░ņāüņŚÉ ņČöņČ£ļÉ£ ĻĖłņåŹļåŹļÅäļŖö ļ¼╝ņ¦łņłśņ¦ĆļĪ£ ĻĄ¼Ē¢łļŗż. ĻĖłņåŹņØ┤ņś©ņØś ņČöņČ£ļźĀĻ│╝ ĒāłĻ▒░ņ£©ņØä ĻĄ¼ĒĢśļŖö ņŗØņØä ļŗżņØīņŚÉ ļéśĒāĆļāłļŗż.
ņŚ¼ĻĖ░ņä£ miniĻ│╝ meļŖö Ļ░üĻ░ü ņČöņČ£ ņĀäĒøä ņłśņāüņŚÉņä£ ĻĖłņåŹņØś ņ¦łļ¤ēņØä ņØśļ»ĖĒĢśĻ│Ā, m*iniĻ│╝ m*eļŖö ĒāłĻ▒░ ņĀäĒøä ņ£ĀĻĖ░ņāüņŚÉņä£ ĻĖłņåŹņØś ņ¦łļ¤ēņØä ļéśĒāĆļéĖļŗż.
3. Ļ▓░Ļ│╝ ļ░Å Ļ│Āņ░░
3.1 ņÜ®ļ¦żņČöņČ£ ņŗ£ ņé░ ļåŹļÅäņØś ņśüĒ¢ź
ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ ņÜ®ļ¦żņČöņČ£ņŚÉ ņØśĒĢ£ ĒīöļØ╝ļōÉ(II)Ļ│╝ ņĢäņŚ░(II)ņØś ņČöņČ£Ļ▒░ļÅÖņØä ļŗżņ¢æĒĢ£ ņāüņÜ®ĒÖö ņČöņČ£ņĀ£ļź╝ ņé¼ņÜ®ĒĢ┤ ņĪ░ņé¼Ē¢łļŗż. ņØ┤ļĢī ņČöņČ£ņĀ£ ļåŹļÅäļŖö 0.1 MļĪ£ Ļ│ĀņĀĢĒ¢łĻ│Ā, ĒÖ®ņé░ ļåŹļÅäļŖö 0.5ņŚÉņä£ 9 MĻ╣īņ¦Ć ļ│ĆĒÖöņŗ£ņ╝░ļŗż.
3.1.1 ņé░ņä▒ ņČöņČ£ņĀ£
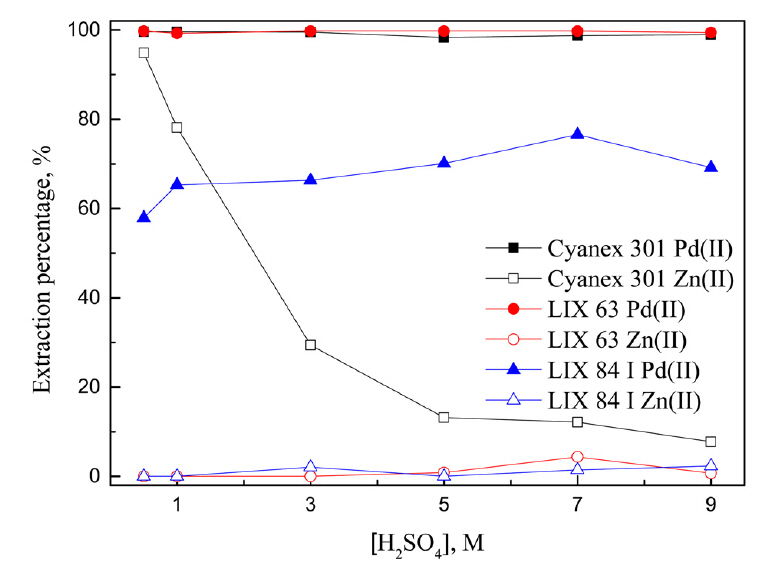
ĒĢ®ņä▒ņÜ®ņĢĪņŚÉņä£ ņé░ņä▒ ņČöņČ£ņĀ£ļĪ£ ņČöņČ£ņŗżĒŚśĒĢ£ Ļ▓░Ļ│╝ D2EHPA, PC88A, Cyanex 272, versatic acidļŖö ļ│Ė ņŗżĒŚśņĪ░Ļ▒┤ņŚÉņä£ ņĄ£ļīĆ ņČöņČ£ļźĀņØ┤ 10% ļ»Ėļ¦īņ£╝ļĪ£ ļé«ņĢä Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ņŚÉ ļéśĒāĆļé┤ņ¦Ć ņĢŖņĢśņ£╝ļ®░, Cyanex 301, LIX 63, LIX 84-IņŚÉ ņØśĒĢ£ ĻĖłņåŹņØ┤ņś©ņØś ņČöņČ£Ļ▒░ļÅÖņØä ĻĘĖļ”╝ 1ņŚÉ ļéśĒāĆļāłļŗż. Cyanex 301ņØĆ ņé░ ļåŹļÅäņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ ĒīöļØ╝ļōÉ(II)ņØä 99% ņØ┤ņāü ņČöņČ£Ē¢łņ£╝ļ®░, ņĢäņŚ░(II)ņØś ņČöņČ£ļźĀņØĆ ņé░ ļåŹļÅäĻ░Ć 0.5ņŚÉņä£ 9MļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ 94.9%ņŚÉņä£ 7.8%ļĪ£ Ļ░ÉņåīĒ¢łļŗż. LIX ņČöņČ£ņĀ£ļŖö ņé░ļåŹļÅäņØś ņśüĒ¢źņØä Ļ▒░ņØś ļ░øņ¦Ć ņĢŖņĢśņ£╝ļ®░, LIX 63ņØĆ ĒīöļØ╝ļōÉ(II)ņØä 99% ņØ┤ņāü ņČöņČ£Ē¢łĻ│Ā, LIX 84 IļŖö ĒÅēĻĘĀņĀüņ£╝ļĪ£ ņĢĮ 60%ņØś ĒīöļØ╝ļōÉ(II)ņØä ņČöņČ£Ē¢łļŗż. LIX 63Ļ│╝ LIX 84-IņŚÉņä£ ņĢäņŚ░(II)ņØĆ Ļ▒░ņØś ņČöņČ£ļÉśņ¦Ć ņĢŖņĢśļŗż.
Cyanex 301ņŚÉ ņØśĒĢ£ ņĢäņŚ░(II)ņØś ņØ┤ņś©ĻĄÉĒÖśļ░śņØæĻ│╝ LIX 63/LIX84-IņŚÉ ņØśĒĢ£ ĒīöļØ╝ļōÉ(II)ņØś ņÜ®ļ¦żĒÖöļ░śņØæņØä ņŗØ (3)Ļ│╝ (4)ņŚÉ ļéśĒāĆļāłļŗż. ņŗØ (3)ņŚÉ ņØśĒĢ┤ ņĢäņŚ░(II)ņØ┤ ņČöņČ£ļÉśļŖö Ļ▓ĮņÜ░ ņÜ®ņĢĪņØś pHļŖö ļ¦żņÜ░ ņżæņÜöĒĢśļŗż. Cyanex 301ņØś pKaļŖö 2.61ļĪ£ ļé«ņØĆ pHņŚÉņä£ļÅä ņĢäņŚ░(II)ņØś ņČöņČ£ņØ┤ Ļ░ĆļŖźĒĢśņ¦Ćļ¦ī, ĒÖ®ņé░ļåŹļÅäĻ░Ć 0.5 M ņØ┤ņāüņØĖ Ļ░ĢĒĢ£ ņé░ņä▒ņÜ®ņĢĪņŚÉņä£ Cyanex 301ņØĆ ĒĢ┤ļ”¼ļÉśĻĖ░ ņ¢┤ļĀĄĻĖ░ ļĢīļ¼ĖņŚÉ ĒÖ®ņé░ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ ņĢäņŚ░(II)ņØś ņČöņČ£ļźĀņØ┤ ĻĖēĻ▓®Ē׳ Ļ░ÉņåīĒĢ£ļŗż [9,10]. ĻĘĖļ¤¼ļéś ĒīöļØ╝ļōÉ(II)ņØĆ ņé░ ļåŹļÅäņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ Cyanex 301ņŚÉ 99.9% ņØ┤ņāü ņČöņČ£ļÉśņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ ņé¼ņŗżļĪ£ļČĆĒä░ ņ¦äĒĢ£ ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØś ņČöņČ£ņØĆ ņØ┤ņś©ĻĄÉĒÖś ļ░śņØæņØ┤ ņĢäļŗī ņŗØ (4)ņØś ņÜ®ļ¦żĒÖöļ░śņØæņŚÉ ņØśĒĢ£ Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢĀ ņłś ņ׳ļŗż. HSAB ņØ┤ļĪĀņŚÉ ļö░ļź┤ļ®┤ ĒīöļØ╝ļōÉ(II)ņØĆ ļ¼┤ļźĖņé░ņ£╝ļĪ£ Ļ░äņŻ╝ļÉśĻ│Ā Cyanex 301ņØś ņ×æņÜ®ĻĖ░ņØĖ Ēŗ░ņśżĒżņŖżĒżļ”┤ĻĖ░(-PSSH)ļŖö ļ¼┤ļźĖņŚ╝ĻĖ░ļĪ£ Ļ░äņŻ╝ļÉ£ļŗż. ļö░ļØ╝ņä£ ĒīöļØ╝ļōÉ(II)Ļ│╝ Cyanex 301 ņé¼ņØ┤ņŚÉļŖö Ļ░ĢļĀźĒĢ£ Ļ▓░ĒĢ®ņØ┤ ĒśĢņä▒ļÉśļ»ĆļĪ£ ņ¦äĒĢ£ ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ļÅä ņČöņČ£ņØ┤ ņל ņØ╝ņ¢┤ļéĀ ņłś ņ׳ļŗż [11,12]. ļśÉĒĢ£ ņØ┤ļŖö PdSņÖĆ ZnSņØś ņÜ®ĒĢ┤ļÅäņĀü(Solubility Product, KSP)ņØ┤ Ļ░üĻ░ü 1.16 ├Ś 10-58Ļ│╝ 2.0 ├Ś 10-25ņ£╝ļĪ£ Zn(II)ļ│┤ļŗż Pd(II)ņÖĆ S2- ņé¼ņØ┤ņØś Ļ▓░ĒĢ®ņØ┤ Ēø©ņö¼ ņäĖļŗżļŖö Ļ▓āĻ│╝ ņל ņØ╝ņ╣śĒĢ£ļŗż [11,12].
Cyanex 301Ļ│╝ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ LIX 63Ļ│╝ LIX 84-IņŚÉ ņØśĒĢ£ ĒīöļØ╝ļōÉ(II)ņØś ņČöņČ£ ļ░śņØæņØĆ ņŗØ (4)ņØś ņÜ®ļ¦żĒÖö ļ░śņØæņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż [13]. ņØ╝ļ░śņĀüņ£╝ļĪ£ ņŚ╝ņé░ņÜ®ņĢĪņØś Ļ▓ĮņÜ░ ņé░ ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņŚ╝ņåīņØ┤ņś© ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢśĻ│Ā, ņØ┤ļŖö PdCl42- ņ░®ļ¼╝ņØś ĒśĢņä▒ņØä ņ┤ēņ¦äĒĢśļ»ĆļĪ£ LIX ņČöņČ£ņĀ£ņŚÉņä£ ĒīöļØ╝ļōÉņØś ņČöņČ£ļźĀņØĆ Ļ░ÉņåīĒĢ£ļŗż [12,13]. ĻĘĖļ¤¼ļéś ņŚ╝ņé░ņÜ®ņĢĪĻ│╝ ļŗ¼ļ”¼ ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØĆ ņé░ ļåŹļÅäņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ LIX 63Ļ│╝ LIX 84-IņŚÉ ņČöņČ£ļÉśĻ│Ā, ņØ┤ ļĢī ņĢäņŚ░(II)ņØĆ Ļ▒░ņØś ņČöņČ£ļÉśņ¦Ć ņĢŖņĢśļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ņ¦äĒĢ£ ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ļŖö ĒÖ®ņé░ņØś 1ņ░© ĒĢ┤ļ”¼ļ¦ī ņØ╝ņ¢┤ļéśļ»ĆļĪ£ ĒÖ®ņé░ņØ┤ ņŻ╝ļĪ£ HSO4-ņØ┤ņś©ņ£╝ļĪ£ ņĪ┤ņ×¼ĒĢ£ļŗż. ļö░ļØ╝ņä£ ĒÖ®ņé░ņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØĆ HSO4-Ļ│╝ ļ░śņØæņØä ĒåĄĒĢ┤ ņĀäĻĖ░ņĀüņ£╝ļĪ£ ņżæņä▒ņØĖ ļČäņ×Éļź╝ ĒśĢņä▒ĒĢśņŚ¼ ņÜ®ļ¦żĒÖöļ░śņØæņØä ĒåĄĒĢ┤ ņ£ĀĻĖ░ņāüņ£╝ļĪ£ ņČöņČ£ļÉĀ ņłś ņ׳ļŗż [14]. ļö░ļØ╝ņä£ ņŚ╝ņé░ņÜ®ņĢĪņØś Ļ▓░Ļ│╝ņÖĆ ļŗ¼ļ”¼ ņ¦äĒĢ£ ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ļŖö LIXņŚÉ ņØśĒĢ£ ņČöņČ£ņØ┤ Ļ░ĆļŖźĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.
3.1.2 ņżæņä▒ ņČöņČ£ņĀ£
ņżæņä▒ ņČöņČ£ņĀ£ļĪ£ TBP, TOP, TOPO, DOSļź╝ ņé¼ņÜ®Ē¢łĻ│Ā ņŗżĒŚśĻ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 2ņŚÉ ļéśĒāĆļāłļŗż. ņŗżĒŚśĻ▓░Ļ│╝ TBP, TOP, TOPOņŚÉņä£ ĒīöļØ╝ļōÉ(II)Ļ│╝ ņĢäņŚ░(II)ņØś ņČöņČ£ļźĀņØĆ ļ¦żņÜ░ ļé«ņĢśĻ│Ā, TOPOņŚÉņä£ ņĢäņŚ░(II)ņØĆ ņĀäĒśĆ ņČöņČ£ļÉśņ¦Ć ņĢŖņĢśļŗż. DOSļź╝ ņĀ£ņÖĖĒĢ£ ņżæņä▒ ņČöņČ£ņĀ£ņżæ TBPņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØś ņČöņČ£ļźĀņØ┤ Ļ░Ćņן ļåÆņĢśļŖöļŹ░, ĒÖ®ņé░ļåŹļÅäĻ░Ć 0.5ņŚÉņä£ 9MļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒīöļØ╝ļōÉ(II)ņØś ņČöņČ£ļźĀņØ┤ 0ņŚÉņä£ 7.9%ļĪ£ ņĢĮĻ░ä ņ”ØĻ░ĆĒ¢łļŗż. ņØ┤ņÖĆ ļŗ¼ļ”¼ DOSņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØś ņČöņČ£ļźĀņØĆ ļåÆņĢśļŖöļŹ░, ĒÖ®ņé░ļåŹļÅäĻ░Ć 0.5ņŚÉņä£ 9 MļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņČöņČ£ļźĀņØ┤ 43.9ņŚÉņä£ 99%ņØ┤ņāüņ£╝ļĪ£ ņ”ØĻ░ĆĒ¢łņ£╝ļ®░, DOSņŚÉ ņØśĒĢ£ ĒīöļØ╝ļōÉ(II)ņØś ņČöņČ£ļ░śņØæņØä ļŗżņØī ņŗØņŚÉ ļéśĒāĆļāłļŗż.
DOSļŖö Cyanex 301Ļ│╝ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņ×æņÜ®ĻĖ░ņŚÉ ĒÖ® ņøÉņ×Éļź╝ ĒżĒĢ©ĒĢśĻ│Ā ņ׳ņ£╝ļ®░, HSAB ņøÉļ”¼ņŚÉ ņØśĒĢ┤ ĒīöļØ╝ļōÉ(II)ņØä ņäĀĒāØņĀüņ£╝ļĪ£ ņČöņČ£ĒĢĀ ņłś ņ׳ļŗż. ņāüĻĖ░ ņŗØņØĆ ĒÖ®ņé░ ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒīöļØ╝ļōÉ(II)ņØś ņČöņČ£ļźĀņØ┤ ņ”ØĻ░ĆĒĢśļŖö ņŗżĒŚśĻ▓░Ļ│╝ņÖĆ ņל ņØ╝ņ╣śĒĢ£ļŗż.
3.1.3 ņØīņØ┤ņś© ņČöņČ£ņĀ£
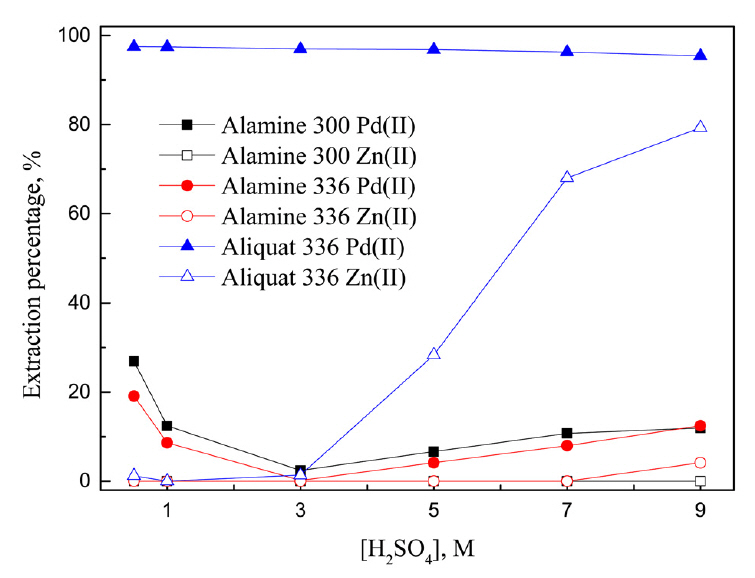
ņØīņØ┤ņś© ņČöņČ£ņĀ£ļĪ£ Alamine 300, Alamine 336, Aliquat 336ņØä ņé¼ņÜ®ĒĢ£ ņŗżĒŚśĻ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 3ņŚÉ ļéśĒāĆļāłļŗż. Alamine 300Ļ│╝ Alamine 336ņŚÉņä£ ĒÖ®ņé░ļåŹļÅäĻ░Ć 0.5ņŚÉņä£ 3MļĪ£ ņ”ØĻ░ĆĒĢśļ®┤ ĒīöļØ╝ļōÉ(II)ņØś ņČöņČ£ļźĀņØ┤ Ļ░üĻ░ü 26.9%ņÖĆ 2.4%ņŚÉņä£ 19.1%ņÖĆ 0.2%ļĪ£ Ļ░ÉņåīĒ¢łļŗż. ĒÖ®ņé░ļåŹļÅäĻ░Ć 3MņŚÉņä£ 9MļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒīöļØ╝ļōÉ(II)ņØś ņČöņČ£ļźĀņØĆ ļŗżņŗ£ Ļ░üĻ░ü 11.9%ņÖĆ 12.4%ļĪ£ ņ”ØĻ░ĆĒ¢łļŗż. Alamine 300ņŚÉņä£ ņĢäņŚ░(II)ņØĆ ņČöņČ£ļÉśņ¦Ć ņĢŖņĢśņ£╝ļ®░, Alamine 336ņŚÉņä£ļŖö 9 M ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ 4.1%ņØś ņĢäņŚ░(II)ņØ┤ ņČöņČ£ļÉśņŚłļŗż. ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ Alamine 300 ļ░Å Alamine 336Ļ│╝ Ļ░ÖņØĆ 3ņ░© ņĢäļ»╝ņØĆ ņØīņØ┤ņś© ĻĄÉĒÖśĻĖ░ļĪ£ ņ×æņÜ®ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ļ©╝ņĀĆ ĒÖ®ņé░Ļ│╝ ļ░śņØæĒĢ┤ ņ¢æņä▒ņ×ÉĒÖöĒĢ£ ļŗżņØī ĒīöļØ╝ļōÉ(II) ļśÉļŖö ņĢäņŚ░(II)ņØä ņČöņČ£ĒĢĀ ņłś ņ׳ļŗż [15]. ĻĘĖļ¤¼ļéś ĻĘĖļ”╝ 3ņŚÉņä£ Alamine 300Ļ│╝ Alamine 336ņØĆ ĒīöļØ╝ļōÉ(II)Ļ│╝ ņĢäņŚ░(II)ņŚÉ ļīĆĒĢ£ ņČöņČ£ļźĀņØ┤ ļé«Ļ│Ā, ļČäļ”¼ņä▒ņØ┤ ļ¢©ņ¢┤ņ¦Ćļ»ĆļĪ£ ņČöĻ░ĆņŗżĒŚśņØä ņłśĒ¢ēĒĢśņ¦Ć ņĢŖņĢśļŗż.
0.5 M ĒÖ®ņé░ņŚÉņä£ Aliquat 336ņŚÉ ņØśĒĢ┤ ĒīöļØ╝ļōÉ(II)ņØĆ 97.5% ņČöņČ£ļÉÉņ£╝ļ®░, ĒÖ®ņé░ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņČöņČ£ļźĀņØ┤ ņĢĮĻ░ä Ļ░ÉņåīĒĢ┤ 9 M ĒÖ®ņé░ņŚÉņä£ 95.4% ņČöņČ£ļÉÉļŗż. Aliquat 336ņŚÉņä£ ņĢäņŚ░(II)ņØĆ ĒÖ®ņé░ļåŹļÅäĻ░Ć 0.5ņŚÉņä£ 3MņØ╝ ļĢīļŖö Ļ▒░ņØś ņČöņČ£ļÉśņ¦Ć ņĢŖņĢśņ£╝ļéś 3 M ņØ┤ņāüņŚÉņä£ ņČöņČ£ļźĀņØ┤ ĻĖēĻ▓®Ē׳ ņāüņŖ╣ĒĢ┤ 9 M ĒÖ®ņé░ņŚÉņä£ 79.3%Ļ░Ć ņČöņČ£ļÉśņŚłļŗż. Aliquat 336ņŚÉ ņØśĒĢ£ ĒÖ®ņé░Ļ│╝ ĻĖłņåŹņØ┤ņś©ņØś ņČöņČ£ ļ░śņØæņŗØņØä ņŗØ (6)Ļ│╝ (7)ņŚÉ ļéśĒāĆļāłļŗż
ņŗØ (6)Ļ│╝ Ļ░ÖņØ┤ ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ Aliquat 336ņØś ņŚ╝ņåīņØ┤ņś©ņØ┤ HSO4-ļĪ£ ņ╣śĒÖśļÉĀ ņłś ņ׳ņ£╝ļ®░, ņŚ╝ņåīņØ┤ņś©ņØĆ ņ£ĀĻĖ░ņāüņŚÉņä£ ņłśņāüņ£╝ļĪ£ ņØ┤ļÅÖĒĢ£ļŗż [16]. ņłśņāüņ£╝ļĪ£ ņØ┤ļÅÖĒĢ£ ņŚ╝ņåīņØ┤ņś©ņØĆ ĒīöļØ╝ļōÉ(II)Ļ│╝ PdCl42- ņ░®ļ¼╝ņØä ĒśĢņä▒ĒĢśĻ│Ā HSO4-ļĪ£ ņ╣śĒÖśļÉ£ Aliquat 336Ļ│╝ ņØīņØ┤ņś© ĻĄÉĒÖś ļ░śņØæņŚÉ ņØśĒĢ┤ ņČöņČ£ļÉĀ ņłś ņ׳ļŗż. ļ¼ĖĒŚīņŚÉ ļö░ļź┤ļ®┤ NaHSO4ļź╝ ņé¼ņÜ®ĒĢ┤ Aliquat 336ņØś Clļź╝ HSO4-ļĪ£ ņ╣śĒÖśĒĢ£ [R4N+][HSO4-]ņŚÉ ņØśĒĢ┤ Pt(IV)ņØś ņČöņČ£ņØ┤ Ļ░ĆļŖźĒĢśļŗż [17]. ĒÖ®ņé░ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņĢäņŚ░(II)ņØś ņČöņČ£ļźĀņØ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØĆ ņŗØ (6)ņŚÉ ļö░ļØ╝ ņłśņāüņ£╝ļĪ£ ņØ┤ļÅÖĒĢ£ ņŚ╝ņåīņØ┤ņś©ņØ┤ ZnCl42-ļź╝ ĒśĢņä▒ĒĢ┤ Aliquat 336ņŚÉ ņČöņČ£ļÉśļŖö Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż. ļśÉļŖö ĒÖ®ņé░ņØ┤ņś©Ļ│╝ Ļ▓░ĒĢ®ĒĢ┤ Zn(SO4)42-ļź╝ ĒśĢņä▒ĒĢ©ņ£╝ļĪ£ņŹ© ņØīņØ┤ņś© ņČöņČ£ņĀ£ņØĖ Aliquat 336ņŚÉ ņČöņČ£ļÉĀ ņłś ņ׳ļŗż.
3.2 ņČöņČ£ņĀ£ ļåŹļÅäņØś ņśüĒ¢ź
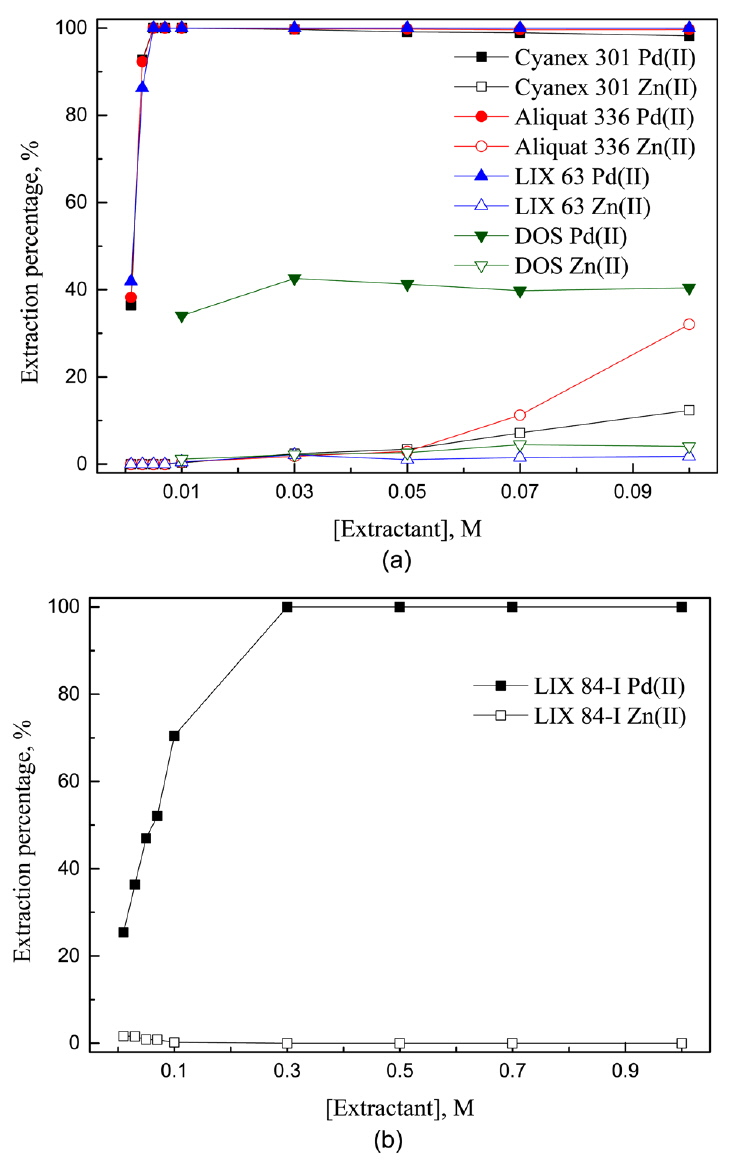
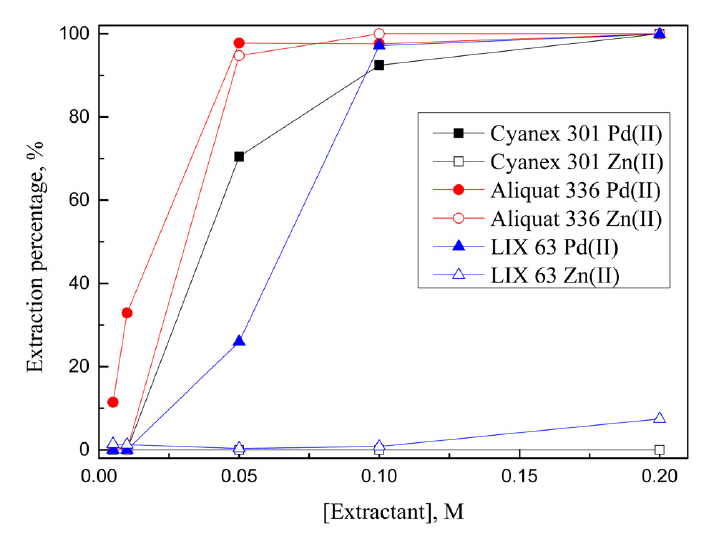
ļ│Ė ņŚ░ĻĄ¼ļŖö ņĢäņŚ░ņ£╝ļĪ£ ņ╣śĒÖśļÉ£ ĒīöļØ╝ļōÉ ĻĖłņåŹņØś ĒÖ®ņé░ ņ╣©ņČ£ņĢĪņŚÉņä£ ļæÉ ĻĖłņåŹņØś ļČäļ”¼ļź╝ ņ£äĒĢ£ ĒøäņåŹņŚ░ĻĄ¼ļĪ£ ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉņä£ ņ¢╗ņØĆ ņĄ£ņĀü ņ╣©ņČ£ņĪ░Ļ▒┤ņØĖ 5 M ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ ņČöņČ£ņĀ£ ļåŹļÅäļź╝ ļ│ĆĒÖöņŗ£ņ╝£ ĻĖłņåŹņØ┤ņś©ņØś ņČöņČ£Ļ▒░ļÅÖņØä ņĪ░ņé¼Ē¢łļŗż. 3.1ņĀłņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņŚÉ ļīĆĒĢ┤ ņäĀĒāØņä▒ņØ┤ ņÜ░ņłśĒ¢łļŹś Cyanex 301, LIX 63, LIX 84-I, DOS, Aliquat 336ņØä ņČöņČ£ņĀ£ļĪ£ ņé¼ņÜ®Ē¢łĻ│Ā, ņČöņČ£ņĀ£ ļåŹļÅäļź╝ 0.001ņŚÉņä£ 1MĻ╣īņ¦Ć ļ│ĆĒÖöņŗ£ņ╝£ ņ¢╗ņØĆ ņŗżĒŚśĻ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 4ņŚÉ ļéśĒāĆļāłļŗż.
Cyanex 301, Aliquat 336, LIX 63ņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØĆ ņ£Āņé¼ĒĢ£ ņČöņČ£Ļ▒░ļÅÖņØä ļ│┤ņśĆļŖöļŹ░, ņČöņČ£ņĀ£ ļåŹļÅäĻ░Ć 0.001ņŚÉņä£ 0.005 MļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒīöļØ╝ļōÉ(II)ņØś ņČöņČ£ļźĀņØ┤ ņ”ØĻ░ĆĒĢ┤ 0.005 M ņØ┤ņāüņŚÉņä£ļŖö 99% ņØ┤ņāü ņČöņČ£ļÉśņŚłļŗż. ņĢäņŚ░(II)ņØś Ļ▓ĮņÜ░ ņČöņČ£ņĀ£ ļåŹļÅäĻ░Ć 0.01 M ļ»Ėļ¦īņØ╝ ļĢī ņĀäĒśĆ ņČöņČ£ļÉśņ¦Ć ņĢŖņĢśņ£╝ļéś, 0.01ņŚÉņä£ 0.1 MļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ Cyanex 301ņŚÉņä£ļŖö 0.3%ņŚÉņä£ 12.3%ļĪ£, Aliquat 336ņŚÉņä£ļŖö 0.5%ņŚÉņä£ 32.0%ļĪ£ ņ”ØĻ░ĆĒ¢łļŗż. Cyanex 301ņŚÉņä£ ņČöņČ£ņĀ£ ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢśļ®┤ ņŗØ (3)ņØś ņĀĢļ░śņØæņØ┤ ņ┤ēņ¦äļÉśļ»ĆļĪ£ 5 M ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ļÅä ņĢäņŚ░(II)ņØ┤ ņČöņČ£ļÉĀ ņłś ņ׳ļŗż [10]. ļ░śļīĆļĪ£ ņČöņČ£ņĀ£ ļåŹļÅäļź╝ ļé«ņČöļ®┤ ņĢäņŚ░(II)ņØś ņČöņČ£ļźĀņØ┤ Ļ░ÉņåīĒĢśļ»ĆļĪ£ ĒīöļØ╝ļōÉ(II)ņØś ņäĀĒāØņĀüņØĖ ņČöņČ£ņØ┤ Ļ░ĆļŖźĒĢśļŗż. ļŗżņØīņ£╝ļĪ£ LIX 63ņØĆ ņČöņČ£ņĀ£ ļåŹļÅäĻ░Ć 0.01ņŚÉņä£ 0.1 MļĪ£ ņ”ØĻ░ĆĒ¢łņØīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņĢäņŚ░(II)ņØś ņČöņČ£ļźĀņØ┤ 2% ļ»Ėļ¦īņ£╝ļĪ£ ļé«ņĢä ĒīöļØ╝ļōÉ(II)Ļ│╝ ļČäļ”¼ņä▒ņØ┤ Ļ░Ćņן ņóŗņĢśļŗż. ņØ┤ņÖĆ ļŗ¼ļ”¼ DOSņŚÉņä£ļŖö ņČöņČ£ņĀ£ ļåŹļÅäĻ░Ć ņČöņČ£ļźĀņŚÉ Ēü░ ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖņĢśņ£╝ļ®░, ĒÅēĻĘĀņĀüņ£╝ļĪ£ ņĢĮ 40%ņØś ĒīöļØ╝ļōÉ(II)ņØ┤ ņČöņČ£ļÉśņŚłĻ│Ā ņĢäņŚ░(II)ņØĆ ņČöņČ£ņĀ£ ļåŹļÅäĻ░Ć 0.01ņŚÉņä£ 0.1 MļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ 1.2%ņŚÉņä£ 4.1%ļĪ£ ņČöņČ£ļźĀņØ┤ ņ”ØĻ░ĆĒ¢łļŗż. DOSņØś Ļ▓ĮņÜ░ ļŗżļźĖ ņČöņČ£ņĀ£ņÖĆ ļ╣äĻĄÉĒĢ┤ ĒīöļØ╝ļōÉ(II)ņØś ņČöņČ£ļźĀņØ┤ 40%ļĪ£ ļé«ņĢä ĒīöļØ╝ļōÉ(II)ņØä ņÖäņĀäĒ׳ ņČöņČ£ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö 3ļŗ© ņØ┤ņāüņØś ļŗżļŗ©ņČöņČ£ņØ┤ ĒĢäņÜöĒĢśļ»ĆļĪ£ ņČöĻ░Ć ņŗżĒŚśņØä ņłśĒ¢ēĒĢśņ¦Ć ņĢŖņĢśļŗż. Cyanex 301, Aliquat 336, LIX 63ņŚÉņä£ ņČöņČ£ņĀ£ ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņĢäņŚ░(II)ņØś ņČöņČ£ļźĀņØ┤ ņ”ØĻ░ĆĒĢśļ»ĆļĪ£ ņČöņČ£ņĀ£ ļåŹļÅäļź╝ ļé«Ļ▓ī ņ£Āņ¦ĆĒĢśļŖö Ļ▓āņØ┤ ļČäļ”¼ņŚÉ ņ£Āļ”¼ĒĢśļŗż. ļö░ļØ╝ņä£ Cyanex 301, Aliquat 336, LIX 63ņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØ┤ ņÖäņĀäĒ׳ ņČöņČ£ļÉśĻ│Ā ņĢäņŚ░(II)ņØĆ ņĀäĒśĆ ņČöņČ£ļÉśņ¦Ć ņĢŖļŖö 0.005 M ļåŹļÅäļź╝ ņĄ£ņĀüņĪ░Ļ▒┤ņ£╝ļĪ£ ĻĄ¼Ē¢łļŗż.
ļŗżņØīņ£╝ļĪ£ 0.1 MņØś LIX 84-IļŖö 5 M ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØä 70.5% ņČöņČ£Ē¢łņ£╝ļ»ĆļĪ£ ņČöņČ£ņĀ£ ļåŹļÅäļź╝ 1MĻ╣īņ¦Ć ņ”ØĻ░Ćņŗ£ņ╝░ļŗż. LIX 84-IņØś ļåŹļÅäĻ░Ć 0.01ņŚÉņä£ 0.3 MļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒīöļØ╝ļōÉ(II)ņØś ņČöņČ£ļźĀņØĆ 25.4ņŚÉņä£ 99.9%ļĪ£ ņ”ØĻ░ĆĒ¢łĻ│Ā, ņĢäņŚ░(II)ņØś ņČöņČ£ļźĀņØĆ 4.6%ņŚÉņä£ Ļ░ÉņåīĒĢśņŚ¼ ņĀäĒśĆ ņČöņČ£ļÉśņ¦Ć ņĢŖņĢśļŗż. 0.3 M ņČöņČ£ņĀ£ ļåŹļÅäņŚÉņä£ ņĢäņŚ░(II)ņØĆ ņĀäĒśĆ ņČöņČ£ļÉśņ¦Ć ņĢŖņĢśņ£╝ļ»ĆļĪ£ ļŗżņØī ņŗżĒŚśņØä ņ£äĒĢ£ ņĄ£ņĀüņĪ░Ļ▒┤ņ£╝ļĪ£ ņäĀĒāØļÉśņŚłļŗż.
3.3 ĒāłĻ▒░ņŗ£ ļ¼┤ĻĖ░ņé░ ļåŹļÅäņØś ņśüĒ¢ź
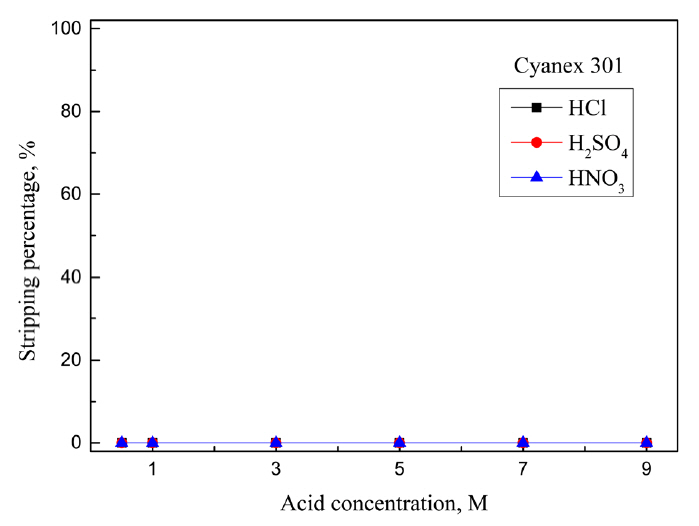
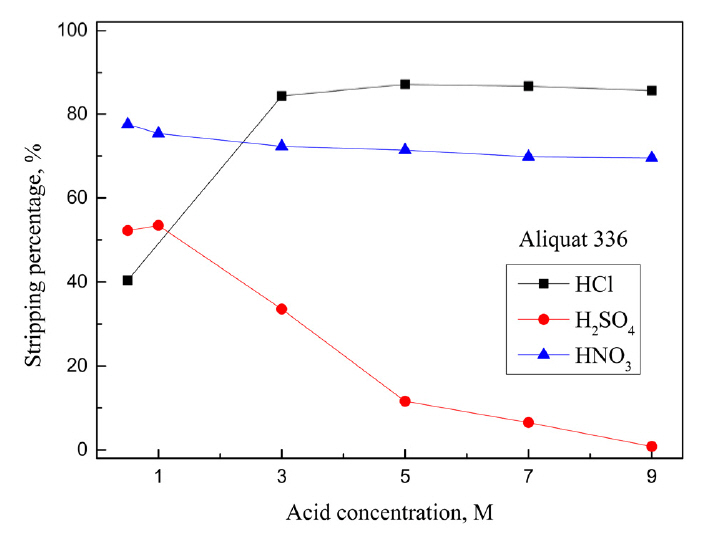
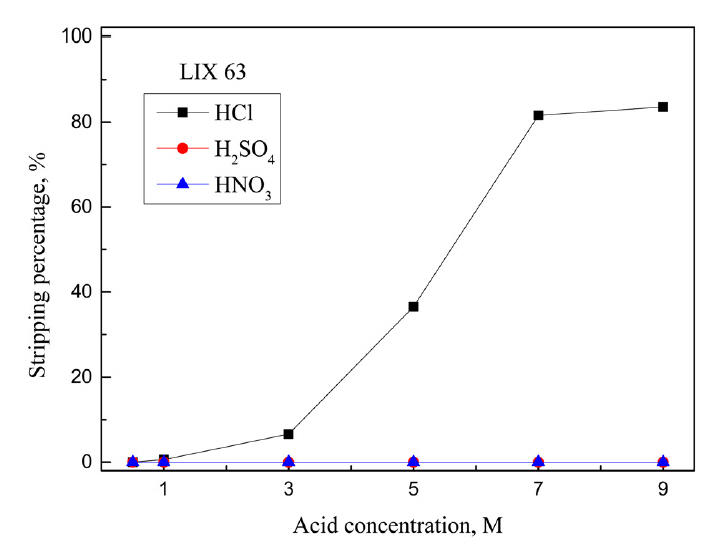
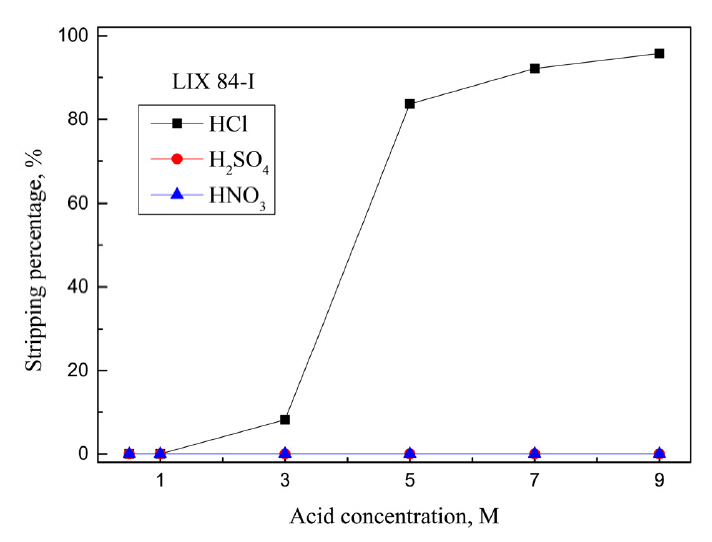
5 M ĒÖ®ņé░ņŚÉņä£ ņČöņČ£ ļ░Å ļČäļ”¼ņä▒ņØ┤ ļø░ņ¢┤ļé£ Cyanex 301, Aliquat 336, LIX 63, LIX 84-IņŚÉ ļīĆĒĢ┤ ļ¼┤ĻĖ░ņé░ņØĖ HCl, H2SO4, HNO3ņÜ®ņĢĪņØś ļåŹļÅäļź╝ ļ│ĆĒÖöņŗ£ņ╝£ ĒāłĻ▒░ņŗżĒŚśņØä ņłśĒ¢ēĒ¢łļŗż. ĒīöļØ╝ļōÉ(II)ņØ┤ ņČöņČ£ļÉ£ ņ£ĀĻĖ░ņāüņØĆ Ļ░üĻ░üņØś ņĄ£ņĀüņØś ņČöņČ£ņĀ£ ļåŹļÅäņŚÉņä£ ņżĆļ╣äĒ¢łņ£╝ļ®░, ĒāłĻ▒░ņĢĪņØś ņé░ ļåŹļÅäļŖö 0.5ņŚÉņä£ 9MĻ╣īņ¦Ć ļ│ĆĒÖöņŗ£ņ╝░Ļ│Ā, ņŗżĒŚśĻ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 5, 6, 7, 8ņŚÉ ļéśĒāĆļāłļŗż. ņĄ£ņĀü ņĪ░Ļ▒┤ņŚÉņä£ ņĢäņŚ░(II)ņØĆ ņČöņČ£ļÉśņ¦Ć ņĢŖņĢśņ£╝ļ»ĆļĪ£ ĻĘĖļ”╝ņŚÉ ņĢäņŚ░ņØś ĒāłĻ▒░ Ļ▓░Ļ│╝ļź╝ ļéśĒāĆļé┤ņ¦Ć ņĢŖņĢśļŗż. Cyanex 301ņŚÉ ņČöņČ£ļÉ£ ĒīöļØ╝ļōÉ(II)ņØĆ ņČöņČ£ņĀ£ņØś P=SņÖĆ Ļ░ĢļĀźĒĢ£ Ļ▓░ĒĢ®ņØä ĒśĢņä▒ĒĢśĻ│Ā ņ׳ļŖö ļ¦īĒü╝ ļ¼┤ĻĖ░ņé░ņŚÉņä£ ņĀäĒśĆ ĒāłĻ▒░ļÉśņ¦Ć ņĢŖņĢśļŗż.
ĒāłĻ▒░ņĢĪņŚÉņä£ ņŚ╝ņé░ļåŹļÅäĻ░Ć 0.5ņŚÉņä£ 3MļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ Aliquat 336ņŚÉ ņČöņČ£ļÉ£ ĒīöļØ╝ļōÉ(II)ņØś ĒāłĻ▒░ņ£©ņØ┤ 40.4ņŚÉņä£ 84.3%ļĪ£ ņ”ØĻ░ĆĒ¢łĻ│Ā, ņŚ╝ņé░ļåŹļÅä 3 M ņØ┤ņāüņŚÉņä£ļŖö ņé░ļåŹļÅäĻ░Ć ĒāłĻ▒░ņ£©ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖņĢśļŗż. ļ░śļ®┤ ĒÖ®ņé░ĒāłĻ▒░ņÜ®ņĢĪņŚÉņä£ļŖö ņé░ ļåŹļÅäĻ░Ć 0.5ņŚÉņä£ 9 MļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒāłĻ▒░ņ£©ņØ┤ 52.2ņŚÉņä£ 0.8%ļĪ£ ĻĖēĻ▓®Ē׳ Ļ░ÉņåīĒ¢łļŗż. ņ¦łņé░ņØś Ļ▓ĮņÜ░ ņé░ļåŹļÅäĻ░Ć ĒāłĻ▒░ņ£©ņŚÉ Ēü░ ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖņĢśņ£╝ļéś ņé░ļåŹļÅäĻ░Ć 0.5ņŚÉņä£ 9 MļĪ£ ņ”ØĻ░ĆĒĢśņ×É ĒāłĻ▒░ņ£©ņØ┤ 77.5ņŚÉņä£ 69.5%ļĪ£ ņĢĮĻ░ä Ļ░ÉņåīĒ¢łļŗż. ļö░ļØ╝ņä£ Aliquat 336ņŚÉ ņČöņČ£ļÉ£ ĒīöļØ╝ļōÉ(II)ņØä ĒāłĻ▒░ĒĢśļŖöļŹ░ 3 M ņØ┤ņāüņØś ņŚ╝ņé░ņÜ®ņĢĪņØ┤ Ļ░Ćņן ĒÜ©Ļ│╝ņĀüņØ┤ļŗż.
LIX 63Ļ│╝ LIX 84-IņŚÉņä£ļŖö ĒÖ®ņé░Ļ│╝ ņ¦łņé░ņŚÉ ĒīöļØ╝ļōÉ(II)ņØ┤ ņĀäĒśĆ ĒāłĻ▒░ļÉśņ¦Ć ņĢŖņĢśņ£╝ļ®░, ņŚ╝ņé░ ļåŹļÅäĻ░Ć 0.5ņŚÉņä£ 9 MļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒāłĻ▒░ņ£©ņØ┤ Ļ░üĻ░ü 83.6%ņÖĆ 95.7%ļĪ£ ņ”ØĻ░ĆĒĢśļŖö ņ£Āņé¼ĒĢ£ Ļ▒░ļÅÖņØä ļ│┤ņśĆļŗż. LIX 84-IĻ░Ć LIX 63ļ│┤ļŗż ņŚ╝ņé░ņŚÉ ņēĮĻ▓ī ĒāłĻ▒░ļÉśņŚłļŖöļŹ░, LIX 63ņØś Ļ▓ĮņÜ░ 7 M ņŚ╝ņé░ņŚÉņä£ 81%, LIX 84-IļŖö 5 M ņŚ╝ņé░ņŚÉņä£ 82% ĒāłĻ▒░ļÉśņŚłļŗż. Aliquat 336, LIX 63, LIX 84-IņŚÉ ņČöņČ£ļÉ£ ĒīöļØ╝ļōÉ(II)ņØĆ ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ ņŚ╝ĒÖöņ░®ļ¼╝ ĒśĢņä▒ņØä ĒåĄĒĢ┤ ĒāłĻ▒░Ļ░Ć Ļ░ĆļŖźĒĢ£ ļ░śļ®┤ [18], Cyanex 301ņØĆ ņŚ╝ņé░, ĒÖ®ņé░, ņ¦łņé░Ļ│╝ Ļ░ÖņØĆ ļŗ©ņØ╝ ļ¼┤ĻĖ░ņé░ ņÜ®ņĢĪņ£╝ļĪ£ ĒāłĻ▒░ĒĢśĻĖ░ ņ¢┤ļĀżņøĀļŗż. ļö░ļØ╝ņä£ ļŗżņ¢æĒĢ£ ĒāłĻ▒░ņĢĪņØä ņé¼ņÜ®ĒĢ┤ ņČöĻ░ĆņŗżĒŚśņØä ņłśĒ¢ēĒ¢łļŗż. NH3, NH4Cl, HClĻ│╝ thioureaņØś Ēś╝ĒĢ®ņÜ®ņĢĪ, NaOH, NaOHņÖĆ NaClņØś Ēś╝ĒĢ®ņÜ®ņĢĪ ļ░Å H2SO4ņÖĆ NaClOņØś Ēś╝ĒĢ®ņÜ®ņĢĪņØä ņĀ£ņĪ░ĒĢ┤ ĒāłĻ▒░ ņŗżĒŚśņØä ņłśĒ¢ēĒĢ£ Ļ▓░Ļ│╝ļź╝ Ēæ£ 1ņŚÉ ņĀĢļ”¼Ē¢łļŗż. 0.005 M Cyanex 301ņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØĆ 0.5 M ĒÖ®ņé░Ļ│╝ 1.5% NaClO Ēś╝ĒĢ®ņÜ®ņĢĪņ£╝ļĪ£ 40.4% ĒāłĻ▒░ļÉśņŚłņ£╝ļ®░, ļŗżļźĖ ĒāłĻ▒░ņĢĪņŚÉņä£ļŖö ņĀäĒśĆ ĒāłĻ▒░ļÉśņ¦Ć ņĢŖņĢśļŗż. Aliquat 336ņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØĆ ļŗżņ¢æĒĢ£ ĒāłĻ▒░ņĢĪņŚÉ ņØśĒĢ┤ ņØ╝ļČĆ ĒāłĻ▒░ļÉśņŚłĻ│Ā, 1 M NaOHņÖĆ 1 M NaCl Ēś╝ĒĢ®ņÜ®ņĢĪņ£╝ļĪ£ ņÖäņĀäĒ׳ ĒāłĻ▒░ĒĢĀ ņłś ņ׳ņŚłļŗż. LIX 63ņŚÉņä£ļŖö 0.5 M ņŚ╝ņé░Ļ│╝ 0.5 M thiourea Ēś╝ĒĢ®ņÜ®ņĢĪ, ĻĘĖļ”¼Ļ│Ā 0.5 M ĒÖ®ņé░Ļ│╝ 1.5% NaClOņØś Ēś╝ĒĢ®ņÜ®ņĢĪņØ┤ ĒīöļØ╝ļōÉ(II) ĒāłĻ▒░ņŚÉ ĒÜ©Ļ│╝Ļ░Ć ņ׳ņŚłņ£╝ļ®░, 0.5 M HClĻ│╝ 0.5 M thioureaņØś Ēś╝ĒĢ®ņÜ®ņĢĪņ£╝ļĪ£ 99.9% ņØ┤ņāü ĒāłĻ▒░Ļ░Ć Ļ░ĆļŖźĒ¢łļŗż. LIX 84-IņŚÉņä£ļŖö 1 M NH3, 1 M NaOHļ░Å 1 M NaOHņÖĆ 1 M NaClņØś Ēś╝ĒĢ®ņÜ®ņĢĪņ£╝ļĪ£ ļ»Ėļ¤ēņØś ĒīöļØ╝ļōÉ(II)ņØ┤ ĒāłĻ▒░ļÉśņŚłņ£╝ļéś, 0.5 M HClĻ│╝ 0.5 M thiourea Ēś╝ĒĢ®ņÜ®ņĢĪņØä ņé¼ņÜ®ĒĢ£ ņĪ░Ļ▒┤ņŚÉņä£ 23.6%ļĪ£ Ļ░Ćņן ļåÆņØĆ ĒāłĻ▒░ņ£©ņØä ņ¢╗ņŚłļŗż. LIX 84-IļŖö ļŗżļźĖ ņāüņÜ®ĒÖöņČöņČ£ņĀ£ņÖĆ ļ╣äĻĄÉĒĢ┤ ĒīöļØ╝ļōÉ(II)ņØä ņÖäņĀäĒ׳ ņČöņČ£ĒĢśĻĖ░ ņ£äĒĢ┤ ļåÆņØĆ ņČöņČ£ņĀ£ļåŹļÅäĻ░Ć ĒĢäņÜöĒĢĀ ļ┐Éļ¦ī ņĢäļŗłļØ╝ ĒāłĻ▒░Ļ░Ć ņ¢┤ļĀĄĻĖ░ ļĢīļ¼ĖņŚÉ ņČöĻ░ĆņŗżĒŚśņØä ņłśĒ¢ēĒĢśņ¦Ć ņĢŖņĢśļŗż. ĒĢ£ĒÄĖ Aliquat 336Ļ│╝ LIX 63ņŚÉ ņČöņČ£ļÉ£ ĒīöļØ╝ļōÉ(II)ņØĆ 1 M NaOHņÖĆ 1M NaClņØś Ēś╝ĒĢ®ņÜ®ņĢĪ ļ░Å 0.5 M HClĻ│╝ 0.5 M thioureaņØś Ēś╝ĒĢ®ņÜ®ņĢĪņ£╝ļĪ£ 99.9% ņØ┤ņāü ĒāłĻ▒░ĒĢĀ ņłś ņ׳ņŚłļŗż. ļśÉĒĢ£ Cyanex 301ņØĆ Aliquat 336 ļ░Å LIX63Ļ│╝ ļÅÖņØ╝ĒĢ£ ņČöņČ£ņĀ£ ļåŹļÅäņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØś ņäĀĒāØņĀü ņČöņČ£ņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ļ»ĆļĪ£ ĒāłĻ▒░ņĢĪņ£╝ļĪ£ Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŖö ĒÖ®ņé░Ļ│╝ NaClOņØś Ēś╝ĒĢ®ņÜ®ņĢĪņŚÉ ļīĆĒĢ£ ņČöĻ░ĆņŗżĒŚśņØä ņłśĒ¢ēĒ¢łļŗż.
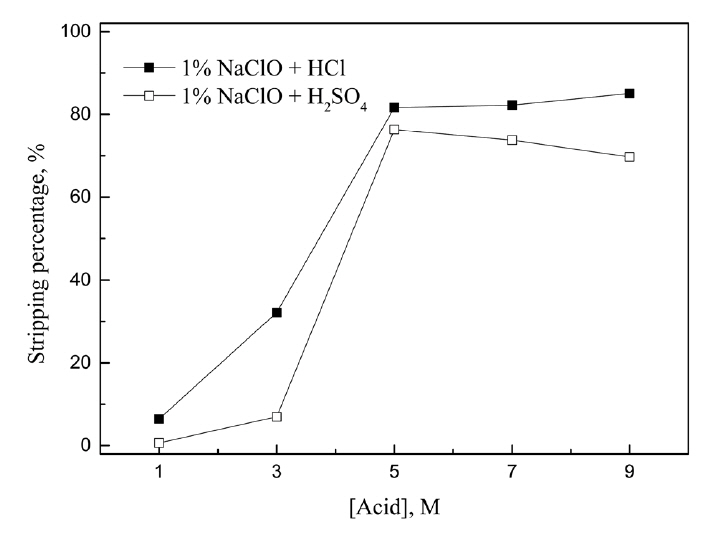
3.4 ĒāłĻ▒░ņŚÉ ļ»Ėņ╣śļŖö ļ¼┤ĻĖ░ņé░ ļ░Å ņé░ĒÖöņĀ£ Ēś╝ĒĢ®ļ¼╝ņØś ņśüĒ¢ź
0.1 g/L ĒīöļØ╝ļōÉ(II)ņØ┤ ņČöņČ£ļÉ£ 0.005 M Cyanex 301ņŚÉņä£ 0.5 M ĒÖ®ņé░Ļ│╝ 1.5% NaClOņØś Ēś╝ĒĢ®ņÜ®ņĢĪņ£╝ļĪ£ ĒāłĻ▒░ĒĢśļ®┤ 40.4% ĒīöļØ╝ļōÉ(II)ņØä ĒāłĻ▒░ĒĢĀ ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļéś ĒāłĻ▒░ņÜ®ņĢĪņŚÉņä£ ņŚ╝ņé░ ļ░Å ĒÖ®ņé░Ļ│╝ Ļ░ÖņØĆ ļ¼┤ĻĖ░ņé░ņØĆ ņāłļĪ£ņÜ┤ ĒāłĻ▒░Ļ│ĄņĀĢņŚÉ ņ×¼ņé¼ņÜ®ņØ┤ Ļ░ĆļŖźĒĢśņ¦Ćļ¦ī NaClOļŖö ļČäĒĢ┤ļÉśļ»ĆļĪ£ ĒāłĻ▒░Ļ│ĄņĀĢņŗ£ ņ▓©Ļ░ĆĒĢ┤ņĢ╝ ĒĢ£ļŗż. ļö░ļØ╝ņä£ NaClOņØś ļåŹļÅäļź╝ ļé«ņČ░ 1%ļĪ£ Ļ│ĀņĀĢĒĢśĻ│Ā ņé░ļåŹļÅäļź╝ 1ņŚÉņä£ 9MĻ╣īņ¦Ć ļ│ĆĒÖöņŗ£ņ╝░ņ£╝ļ®░, ņŗżĒŚśĻ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 9ņŚÉ ļéśĒāĆļāłļŗż. ņŚ╝ņé░Ļ│╝ ĒÖ®ņé░ņØś ļåŹļÅäĻ░Ć 1ņŚÉņä£ 5MļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒīöļØ╝ļōÉ(II)ņØś ĒāłĻ▒░ņ£©ņØĆ Ļ░üĻ░ü 6.4ņŚÉņä£ 81.6%ņÖĆ 0.6ņŚÉņä£ 76.3%ļĪ£ ņ”ØĻ░ĆĒ¢łļŗż. ļśÉĒĢ£ ņé░ļåŹļÅäĻ░Ć 5ņŚÉņä£ 9MļĪ£ ņ”ØĻ░ĆĒĢśļŖö Ļ▓ĮņÜ░ ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ļŖö ĒāłĻ▒░ņ£©ņØ┤ 85.0%ļĪ£ ņĢĮĻ░ä ņ”ØĻ░ĆĒĢ£ ļ░śļ®┤, ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ļŖö 69.6%ļĪ£ ņĢĮĻ░ä Ļ░ÉņåīĒ¢łļŗż. ņĀäļ░śņĀüņ£╝ļĪ£ ĒÖ®ņé░ļ│┤ļŗż ņŚ╝ņé░ņØś Ēś╝ĒĢ®ņÜ®ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØś ĒāłĻ▒░ņ£©ņØ┤ ļŹö ļåÆņĢśļŗż. ļö░ļØ╝ņä£ Ēś╝ĒĢ®ņÜ®ņĢĪņŚÉ ņŚ╝ņé░ņØä ņ▓©Ļ░ĆĒĢśļŖö Ļ▓āņØ┤ ĒāłĻ▒░ņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ļŗż. ņŗżĒŚśĻ▓░Ļ│╝ņŚÉ ļö░ļź┤ļ®┤ 5 M ņØ┤ņāüņŚÉņä£ļŖö ņé░ļåŹļÅäĻ░Ć ĒīöļØ╝ļōÉ(II)ņØś ĒāłĻ▒░ņ£©ņŚÉ Ēü░ ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖņĢśļŗż. ļö░ļØ╝ņä£ ņĄ£ņĀü ĒāłĻ▒░ņÜ®ņĢĪņØś ņĪ░Ļ▒┤ņØä 1% NaClOņÖĆ 5 M ņŚ╝ņé░ņÜ®ņĢĪņ£╝ļĪ£ ņäĀĒāØĒ¢łļŗż. ņØ┤ ņĪ░Ļ▒┤ņŚÉņä£ 2ļŗ©ņØś ļŗżļŗ©ņČöņČ£ņØä ņłśĒ¢ēĒĢśļ®┤ ĒīöļØ╝ļōÉ(II)ņØä ņÖäņĀäĒ׳ ĒāłĻ▒░ĒĢĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.
3.5 ņŗżņĀ£ ņ╣śĒÖśļÉ£ ĒīöļØ╝ļōÉ ĻĖłņåŹņØś ĒÖ®ņé░ņ╣©ņČ£ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II)Ļ│╝ ņĢäņŚ░(II)ņØś ļČäļ”¼
3.5.1 ņČöņČ£
ĒĢ®ņä▒ņÜ®ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II)Ļ│╝ ņĢäņŚ░(II)ņØś ļČäļ”¼ņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ņŚłļŹś Cyanex 301, Aliquat 336, LIX 63ņØä ņé¼ņÜ®ĒĢ┤ ņŗżņĀ£ ĒīöļØ╝ļōÉ ņ╣śĒÖśļ¼╝ņØś ĒÖ®ņé░ņ╣©ņČ£ņĢĪņŚÉņä£ ņÜ®ļ¦żņČöņČ£ ņŗżĒŚśņØä ņłśĒ¢ēĒ¢łĻ│Ā, Cyanex 301Ļ│╝ LIX 63ņØś ĒÖöĒĢÖņĀü ĻĄ¼ņĪ░ļź╝ ĻĘĖļ”╝ 10ņŚÉ ļéśĒāĆļāłļŗż. ĒÖ®ņé░ņ╣©ņČ£ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II)Ļ│╝ ņĢäņŚ░(II)ņØś ļåŹļÅäļŖö Ļ░üĻ░ü 1.926Ļ│╝ 0.074 g/LņśĆļŗż. ļö░ļØ╝ņä£ ņČöņČ£ņĀ£ ļåŹļÅäļź╝ 0.005ņŚÉņä£ 0.2 MĻ╣īņ¦Ć ļ│ĆĒÖöņŗ£ņ╝░Ļ│Ā, ņŗżĒŚśĻ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 11ņŚÉ ļéśĒāĆļāłļŗż. Cyanex 301Ļ│╝ LIX 63ņŚÉņä£ ņČöņČ£ņĀ£ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒīöļØ╝ļōÉ(II)ņØś ņČöņČ£ļźĀņØĆ ĻĖēĻ▓®Ē׳ ņ”ØĻ░ĆĒ¢łļŗż. Cyanex 301ņØĆ 0.2 MņŚÉņä£ LIX 63ņØĆ 0.1 MņŚÉņä£ 99.9% ņØ┤ņāü ĒīöļØ╝ļōÉ(II)ņØ┤ ņČöņČ£ļÉśņ¢┤ ņØ┤ļź╝ ņĄ£ņĀüņĪ░Ļ▒┤ņ£╝ļĪ£ ņäĀĒāØĒ¢łļŗż. ņĢäņŚ░(II)ņØĆ Cyanex 301ņŚÉņä£ ņČöņČ£ņĀ£ ļåŹļÅäņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ ņĀäĒśĆ ņČöņČ£ļÉśņ¦Ć ņĢŖņĢśĻ│Ā, LIX 63ņŚÉņä£ļŖö 0.1 M ļåŹļÅäĻ╣īņ¦Ć ņČöņČ£ļÉśņ¦Ć ņĢŖļŗżĻ░Ć 0.2 MļĪ£ ņČöņČ£ņĀ£ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņČöņČ£ļźĀņØ┤ ņ”ØĻ░ĆĒĢ┤ 7.4%Ļ░Ć ņČöņČ£ļÉśņŚłļŗż. ļö░ļØ╝ņä£ ĒīöļØ╝ļōÉ(II)ņØś ņČöņČ£ļźĀņØ┤ 99.9%ļĪ£ ļåÆĻ│Ā ņĢäņŚ░(II)ņØś ņČöņČ£ļźĀņØ┤ 5.4%ļĪ£ ļé«ņØĆ 0.1 M LIXļź╝ ņĄ£ņĀüņĪ░Ļ▒┤ņ£╝ļĪ£ ņäĀĒāØĒ¢łļŗż. ļ░śļ®┤ Aliquat 336ņŚÉņä£ļŖö ĒĢ®ņä▒ņÜ®ņĢĪĻ│╝ ļŗ¼ļ”¼ ļ¬©ļōĀ ņĪ░Ļ▒┤ņŚÉņä£ ĒīöļØ╝ļōÉ(II)Ļ│╝ ĒĢ©Ļ╗ś ņĢäņŚ░(II)ņØ┤ ļÅÖņŗ£ņŚÉ ņČöņČ£ļÉśļ»ĆļĪ£ ļæÉ ĻĖłņåŹņØś ļČäļ”¼Ļ░Ć ņ¢┤ļĀżņøĀļŗż. ņØ┤ļŖö ņŗżņĀ£ ņ╣©ņČ£ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØś ņ╣©ņČ£ņØä ņ£äĒĢ┤ ņ▓©Ļ░ĆĒĢ£ NaClOņØś ĒÖśņøÉ ņāØņä▒ļ¼╝ņØĖ ņŚ╝ņåīņØ┤ņś©ņØ┤ ņĢäņŚ░(II)Ļ│╝ ņ░®ļ¼╝ņØä ĒśĢņä▒ĒĢ┤ ņČöņČ£ļźĀņØ┤ ņ”ØĻ░ĆĒĢ£ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ļö░ļØ╝ņä£ Aliquat 336ņŚÉ ļīĆĒĢ£ ņČöĻ░Ć ņŗżĒŚśņØĆ ņłśĒ¢ēĒĢśņ¦Ć ņĢŖņĢśļŗż.
3.5.2 ĒāłĻ▒░
ĻĖłņåŹņØ┤ņś©ņØ┤ ņČöņČ£ļÉ£ Cyanex 301Ļ│╝ LIX 63ņŚÉ ļīĆĒĢ┤ ĒāłĻ▒░ ņŗżĒŚśņØä ņłśĒ¢ēĒ¢łļŗż. ņ£ĀĻĖ░ņāüņØĆ ņŗżņĀ£ ņ╣©ņČ£ņĢĪņŚÉņä£ Ļ░üĻ░üņØś ņĄ£ņĀü ņĪ░Ļ▒┤ņØĖ 0.2 M Cyanex 301Ļ│╝ 0.1 M LIX 63 ņČöņČ£ņĀ£ļĪ£ļČĆĒä░ ņżĆļ╣äĒ¢łļŗż. ļæÉ ņ£ĀĻĖ░ņāüņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØś ļåŹļÅäļŖö 1.926 g/LņśĆĻ│Ā, LIX 63ņŚÉņä£ ņĢäņŚ░(II)ņØĆ 0.004 g/LņśĆļŗż. ĒĢ®ņä▒ņÜ®ņĢĪņŚÉņä£ ļ¼┤ĻĖ░ņé░Ļ│╝ ņé░ĒÖöņĀ£ņØś Ēś╝ĒĢ®ņÜ®ņĢĪņØ┤ ĒāłĻ▒░ņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ņŚłņ£╝ļ»ĆļĪ£ 5 M ņŚ╝ņé░ņÜ®ņĢĪņŚÉ H2O2, NaClO, NaClO3ņÖĆ Ļ░ÖņØĆ ņé░ĒÖöņĀ£ļź╝ ņ▓©Ļ░ĆĒĢ┤ Cyanex 301Ļ│╝ LIX 63ņ£╝ļĪ£ļČĆĒä░ ĒīöļØ╝ļōÉ(II)Ļ│╝ ņĢäņŚ░(II)ņØś ĒāłĻ▒░ņ£©ņØä ņĪ░ņé¼ĒĢ£ Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 12ņŚÉ ļéśĒāĆļāłļŗż. ļ│Ė ņŗżĒŚśņĪ░Ļ▒┤ņŚÉņä£ ņĢäņŚ░(II)ņØĆ ņĀäĒśĆ ĒāłĻ▒░ļÉśņ¦Ć ņĢŖņĢśļŗż. ĒĢ®ņä▒ņÜ®ņĢĪĻ│╝ ļŗ¼ļ”¼ ņŗżņĀ£ ņ╣©ņČ£ņĢĪņŚÉņä£ ĻĖłņåŹņØä ņČöņČ£ĒĢ£ 0.2 M Cyanex 301ņŚÉņä£ 5 M HClĻ│╝ ņé░ĒÖöņĀ£ņØś Ēś╝ĒĢ®ļ¼╝ņŚÉ ņØśĒĢ£ ĒīöļØ╝ļōÉ(II)ņØś ĒāłĻ▒░ņ£©ņØĆ ļé«ņĢśļŗż. H2O2ņØś ļåŹļÅäĻ░Ć 0.1ņŚÉņä£ 3%ļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒāłĻ▒░ņ£©ņØ┤ 20.0ņŚÉņä£ 1.5%ļĪ£ Ļ░ÉņåīĒ¢łĻ│Ā, NaClOļŖö 2% ļåŹļÅäļź╝ ĻĖ░ņĀÉņ£╝ļĪ£ ĒāłĻ▒░ņ£©ņØ┤ 18.1ņŚÉņä£ 5.1%ļĪ£ Ļ░ÉņåīĒ¢łļŗżĻ░Ć 3%ņŚÉņä£ 28.5%ļĪ£ ļŗżņŗ£ ņ”ØĻ░ĆĒ¢łļŗż. NaClO3ņØś Ļ▓ĮņÜ░ ņé░ĒÖöņĀ£ ļåŹļÅäĻ░Ć ĒāłĻ▒░ņ£©ņŚÉ ņśüĒ¢źņØä ņŻ╝ņ¦Ć ņĢŖņĢśņ£╝ļ®░, ĒÅēĻĘĀņĀüņ£╝ļĪ£ ņĢĮ 17.5%ņØś ĒīöļØ╝ļōÉ(II)ņØ┤ ņ£ĀĻĖ░ņāüņ£╝ļĪ£ļČĆĒä░ ĒāłĻ▒░ļÉśņŚłļŗż. 0.2 M Cyanex 301ņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØś ĒāłĻ▒░ņ£©ņØ┤ ļé«ņØĆ Ļ▓āņØĆ ĒĢ®ņä▒ņÜ®ņĢĪļ│┤ļŗż 20ļ░░ Ļ░Ćļ¤ē ļåÆņØĆ ĒīöļØ╝ļōÉ(II) ļåŹļÅäņŚÉ ĻĖ░ņØĖĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉśļ®░, ņłśņāüņØś ļ╣äļź╝ 5ļ░░ ņØ┤ņāü ļåÆņŚ¼ņŻ╝ļ®┤ ĒīöļØ╝ļōÉ(II)ņØä ņÖäņĀäĒ׳ ĒāłĻ▒░ĒĢĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ĻĖ░ļīĆļÉ£ļŗż. ļ░śļ®┤ 0.1 M LIX 63ņØś Ļ▓ĮņÜ░ ĒĢ®ņä▒ņÜ®ņĢĪļ│┤ļŗż ļåÆņØĆ ĒīöļØ╝ļōÉ(II) ļåŹļÅäņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņé░ĒÖöņĀ£ ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒīöļØ╝ļōÉ(II)ņØś ĒāłĻ▒░ņ£©ņØ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņśĆļŗż. H2O2ņÖĆ NaClO3ļŖö ņé░ĒÖöņĀ£ ļåŹļÅäĻ░Ć 0.1ņŚÉņä£ 3%ļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ Ļ░üĻ░ü 6.2ņŚÉņä£ 36.0%ņÖĆ 4.4ņŚÉņä£ 33.5%ļĪ£ ĒāłĻ▒░ņ£©ņØ┤ ņ”ØĻ░ĆĒ¢łļŗż. 0.1 M LIX 63ņŚÉņä£ NaClOļŖö Ļ░Ćņן ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ĒīöļØ╝ļōÉ(II)ņØä ĒāłĻ▒░Ē¢łļŖöļŹ░, 5 M ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ ņé░ĒÖöņĀ£ ļåŹļÅäĻ░Ć 0.1ņŚÉņä£ 3%ļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒāłĻ▒░ņ£©ņØ┤ 7.3ņŚÉņä£ 87.1%ļĪ£ ņ”ØĻ░ĆĒ¢łļŗż. ļö░ļØ╝ņä£ 5 M HClĻ│╝ 3% NaClOļź╝ ņĄ£ņĀüņĪ░Ļ▒┤ņ£╝ļĪ£ ņäĀĒāØĒ¢łņ£╝ļ®░, 2ļŗ© ņØ┤ņāüņØś ĒāłĻ▒░ļéś A/O ļ╣äļź╝ 2 ņØ┤ņāüņ£╝ļĪ£ ļåÆņŚ¼ņŻ╝ļ®┤ ņÖäņĀäĒ׳ ĒāłĻ▒░ĒĢĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ ĒāłĻ▒░Ļ│╝ņĀĢņØä Ļ│ĀļĀżĒ¢łņØä ļĢī LIX 63ņØ┤ ņŗżņĀ£ ņ╣©ņČ£ņĢĪņŚÉņä£ Ļ│Āņł£ļÅäņØś ĒīöļØ╝ļōÉ(II)ņØä ĒÜīņłśĒĢśĻĖ░ ņ£äĒĢ£ ņČöņČ£ņĀ£ļĪ£ ņĀüĒĢ®ĒĢśļŗżĻ│Ā ĒīÉļŗ©ļÉ£ļŗż.
4. Ļ▓░ ļĪĀ
ļÅäĻĖłĒÅÉņĢĪņŚÉņä£ ņĢäņŚ░ĻĖłņåŹļČäļ¦ÉļĪ£ ĒÖśņøÉņŗ£Ēé© ĒīöļØ╝ļōÉ ĻĖłņåŹņØś ĒÖ®ņé░ ņ╣©ņČ£ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II)Ļ│╝ ņĢäņŚ░(II)ņØä ļČäļ”¼ĒĢśĻĖ░ ņ£äĒĢ┤ ļŗżņ¢æĒĢ£ ņāüņÜ®ĒÖö ņČöņČ£ņĀ£ļź╝ ņé¼ņÜ®ĒĢ┤ ņĪ░ņé¼Ē¢łļŗż. ĒīöļØ╝ļōÉ(II)Ļ│╝ ņĢäņŚ░(II)ņØś ļåŹļÅäĻ░Ć Ļ░üĻ░ü 0.1Ļ│╝ 0.5 g/LņØĖ ĒĢ®ņä▒ņÜ®ņĢĪņŚÉņä£ ĒÖ®ņé░ļåŹļÅäĻ░Ć 0.5ņŚÉņä£ 9 M ņé¼ņØ┤ņØś ļ▓öņ£äņØ╝ ļĢī Cyanex 301, LIX 63 ļ░Å Aliquat 336ņØ┤ ĒīöļØ╝ļōÉ(II)ņŚÉ ļīĆĒĢ£ ņäĀĒāØņä▒ņØ┤ ņÜ░ņłśĒ¢łļŗż. LIX 63Ļ│╝ Aliquat 336ņŚÉ ņČöņČ£ļÉ£ ĒīöļØ╝ļōÉ(II)ņØĆ ņŚ╝ņé░ļ¦īņ£╝ļĪ£ ĒāłĻ▒░Ļ░Ć Ļ░ĆļŖźĒ¢łņ£╝ļéś, Caynex 301ņØś Ļ▓ĮņÜ░ ļ¼┤ĻĖ░ņé░(ņŚ╝ņé░, ĒÖ®ņé░)Ļ│╝ 1% NaClOņØś Ēś╝ĒĢ®ņÜ®ņĢĪņ£╝ļĪ£ ĒīöļØ╝ļōÉ(II)ņØä ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ĒāłĻ▒░ĒĢĀ ņłś ņ׳ņŚłļŗż. 5 M ĒÖ®ņé░ ļåŹļÅäņØś ņŗżņĀ£ ņ╣©ņČ£ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II)Ļ│╝ ņĢäņŚ░(II)ņØś ļåŹļÅäļŖö Ļ░üĻ░ü 1.926Ļ│╝ 0.074 g/LņØ┤ņŚłņ£╝ļ®░, ĒĢ®ņä▒ņÜ®ņĢĪņŚÉņä£ ņ¢╗ņØĆ ņĄ£ņĀüņĪ░Ļ▒┤ņØä ņĀüņÜ®ĒĢ£ Ļ▓░Ļ│╝ 0.2 M Cyanex 301ņŚÉļŖö 99.9% ĒīöļØ╝ļōÉ(II)ļ¦īņØ┤ ņäĀĒāØņĀüņ£╝ļĪ£ ņČöņČ£ļÉśņŚłĻ│Ā, 0.1 M LIX 63ņŚÉļŖö 99.9% ĒīöļØ╝ļōÉ(II)Ļ│╝ 5.4% ņĢäņŚ░(II)ņØ┤ ņČöņČ£ļÉśņŚłļŗż. ĻĘĖļ¤¼ļéś Aliquat 336ņØś Ļ▓ĮņÜ░ ĒĢ®ņä▒ņÜ®ņĢĪĻ│╝ ļŗ¼ļ”¼ ĒīöļØ╝ļōÉ(II) ļ┐Éļ¦ī ņĢäļŗłļØ╝ ņĢäņŚ░(II)ņØś ņČöņČ£ļźĀļÅä ļåÆņĢśļŗż. 5 MņØś ņŚ╝ņé░Ļ│╝ 3% NaClOņØś Ēś╝ĒĢ®ņÜ®ņĢĪņØä ĒāłĻ▒░ņĢĪņ£╝ļĪ£ ņé¼ņÜ®ĒĢ£ Ļ▓ĮņÜ░ Cyanex 301ņŚÉ ļ╣äĒĢ┤ LIX 63ņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØś ĒāłĻ▒░Ļ░Ć ņÜ®ņØ┤Ē¢łļŗż. ļö░ļØ╝ņä£ ņŗżņĀ£ ņ╣©ņČ£ņĢĪņŚÉņä£ ņČöņČ£Ļ│╝ ĒāłĻ▒░ļĪ£ ņł£ņłśĒĢ£ ĒīöļØ╝ļōÉ(II)ņÜ®ņĢĪņØä ĒÜīņłśĒĢśĻĖ░ ņ£äĒĢ£ ņČöņČ£ņĀ£ļĪ£ LIX 63ņØ┤ Ļ░Ćņן ĒÜ©Ļ│╝ņĀüņØ┤ņŚłļŗż.