1. ņä£ ļĪĀ
ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤(Metal-Organic Framework, MOFs)ļŖö ĻĖłņåŹņØ┤ņś© ļśÉļŖö Ēü┤ļ¤¼ņŖżĒä░ņÖĆ ņ£ĀĻĖ░ ļ”¼Ļ░äļō£ļĪ£ ĻĄ¼ņä▒ļÉ£ 3ņ░©ņøÉ ĻĄ¼ņĪ░ņØś ļŗżĻ│Ąņ▓┤ņØ┤ļŗż [1,2]. ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ļŖö ļ╣äĒæ£ļ®┤ņĀüĻ│╝ ĻĖ░Ļ│Ą ļČĆĒö╝Ļ░Ć Ēü¼Ļ│Ā ņĀüņĀłĒĢ£ Ēü┤ļ¤¼ņŖżĒä░ņÖĆ ņ£ĀĻĖ░ ļ”¼Ļ░äļō£ņØś ļ│ĆĒśĢņØä ĒåĄĒĢ┤ ļ¦×ņČżĒśĢ ļČäņ×É ņäżĻ│äĻ░Ć Ļ░ĆļŖźĒĢ£ ņןņĀÉņØ┤ ņ׳ļŗż. Ēśäņ×¼ ĻĖ░ņ▓┤ņØś ĒØĪņ░® ļ░Å ļČäļ”¼, ņä╝ņä£, ņ┤ēļ¦ż, ņĢĮļ¼╝ ņĀäļŗ¼, ļéśļģĖļ¼╝ņ¦ł ĒĢ®ņä▒Ļ│╝ Ļ░ÖņØĆ ļŗżņ¢æĒĢ£ ļČäņĢ╝ņŚÉ ļīĆĒĢ£ ņØæņÜ® ņ×Āņ×¼ļĀźņ£╝ļĪ£ ņØĖĒĢ┤ Ļ┤ĆļĀ© ņŚ░ĻĄ¼Ļ░Ć ĒÖ£ļ░£Ē׳ ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā ņ׳ļŗż [3-10].
ļģĖļź┤ņø©ņØ┤ņØś LillerudĻĄÉņłśļŖö ņ¦Ćļź┤ņĮöļŖä(IV)Ļ│╝ 1,4-benzenedicaboxylic acidļź╝ ņé¼ņÜ®ĒĢ┤ ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ļź╝ ņĀ£ņĪ░ĒĢśĻ│Ā UIO-66(UIOļŖö University of OsloņØś ņĢĮņ¢┤)ļØ╝Ļ│Ā ļ¬ģļ¬ģĒ¢łļŗż [11]. ļ│Ė ļģ╝ļ¼ĖņŚÉņä£ ņé¼ņÜ®ĒĢ£ UIO-66-NH2ļŖö UIO-66ņØś ļ│ĆĒśĢņ£╝ļĪ£ 2-Aminoterephthalic acidļź╝ ņ£ĀĻĖ░ ļ”¼Ļ░äļō£ļĪ£ ņé¼ņÜ®ĒĢ┤ ņĀ£ņĪ░ Ļ░ĆļŖźĒĢśļŗż. UIO-66-NH2ļŖö ņ×ģļ░®ņĄ£ļ░ĆņČ®ņĀä ĻĄ¼ņĪ░ļĪ£ ļ│╝ ĒśĢĒā£ņØś Ļ▓░ņĀĢņØä Ļ░Ćņ¦Ćļ®░ ļé┤ļČĆņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ĻĖ░Ļ│ĄņØś ļ░śņ¦Ćļ”äņØĆ 9.5 ├ģņØ┤ļ®░ ļŗ©ņ£ä ņ¦łļ¤ēļŗ╣ 876 m2/gĻ│╝ 0.379 cm3/gņØś ļåÆņØĆ ļ╣äĒæ£ļ®┤ņĀüĻ│╝ ļ╣äņ▓┤ņĀüņØä Ļ░¢ļŖöļŗż [12]. ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ļź╝ ņłśņÜ®ņĢĪņŚÉņä£ ĻĖłņåŹ ĒØĪņ░® ļ¬®ņĀüņ£╝ļĪ£ ņé¼ņÜ®ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ņØś ĒÖöĒĢÖņĀü ņĢłņĀĢņä▒ņØ┤ ļ¦żņÜ░ ņżæņÜöĒĢśļŗż [13,7,14-16]. UIO-66-NH2ļŖö ļé┤ĒÖöĒĢÖņĀü ĒŖ╣ņä▒ņØ┤ ļø░ņ¢┤ļé£ ņ¦Ćļź┤ņĮöļŖä(IV)ņØä Ēü┤ļ¤¼ņŖżĒä░ļĪ£ ņé¼ņÜ®ĒĢ┤ ļŗżļźĖ ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ļ│┤ļŗż ņłśņÜ®ņĢĪņŚÉņä£ ĒÖöĒĢÖņĀü, ņŚ┤ņĀü ņĢłņĀäņä▒ņØ┤ Ēü¼ļŗż. ļ¼ĖĒŚīņŚÉ ļö░ļź┤ļ®┤ pHĻ░Ć 1ņĀĢļÅäņØś ņŚ╝ņé░ ņÜ®ņĢĪņŚÉņä£ļÅä UIO-66-NH2ļŖö ļ│ĆĒśĢļÉśņ¦Ć ņĢŖĻ│Ā ņĢłņĀĢĒĢśļŗż [17].
ĒīöļØ╝ļōÉņØĆ ņŚ░ļŻīņĀäņ¦ĆņÜ® ĒĢ®ĻĖł, ļČłņÜ®ņä▒ ņĀäĻĘ╣ņ×¼ļŻī, Ļ┤æņ┤ēļ¦żņ×¼ļŻī, Ļ░ĆņŖż ņä╝ņä£, ĻĖłņåŹ ņ£Āļ”¼ ņ×¼ļŻīļō▒ ļŗżņ¢æĒĢ£ ļČäņĢ╝ņŚÉ ņé¼ņÜ®ļÉ£ļŗż [18-21]. ļśÉĒĢ£ ĒīöļØ╝ļōÉņØĆ ļŗżļźĖ ņĀäņØ┤ĻĖłņåŹņŚÉ ļ╣äĒĢ┤ ņłśņåī ĒØĪņłśļŖźļĀźņØ┤ ļ¦żņÜ░ ņ╗żņä£ ņłśņåīņĀĆņןļ¼╝ņ¦łļĪ£ ņé¼ņÜ®ļÉśļ®░, Ē¢źĒøä ņłśņÜöĻ░Ć ņ”ØĻ░ĆĒĢĀ Ļ░ĆļŖźņä▒ņØ┤ ļåÆļŗż [21]. ĒīöļØ╝ļōÉņØä ņĢłņĀĢņĀüņ£╝ļĪ£ Ļ│ĄĻĖēĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö 2ņ░© ņ×ÉņøÉņ£╝ļĪ£ļČĆĒä░ ĒīöļØ╝ļōÉņØä ĒÜīņłśĒĢśĻĖ░ ņ£äĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż [19-25]. ĻĖ░ņĪ┤ ļ¼ĖĒŚīņŚÉ ļö░ļź┤ļ®┤ UIO-66-NH2ļĪ£ pH 1ņĀĢļÅäņØś ņŚ╝ņé░ ņÜ®ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉņØä ĒØĪņ░®ĒĢśļŖö Ļ▓āņØ┤ Ļ░ĆļŖźĒĢśļŗż [9]. ĻĘĖļ¤¼ļéś ļ░▒ĻĖłņĪ▒ ĻĖłņåŹņØ┤ ĒĢ©ņ£ĀļÉ£ 2ņ░© ņ×ÉņøÉ ņ╣©ņČ£ņĢĪņØś ņŚ╝ņé░ļåŹļÅäļŖö 1 M ņØ┤ņāüņØ┤ļŗż. ļö░ļØ╝ņä£ 1 M ņØ┤ņāüņØś ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ UIO-66-NH2ņŚÉ ņØśĒĢ£ ĒīöļØ╝ļōÉ(II)ņØś ĒØĪņ░® Ļ▒░ļÅÖņŚÉ ļīĆĒĢ£ ņ×ÉļŻī ĒÖĢļ│┤Ļ░Ć ĒĢäņÜöĒĢśļŗż. ļśÉĒĢ£ ņŗżņĀ£Ļ│ĄņĀĢņŚÉ ņĀüņÜ®ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņŚ╝ņé░ļåŹļÅäņŚÉ ļö░ļźĖ UIO-66-NH2ņØś ņĢłņĀĢņä▒Ļ│╝ ĒīöļØ╝ļōÉ(II)ņØś ĒØĪņ░®ņÜ®ļ¤ē ļ░Å ņåŹļÅäļĪĀņŚÉ ļīĆĒĢ£ ņ×ÉļŻīĻ░Ć ĒĢäņÜöĒĢśļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŚ╝ņé░ņłśņÜ®ņĢĪņŚÉņä£ UIO-66-NH2ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņŚ╝ņé░ ļ░Å ņŚ╝ņåīņØ┤ņś©ņØś ļåŹļÅäņŚÉ ļö░ļźĖ ĒīöļØ╝ļōÉ(II)ņØś ĒØĪņ░®Ļ▒░ļÅÖņØä ņĪ░ņé¼Ē¢łļŗż. ļ░śņØæņŗ£Ļ░äņŚÉ ļö░ļźĖ ĒØĪņ░®ļźĀņØś ļ│ĆĒÖöņŚÉ ļīĆĒĢ┤ 2ņ░© ļ░śņØæņåŹļÅä ļ¬©ļŹĖņØä ņĀüņÜ®ĒĢśņŚ¼ ņåŹļÅäļĪĀņĀü ņ×ÉļŻīļź╝ ĒÖĢļ│┤Ē¢łļŗż. ļśÉĒĢ£ UIO-66-NH2ņŚÉ ĒīöļØ╝ļōÉ(II) ĒØĪņ░®ņŚÉ ļīĆĒĢ┤ Langmuir ļō▒ņś©ĒØĪņ░® ĒÅēĒśĢņØä ņĀüņÜ®ĒĢ┤ņä£ ņĄ£ļīĆĒØĪņ░®ņÜ®ļ¤ēņØä ĻĄ¼Ē¢łļŗż. UIO-66-NH2ņØś ņĢłņĀĢņä▒ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖņ£╝ļ®┤ņä£ ĒØĪņ░®ļÉ£ ĒīöļØ╝ļōÉ(II)ņØä ņäĖņČ£ĒĢśļŖö ņĪ░Ļ▒┤ņØä ņĪ░ņé¼Ē¢łļŗż.
2. ņŗżĒŚś ņ×¼ļŻī ļ░Å ļ░®ļ▓Ģ
2.1 ņŗżĒŚś ņ×¼ļŻī ļ░Å ļ░®ļ▓Ģ
UIO-66-NH2ļź╝ ņĀ£ņĪ░ĒĢśĻĖ░ ņ£äĒĢ┤ ZrCl4(99.5%, Sigma-Aldrich), N,NŌĆÖ-Dimethylformamide (99.8%, Sigama-Aldrich), BDC-NH2(99%, Sigama-Aldrich), ņŚÉĒŗĖ ņĢīņĮöņś¼(95%, Daejung Chemical & Metals Co., Ltd)ņØä ņé¼ņÜ®Ē¢łļŗż. PdCl2(99.9%, Sigma-Aldrich)ļź╝ 2ņ░© ņ”ØļźśņłśņŚÉ ņÜ®ĒĢ┤ņŗ£ņ╝£ ĒīöļØ╝ļōÉ(II) ņÜ®ņĢĪņØä ņĀ£ņĪ░Ē¢łļŗż. ņŚ╝ņé░(35%, Daejung Chemical & Metals Co., Ltd)ņØä ņ▓©Ļ░ĆĒĢśņŚ¼ ĒīöļØ╝ļōÉņÜ®ņĢĪņØś ņé░ļÅäļź╝ ņĪ░ņĀłĒĢśņśĆĻ│Ā, ņŚ╝ĒÖöļéśĒŖĖļź©(99%, Daejung Chemical & Metals Co., Ltd)ņØä ņ▓©Ļ░ĆĒĢśņŚ¼ ĒīöļØ╝ļōÉņÜ®ņĢĪņØś ņŚ╝ņåīņØ┤ņś©ļåŹļÅäļź╝ ļ│ĆĒÖöņŗ£ņ╝░ļŗż.
ĒÜīļČäņŗØ ĒØĪņ░® ņŗżĒŚśņŚÉņä£ 50 mL Ļ┤æĻĄ¼ļ│æņØä ņé¼ņÜ®Ē¢łĻ│Ā ņŗżĒŚśņÜ®ņĢĪņØĆ 10 mLļĪ£ Ļ│ĀņĀĢĒ¢łļŗż. ļ░śņØæ ņś©ļÅä, ĻĄÉļ░ś ņåŹļÅäņÖĆ ĻĄÉļ░śņŗ£Ļ░äņØä ņĪ░ņĀłĒĢśĻĖ░ ņ£äĒĢ┤ ĻĄÉļ░śĻĖ░(HB-201SF, Hanbaek Scientific Co.)ļź╝ ņé¼ņÜ®Ē¢łļŗż. ļ¬©ļōĀ ņŗżĒŚśņŚÉņä£ ĻĄÉļ░ś ņåŹļÅäņÖĆ ĻĄÉļ░śņś©ļÅäļŖö 200 rpmņÖĆ 25 ┬░CļĪ£ Ļ│ĀņĀĢĒ¢łļŗż. ĒØĪņ░®ļÉ£ UIO-66-NH2ļŖö ņŚ¼Ļ│╝ņ¦Ć(Advantec No.2: 110 mm, pore size : 5 um)ļź╝ ņé¼ņÜ®ĒĢ┤ ņÜ®ņĢĪĻ│╝ ļČäļ”¼Ē¢łļŗż.
ņäĖņČ£ ņŗżĒŚśņŚÉ ņé¼ņÜ®ĒĢ£ ĒīöļØ╝ļōÉ(II)ņØ┤ ĒØĪņ░®ļÉ£ UIO-66-NH2ļŖö ņŚ╝ņé░ ļåŹļÅä 0.2 MņØĖ 100 mg/LņØś ĒīöļØ╝ļōÉ(II) ņÜ®ņĢĪņØä 1 g/LņØś UIO-66-NH2ļĪ£ ĒØĪņ░®ĒĢ┤ņä£ ņżĆļ╣äĒ¢łļŗż. ņäĖņČ£ ņŗżĒŚśņŗ£ ņÜ®ņĢĪņØś ļČĆĒö╝ņÖĆ ņŗ£Ļ░äņØä Ļ░üĻ░ü 10 mLņÖĆ 2ņŗ£Ļ░äņ£╝ļĪ£ Ļ│ĀņĀĢĒ¢łļŗż. ĒīöļØ╝ļōÉ(II)ņØ┤ ĒØĪņ░®ļÉ£ UIO-66-NH2ļź╝ ņŚ¼Ļ│╝ņ¦ĆļĪ£ ļČäļ”¼ĒĢ£ ļŗżņØī UIO-66-NH2ļź╝ 60 oCņŚÉņä£ 12ņŗ£Ļ░ä Ļ▒┤ņĪ░ņŗ£ņ╝£ ņäĖņČ£ ņŗżĒŚśņŚÉ ņé¼ņÜ®Ē¢łļŗż.
2.2 UIO-66-NH2ņØś ĒĢ®ņä▒
ņ¦Ćļź┤ņĮöļŖä(IV)Ļ│ä ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ņØĖ UIO-66-NH2ļŖö ļ¼ĖĒŚīņŚÉ ļ░£Ēæ£ļÉ£ ļ░®ļ▓ĢņŚÉ ļö░ļØ╝ ņĀ£ņĪ░Ē¢łļŗż [9,17]. ZrCl4(125 mg, 0.54 mmol), N,NŌĆÖ ŌĆō Dimethylformamide (DMF, 15 ml), ņŚ╝ņé░ (1.00 ml) ĻĘĖļ”¼Ļ│Ā BDC-NH2 (134 mg, 0.75 mmol)ņØä ļ╣äņ╗żņŚÉ ļäŻĻ│Ā ņ┤łņØīĒīī ļ░£ņāØ ņןņ╣śņŚÉņä£ 40ļČä ļÅÖņĢł ņ▓śļ”¼ĒĢ┤ ņÖäņĀäĒ׳ ņÜ®ĒĢ┤ņŗ£ņ╝░ļŗż. ņāüĻĖ░ ņĪ░Ļ▒┤ņŚÉņä£ ņĀ£ņĪ░ļÉ£ ņÜ®ņĢĪņØä 120 ┬░CņŚÉņä£ 24ņŗ£Ļ░ä ļÅÖņĢł ņśżļĖÉņŚÉņä£ Ļ▒┤ņĪ░ņŗ£ņ╝░ļŗż. ņāØņä▒ļÉ£ UIO-66-NH2ļź╝ ņŚ¼Ļ│╝ņ¦ĆļĪ£ ņŚ¼Ļ│╝ĒĢśĻ│Ā N,NŌĆÖŌĆōDimethylformamide (DMF)ņÖĆ ņŚÉĒāäņś¼ļĪ£ ņäĖņ▓ÖĒ¢łļŗż. ņäĖņ▓Ö Ēøä UIO-66-NH2ļź╝ ņśżļĖÉņØä ņé¼ņÜ®ĒĢśņŚ¼ 60 ┬░CņŚÉņä£ 12ņŗ£Ļ░ä Ļ▒┤ņĪ░ Ēøä ĒīöļØ╝ļōÉ(II) ĒØĪņ░® ņŗżĒŚśņŚÉ ņé¼ņÜ®Ē¢łļŗż.
ņłśņÜ®ņĢĪņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ĒīöļØ╝ļōÉ(II) ļåŹļÅäļŖö ICP-OES(Inductive Coupled Plasma Optical Emission Spectrometer, Spectro arcos FHE 16 model)ļĪ£ ņĖĪņĀĢĒ¢łļŗż.
3. Ļ▓░Ļ│╝ ļ░Å Ļ│Āņ░░
3.1 ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ UIO-66-NH2ņØś ĒīöļØ╝ļōÉ(II) ĒØĪņ░®
ļ¼ĖĒŚīņŚÉ ļö░ļź┤ļ®┤ 0.1 M ņØ┤ņāüņØś ņŚ╝ņé░ ņÜ®ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØĆ ļīĆļČĆļČä PdCl42-ļĪ£ ņĪ┤ņ×¼ĒĢ£ļŗż [18,19]. ļ│Ė ņŗżĒŚśņŚÉņä£ ņé¼ņÜ®ĒĢ£ ņ¦Ćļź┤ņĮöļŖä(IV)Ļ│ä ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ļŖö UIO-66-NH2ļĪ£ ņłśņÜ®ņĢĪņŚÉņä£ ņāüļīĆņĀüņ£╝ļĪ£ ļŗżļźĖ ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ļ│┤ļŗż Ļ░ĢĒĢ£ ņĢłņĀĢņä▒ņØä ļ│┤ņØĖļŗż [11,17]. UIO-66-NH2ļŖö [Zr6O4(OH)4]12+ ĒśĢĒā£ņØś ņ¦Ćļź┤ņĮöļŖä(IV) Ēü┤ļ¤¼ņŖżĒä░ņÖĆ 12Ļ░£ņØś BDC-NH2ņØś Ļ▓░ĒĢ®ņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦ä ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ņØ┤ļŗż. ņØ┤ļ¤¼ĒĢ£ ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ņŚÉ ņØ┤ņś©ņØ┤ ĒØĪņ░®ļÉśļŖö Ļ▓āņØĆ ļģĖļō£ņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ņĢäļ»╝ĻĖ░(-NH2)ļĪ£ ņØĖĒĢ£ ĒØĪņ░®Ļ│╝ ņ¦Ćļź┤ņĮöļŖä Ēü┤ļ¤¼ņŖżĒä░ņÖĆ Ēü┤ļ¤¼ņŖżĒä░ ņé¼ņØ┤ņŚÉ ņĪ┤ņ×¼ĒĢśļŖö Ļ▓░ĒĢ©ņ£╝ļĪ£ ņØĖĒĢ£ ĒØĪņ░®ņ£╝ļĪ£ ļīĆļ│äļÉ£ļŗż [6,9]. UIO-66-NH2ņŚÉņä£ BDC-NH2ņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ņĢäļ»╝ņØĆ ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ ņé░-ņŚ╝ĻĖ░ ļ░śņØæņŚÉ ņØśĒĢ┤ ņ¢æņä▒ņ×ÉĻ░Ć ņ▓©Ļ░ĆļÉśņ¢┤ BDCŌĆōNH3+ļĪ£ ņĀäĒÖśļÉ£ļŗż. ņØ┤ņÖĆ Ļ░ÖņØ┤ ĒśĢņä▒ļÉ£ BDCŌĆōNH3+ļŖö ņĀĢņĀäĻĖ░ņĀü ņØĖļĀźņ£╝ļĪ£ ņłśņÜ®ņĢĪņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ņØīņØ┤ņś© PdCl42-ļź╝ ĒØĪņ░®ĒĢ£ļŗż [9]. ĒĢ£ĒÄĖ Ēü┤ļ¤¼ņŖżĒä░ņÖĆ Ēü┤ļ¤¼ņŖżĒä░ ņé¼ņØ┤ņŚÉ ļģĖļō£Ļ░Ć ņĪ┤ņ×¼ĒĢśņ¦Ć ņĢŖļŖö Ļ▓░ĒĢ© ņé¼ņØ┤ĒŖĖņŚÉļŖö ZrŌĆōOH ļśÉļŖö ZrŌĆōOH2Ļ░Ć ņĪ┤ņ×¼ĒĢĀ ņłś ņ׳ļŗż. BDC-NH2ņØś ņ¢æņä▒ņ×É ņ▓©Ļ░Ćļ░śņØæņØä ņŗØ (1)ņŚÉ ļéśĒāĆļāłļŗż. ļśÉĒĢ£ BDCŌĆōNH3+ņÖĆ Zr-OHņŚÉ ņØśĒĢ£ PdCl42- ĒØĪņ░® ļ░śņØæņØä Ļ░üĻ░ü ņŗØ (2)ņÖĆ (3)ņŚÉ ļéśĒāĆļāłļŗż [9].
ņŗØ (1)-(3)ņØä ļ│┤ļ®┤ BDCŌĆōNH3+ļéś Zr-OHņŚÉ ņØśĒĢ┤ ĒīöļØ╝ļōÉ(II)ņØ┤ ĒØĪņ░®ļÉśļĀżļ®┤ ņłśņåīņØ┤ņś©ņØ┤ ĒĢäņÜöĒĢ£ Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ļö░ļØ╝ņä£ UIO-66-NH2ņŚÉ ņØśĒĢ£ ĒīöļØ╝ļōÉ(II)ņØś ĒØĪņ░®ļ░śņØæņŚÉņä£ ņŚ╝ņé░ļåŹļÅäļŖö Ēü░ ņśüĒ¢źņØä ļ»Ėņ╣£ļŗżĻ│Ā ņāØĻ░üĒĢĀ ņłś ņ׳ļŗż. ņé░ļÅäĻ░Ć Ļ░ĢĒĢ£ ņÜ®ņĢĪņŚÉņä£ļŖö (1)-(3)ļ░śņØæņŚÉ ņØśĒĢ£ ĒØĪņ░®ļ░śņØæņØ┤ ĒÖ£ļ░£Ē׳ ņØ╝ņ¢┤ļéĀ Ļ▓āņ£╝ļĪ£ ņśłņāüļÉ£ļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ņŚÉņä£ Ļ▓░ĒĢ© ļåŹļÅäļŖö ļåÆņ¦Ć ņĢŖĻ│Ā, UIO-66-NH2ņØś ĒīöļØ╝ļōÉ(II) ĒØĪņ░®ļ¤ēņØ┤ UIO-66ļ│┤ļŗż ļ¦żņÜ░ ļåÆļŗż [4]. ļö░ļØ╝ņä£ BDCŌĆōNH2ņŚÉ ņ¢æņä▒ņ×É ņ▓©Ļ░Ćļ░śņØæņØ┤ ņØ╝ņ¢┤ļé£ ļŗżņØī ĒīöļØ╝ļōÉ(II) ņØīņØ┤ņś©ņØä ņĀĢņĀäĻĖ░ņĀü ņØĖļĀźņ£╝ļĪ£ ĒØĪņ░®ĒĢśļŖö ļ░śņØæ (2)Ļ░Ć ņŻ╝ļĪ£ ņØ╝ņ¢┤ļé£ļŗżĻ│Ā ņāØĻ░üļÉ£ļŗż.
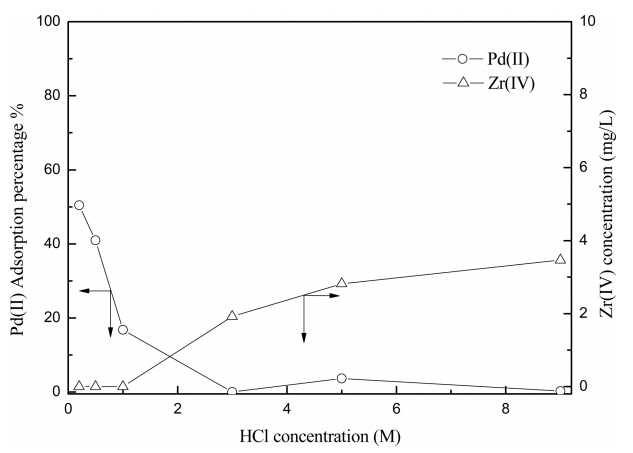
ņŚ╝ņé░ ļåŹļÅäĻ░Ć UIO-66-NH2ņØś ĒīöļØ╝ļōÉ(II) ĒØĪņ░®ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņĪ░ņé¼ĒĢśĻĖ░ ņ£äĒĢ┤ ņŚ╝ņé░ ļåŹļÅäļź╝ 0.2 MņŚÉņä£ 9 MĻ╣īņ¦Ć ļ│ĆĒÖöņŗ£ņ╝£ ņŗżĒŚśĒĢ£ Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 1ņŚÉ ļéśĒāĆļāłļŗż. ļ│Ė ņŗżĒŚśņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØś ļåŹļÅäļŖö 100 mg/LļĪ£ Ļ│ĀņĀĢņŗ£ņ╝░Ļ│Ā, UIO-66-NH2ņØś ļåŹļÅäļŖö 0.5 g/LļĪ£ ņĪ░ņĀłĒ¢łļŗż. ņŚ╝ņé░ļåŹļÅä 0.2 MņŚÉņä£ 1 M ņé¼ņØ┤ņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØĆ UIO-66-NH2ņŚÉ ĒØĪņ░®ļÉśņŚłĻ│Ā, ņŚ╝ņé░ļåŹļÅä 3M ņØ┤ņāüņØś ņÜ®ņĢĪņŚÉņä£ļŖö ĒīöļØ╝ļōÉ(II)ņØ┤ ļ»Ėļ¤ē ĒØĪņ░®ļÉśņŚłļŗż. ļśÉĒĢ£ 3 M ņØ┤ņāüņØś ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ ĒØĪņ░® ņŗżĒŚśņŗ£ UIO-66-NH2Ļ░Ć ļČłņĢłņĀĢĒĢ┤ņ¦Ćļ®┤ņä£ ņØ╝ļČĆ ņ¦Ćļź┤ņĮöļŖä(IV)ņØ┤ ĒīöļØ╝ļōÉ(II)ņÜ®ņĢĪņ£╝ļĪ£ ņÜ®ņČ£ļÉśņ¢┤ ņÜ®ņĢĪļé┤ ņ¦Ćļź┤ņĮöļŖä(IV) ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒ¢łļŗż. UIO-66-NH2Ļ░Ć ņØīņØ┤ņś©ņØś ĒØĪņ░®ņĀ£ļĪ£ ņ×æņÜ®ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņłśņåīņØ┤ņś©ņØ┤ ĒĢäņÜöĒĢ£ļŹ░ļÅä ļČłĻĄ¼ĒĢśĻ│Ā ļ│Ė ņŗżĒŚśĻ▓░Ļ│╝ņŚÉ ņØśĒĢśļ®┤ ņŚ╝ņé░ļåŹļÅäĻ░Ć 0.2 MņŚÉņä£ 1 MļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒīöļØ╝ļōÉ(II)ņØś ĒØĪņ░®ļźĀņØĆ Ļ░ÉņåīĒ¢łļŗż. ņŚ╝ņé░ ļåŹļÅä ņ”ØĻ░ĆņŚÉ ļö░ļØ╝ ĒØĪņ░®ļźĀņØ┤ Ļ░ÉņåīĒĢśļŖö ņØ┤ņ£ĀļŖö ņŚ╝ņåī ņØ┤ņś© ļåŹļÅäņØś ņ”ØĻ░ĆņŚÉ ļö░ļźĖ ņśüĒ¢źņ£╝ļĪ£ ņāØĻ░üļÉśļ®░, 3.2ņĀłņŚÉņä£ ņØ┤ņØś ņśüĒ¢źņØä Ļ│Āņ░░Ē¢łļŗż.
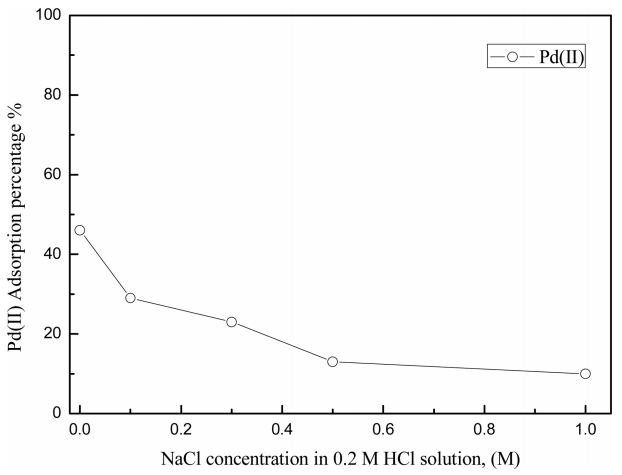
3.2 ņŚ╝ņåīņØ┤ņś© ļåŹļÅäĻ░Ć UIO-66-NH2ņØś ĒīöļØ╝ļōÉ(II) ĒØĪņ░®ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢ź
ļ│Ė ņŚ░ĻĄ¼ņØś ņŚ╝ņé░ļåŹļÅä ņŗżĒŚśļ▓öņ£äņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØĆ PdCl42- ļŗ©ņØ╝ ĒÖöĒĢÖņóģņ£╝ļĪ£ ņĪ┤ņ×¼ĒĢ£ļŗż. ĻĘĖļ¤¼ļéś ņŚ╝ņé░ ļåŹļÅä 0.2 MņŚÉņä£ 1.0 M ļåŹļÅä ļ▓öņ£äņŚÉņä£ ņŚ╝ņé░ ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ UIO-66-NH2ļĪ£ņØś ĒīöļØ╝ļōÉ(II) ĒØĪņ░®ļźĀņØ┤ Ļ░ÉņåīĒĢśņśĆļŗż. ļö░ļØ╝ņä£ ņŚ╝ņåīņØ┤ņś©ļåŹļÅäĻ░Ć ĒīöļØ╝ļōÉ(II)ņØś ĒØĪņ░®ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņĪ░ņé¼ĒĢśĻĖ░ ņ£äĒĢ┤ 0.2 M ņŚ╝ņé░ ņÜ®ņĢĪņŚÉ ņŚ╝ĒÖöļéśĒŖĖļź©ļź╝ ņ▓©Ļ░ĆĒĢ┤ ĒØĪņ░®ņŗżĒŚśņØä ņłśĒ¢ēĒĢ£ Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 2ņŚÉ ļéśĒāĆļāłļŗż. ļ░śņØæņŗØ (2) ņÖĆ (3)ņØä ļ│┤ļ®┤ ĒīöļØ╝ļōÉ(II)ņØś ĒØĪņ░®ļ░śņØæņŚÉ ņŚ╝ņåīņØ┤ņś©ņØĆ ļ¼┤Ļ┤ĆĒĢśņ¦Ćļ¦ī, ņŗżĒŚśĻ▓░Ļ│╝ ņŚ╝ņåīņØ┤ņś©ņØś ļåŹļÅäĻ░Ć 1 MļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒīöļØ╝ļōÉ(II)ņØś ĒØĪņ░®ļźĀņØ┤ Ļ░ÉņåīĒ¢łļŗż. PdCl42-ņÖĆ ņŚ╝ņåīņØ┤ņś©ņØś ņ£ĀĒÜ© ļ░śņ¦Ćļ”äņØĆ Ļ░üĻ░ü 5.5 ├ģ, 1.81 ├ģļĪ£ PdCl42-Ļ░Ć ļŹö Ēü¼ļ»ĆļĪ£ ņĀäĒĢśļ░ĆļÅä(charge density)ļŖö ņŚ╝ņåīņØ┤ņś©Ļ│╝ ļ╣äņŖĘĒĢśļŗż [26,9]. ĻĘĖļ¤¼ļéś PdCl42-Ļ░Ć ņŚ╝ņåīņØ┤ņś©ņŚÉ ļ╣äĒĢ┤ ļČĆĒö╝Ļ░Ć Ēü¼ļ»ĆļĪ£ UIO-66-NH2ņŚÉ ĒØĪņ░®ņŗ£ ņ×ģņ▓┤ņØĖņ×É(Steric factor)Ļ░Ć ņ”ØĻ░ĆĒĢśļ»ĆļĪ£ ĒīöļØ╝ļōÉ(II)ļ│┤ļŗżļŖö ņŚ╝ņåīņØ┤ņś©ņØ┤ ņĀĢņĀäĻĖ░ņĀü ņØĖļĀźņŚÉ ņØśĒĢ┤ ĒØĪņ░®ļÉĀ Ļ░ĆļŖźņä▒ņØ┤ Ēü¼ļŗż. ļśÉĒĢ£ ĒīöļØ╝ļōÉ(II)ņŚÉ ļ╣äĒĢ┤ ņŚ╝ņåīņØ┤ņś©ņØś ļåŹļÅäĻ░Ć Ļ│╝ņ×ēņØĖ ņĪ░Ļ▒┤ņŚÉņä£ļŖö ņ¦łļ¤ēņ×æņÜ®ņØś ļ▓Ģņ╣ÖņŚÉ ļö░ļØ╝ ņŚ╝ņåīņØ┤ņś©ņØ┤ ĒØĪņ░®ļÉ£ļŗż. ļ│Ė ņŗżĒŚśĻ▓░Ļ│╝ļĪ£ļČĆĒä░ UIO-66-NH2ļĪ£ ĒīöļØ╝ļōÉ(II) ĒØĪņ░®ņŗ£ ņŚ╝ņé░Ļ│╝ ņŚ╝ņåīņØ┤ņś©ņØś ļåŹļÅäĻ░Ć ļ¦żņÜ░ ņżæņÜöĒĢ©ņØä ņĢī ņłś ņ׳ļŗż.
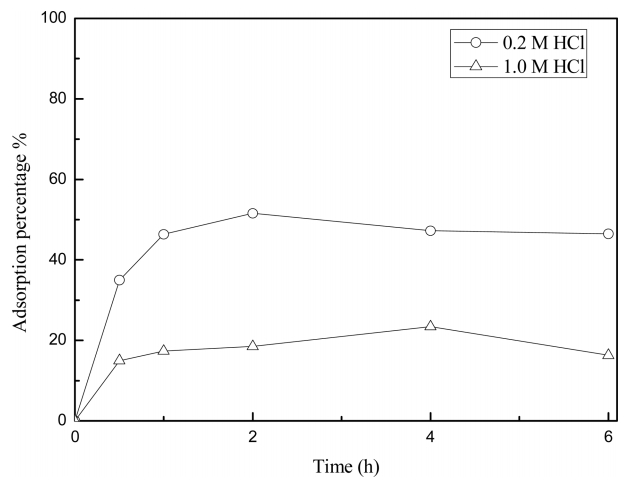
3.3 ņŚ╝ņé░ ņÜ®ņĢĪņŚÉņä£ UIO-66-NH2ņŚÉņØś ĒīöļØ╝ļōÉ(II) ĒØĪņ░®ņåŹļÅä
ņŚ╝ņé░ ļåŹļÅäĻ░Ć ĒīöļØ╝ļōÉ(II) ĒØĪņ░® ņåŹļÅäņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņĪ░ņé¼ĒĢśĻĖ░ ņ£äĒĢ┤ ņŚ╝ņé░ļåŹļÅä 0.2 MĻ│╝ 1.0 M ņÜ®ņĢĪņŚÉņä£ ļ░śņØæņåŹļÅäņŗżĒŚśņØä ņłśĒ¢ēĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ ļ¬®ņĀüņØä ņ£äĒĢ┤ ĒīöļØ╝ļōÉ(II)ņØś ļåŹļÅäĻ░Ć 100 mg/LņØĖ ņÜ®ņĢĪņØä ļīĆņāüņ£╝ļĪ£ UIO-66-NH2ņØś ļåŹļÅäņÖĆ ņŗżĒŚśņÜ®ņĢĪņØś ļČĆĒö╝ļź╝ Ļ░üĻ░ü 0.5 g/LņÖĆ 10 mLļĪ£ ņĪ░ņĀłĒĢśņŚ¼ ļ░śņØæņŗ£Ļ░äņØä 30ļČäņŚÉņä£ 6ņŗ£Ļ░äĻ╣īņ¦Ć ļ│ĆĒÖöņŗ£ņ╝░ļŗż. ĻĘĖļ”╝ 3ņŚÉ ņØśĒĢśļ®┤ UIO-66-NH2ļŖö ļæÉ ņŚ╝ņé░ļåŹļÅä ņÜ®ņĢĪņŚÉņä£ 2ņŗ£Ļ░ä ļ¦īņŚÉ ĒØĪņ░® ĒÅēĒśĢņŚÉ ļÅäļŗ¼Ē¢łļŗż. ĒīöļØ╝ļōÉ(II)ņØś UIO-66-NH2 ĒØĪņ░® ļ░śņØæņåŹļÅäņŚÉ ļīĆĒĢ£ ņĀĢļ¤ēņĀü ņĀĢļ│┤ļź╝ ņ¢╗ĻĖ░ ņ£äĒĢ┤ Ļ│Āņ▓┤ņāüņØś ĒØĪņ░® ĒÅēĒśĢļŖźļĀźņØä ĻĖ░ļ░śņ£╝ļĪ£ ņ£ĀļÅäļÉ£ 2ņ░© ļ░śņØæņåŹļÅä ļ¬©ļŹĖ(pseudo-second-order kinetic model)ņØä ņé¼ņÜ®ĒĢ┤ ļČäņäØĒ¢łļŗż [27,28]. ņŗØ (4)ļŖö 2ņ░© ļ░śņØæņåŹļÅä ļ¬©ļŹĖņØä ļéśĒāĆļéĖļŗż [27].
ņāüĻĖ░ ņŗØņŚÉņä£ tļŖö ļ░śņØæņŗ£Ļ░ä(min), qtļŖö ļŗ©ņ£ä ņ¦łļ¤ēļŗ╣ ļ░śņØæņŗ£Ļ░ä tņŚÉņä£ ĒØĪņ░®ļÉ£ ĒīöļØ╝ļōÉ(II) ņØ┤ņś©ņØś ĒØĪņ░® ņÜ®ļ¤ē(mg/g), qeļŖö ļŗ©ņ£ä ņ¦łļ¤ēļŗ╣ ĒÅēĒśĢņāüĒā£ņŚÉņä£ ĒØĪņ░®ļÉ£ ĒīöļØ╝ļōÉ(II) ņØ┤ņś©ņØś ĒØĪņ░® ņÜ®ļ¤ē(mg/g), kļŖö 2ņ░© ļ░śņØæņåŹļÅä ņāüņłś(g/mg/min)ļź╝ ļéśĒāĆļéĖļŗż [27,28]. ņāüĻĖ░ 2ņ░© ļ░śņØæņåŹļÅä ļ¬©ļŹĖņØä ļ│Ė ņŚ░ĻĄ¼ņØś ĒØĪņ░®ņŗżĒŚśņ×ÉļŻīņŚÉ ņĀüņÜ®ĒĢśļ®┤ kņÖĆ qeļź╝ ĻĄ¼ĒĢĀ ņłś ņ׳Ļ│Ā ņØ┤ Ļ░Æņ£╝ļĪ£ļČĆĒä░ ņŗØ (5)ņØä ņé¼ņÜ®ĒĢśņŚ¼ ņ┤łĻĖ░ ĒØĪņ░®ņåŹļÅä(h, mg/g/min)ļź╝ ĻĄ¼ĒĢĀ ņłś ņ׳ļŗż [28].
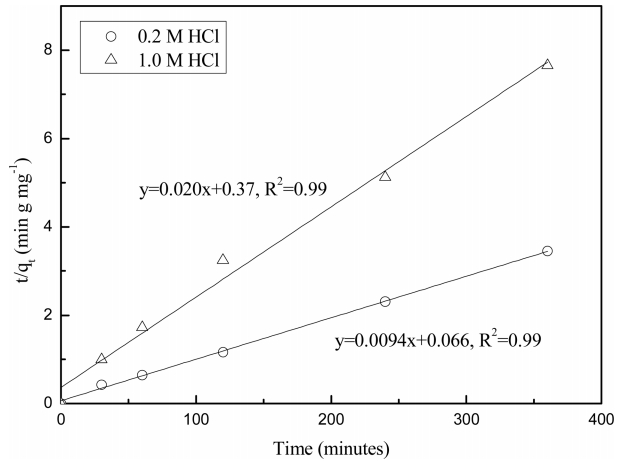
2ņ░© ļ░śņØæņåŹļÅä ļ¬©ļŹĖņØä ļ│Ė ļģ╝ļ¼ĖņØś ņŗżĒŚśĻ▓░Ļ│╝ņŚÉ ņĀüņÜ®ĒĢ£ Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 4ņÖĆ Ēæ£ 1ņŚÉ ļéśĒāĆļāłļŗż. ļ│Ė ņŗżĒŚśņĪ░Ļ▒┤ņŚÉņä£ ņŚ╝ņé░ ņÜ®ņĢĪņŚÉņä£ UIO-66-NH2ņØś ĒīöļØ╝ļōÉ(II) ĒØĪņ░®ņØĆ 2ņ░© ļ░śņØæ ņåŹļÅäņŗØĻ│╝ ņל ņØ╝ņ╣śĒĢśņśĆļŗż. ļśÉĒĢ£ 2ņ░© ļ░śņØæņåŹļÅä ļ¬©ļŹĖņØä ĒåĄĒĢ┤ ĻĄ¼ĒĢ£ kņÖĆ qeļŖö ņŚ╝ņé░ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ Ļ░ÉņåīĒ¢łļŗż. ņ┤łĻĖ░ ĒØĪņ░®ņåŹļÅä(h)ļŖö ņŚ╝ņé░ ļåŹļÅäņÖĆ ļ░śļ╣äļĪĆĒĢśņŚ¼ ņŚ╝ņé░ ļåŹļÅäĻ░Ć ļé«ņØäņłśļĪØ ļåÆņØĆ ņ┤łĻĖ░ ĒØĪņ░®ņåŹļÅäļź╝ ļ│┤ņśĆļŗż. ļö░ļØ╝ņä£ ļ│Ė ņŗżĒŚś Ļ▓░Ļ│╝ņŚÉ ļö░ļź┤ļ®┤ UIO-66-NH2ņŚÉ ņØśĒĢ£ ĒīöļØ╝ļōÉ(II)ņØś ĒØĪņ░®ņŚÉņä£ ņŚ╝ņé░ļåŹļÅäļŖö ĒØĪņ░®ņåŹļÅäņÖĆ ĒØĪņ░®ņÜ®ļ¤ēņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļ®░ ņŚ╝ņé░ļåŹļÅäĻ░Ć ļé«ņØäņłśļĪØ ĒØĪņ░®ņÜ®ļ¤ēņØĆ ņ”ØĻ░ĆĒĢśņśĆļŗż. ņŗØ (5)ļĪ£ ĻĄ¼ĒĢ£ UIO-66-NH2ņØś ĒīöļØ╝ļōÉ(II) ņ┤łĻĖ░ ĒØĪņ░®ņåŹļÅäļŖö UIO-66-NH2ņØś ļŗ©ņ£ä ņ¦łļ¤ēļŗ╣ ļåÆņØĆ ļ╣äĒæ£ļ®┤ņĀüĻ│╝ ļ╣äņ▓┤ņĀüņ£╝ļĪ£ ņØĖĒĢ┤ ļ¦żņÜ░ ļ╣Āļź┤ļŗż [27,28]. FickņØś ĒÖĢņé░ ļ▓Ģņ╣ÖņŚÉ ļö░ļź┤ļ®┤ ļ¬░ļČäņ£©ņØ┤ Ļ░ÉņåīĒĢśļ®┤ PdCl42-ņØś ņ£ĀņåŹņØ┤ Ļ░ÉņåīĒĢśņŚ¼ UIO-66-NH2ņÖĆ Ļ│äļ®┤ņŚÉ ļÅäļŗ¼ĒĢĀ ņłś ņ׳ļŖö PdCl42-ņØś ņ£ĀĒÜ©ļåŹļÅäĻ░Ć Ļ░ÉņåīĒĢ£ļŗż. ļö░ļØ╝ņä£ ņŚ╝ņé░ ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢśļ®┤ ņ┤łĻĖ░ ĒØĪņ░®ņåŹļÅäļŖö Ļ░ÉņåīĒĢśĻ▓ī ļÉ£ļŗż.
3.4 ņŚ╝ņé░ ņÜ®ņĢĪņŚÉņä£ UIO-66-NH2 ļåŹļÅäņŚÉ ļö░ļźĖ ĒØĪņ░®ļźĀ ļ│ĆĒÖö ļ░Å ļō▒ņś©ĒØĪņ░®Ļ│ĪņäĀ
UIO-66-NH2ņØś ļåŹļÅäĻ░Ć ĒīöļØ╝ļōÉ(II) ĒØĪņ░®ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņĪ░ņé¼ĒĢśĻĖ░ ņ£äĒĢ┤ 0.2 MĻ│╝ 1.0 M ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ UIO-66-NH2ņØś ļåŹļÅäļź╝ 0.2 g/LņŚÉņä£ 4 g/LĻ╣īņ¦Ć ļ│ĆĒÖöņŗ£ņ╝░ļŗż. ĻĘĖļ”╝ 5ņŚÉ ļö░ļź┤ļ®┤ 0.2 M ņŚ╝ņé░ ņÜ®ņĢĪņØś Ļ▓ĮņÜ░ UIO-66-NH2ņØś ļåŹļÅäĻ░Ć 2 g/LņØĖ ņĪ░Ļ▒┤ņŚÉņä£ ĒīöļØ╝ļōÉ 100 mg/LĻ░Ć ļīĆļČĆļČä ĒØĪņ░®ļÉśņŚłļŗż. ĻĘĖļ¤¼ļéś 1.0 M ņŚ╝ņé░ ņÜ®ņĢĪņØś Ļ▓ĮņÜ░ UIO-66-NH2ņØś ļåŹļÅä 4 g/L ņĪ░Ļ▒┤ņŚÉņä£ 90% ņĀĢļÅä ĒīöļØ╝ļōÉ(II)ņØ┤ ĒØĪņ░®ļÉ£ļŗż.
ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ UIO-66-NH2ļĪ£ ĒīöļØ╝ļōÉ( I I ) ĒØĪņ░®ņØĆ Langmuirļō▒ņś©ĒØĪņ░®ņØä ļö░ļź┤ļ®░ ņŗżĒŚśņ×ÉļŻīļĪ£ļČĆĒä░ ļŗżņØīņØś ņ¦üņäĀ Ļ┤ĆĻ│äļź╝ ņ¢╗ņØä ņłś ņ׳ļŗż [29,30].
ņāüĻĖ░ ņŗØņŚÉņä£ qeļŖö ļŗ©ņ£ä ņ¦łļ¤ēļŗ╣ ĒÅēĒśĢņāüĒā£ņŚÉņä£ņØś ĒīöļØ╝ļōÉ(II) ņØ┤ņś©ņØś ĻĄÉĒÖś ņÜ®ļ¤ē(mg/g), qmņØĆ ļŗ©ņ£ä ņ¦łļ¤ēļŗ╣ ĒÅēĒśĢņāüĒā£ņŚÉņä£ ĒīöļØ╝ļōÉ(II) ņØ┤ņś©ņØś ņĄ£ļīĆ ĻĄÉĒÖś ņÜ®ļ¤ē(mg/g), CeļŖö ĒØĪņ░® ņŗżĒŚś Ēøä ņÜ®ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II) ņØ┤ņś© ļåŹļÅä(mg/L), KļŖö Langmuir ņāüņłśņØ┤ļŗż(L/mg). ņŗżĒŚśņŚÉņä£ ņ¢╗ņØĆ ņ×ÉļŻīļź╝ ņāüĻĖ░ Langmuir ļō▒ ņś©ĒØĪņ░®ņŗØņ£╝ļĪ£ ļÅäĒĢ┤ĒĢ£ Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 6ņŚÉ ļéśĒāĆļāłļŗż. ļ│Ė ņŗżĒŚś ņ×ÉļŻīļŖö ņ¦üņäĀņĀüņØĖ Ļ┤ĆĻ│äļź╝ ļéśĒāĆļāłĻ│Ā ņØ┤ļĪ£ļČĆĒä░ ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II)ļŖö UIO-66-NH2ņŚÉ Langmuir ļō▒ņś©ĒØĪņ░®ņŚÉ ņØśĒĢ┤ ĒØĪņ░®ļÉ£ļŗżĻ│Ā ņāØĻ░üĒĢĀ ņłś ņ׳ļŗż. Langmuir ļō▒ņś©ĒØĪņ░® Ļ│ĪņäĀņ£╝ļĪ£ļČĆĒä░ ņ¢╗ņØĆ Langmuir ņāüņłśņÖĆ ņĄ£ļīĆ ĻĄÉĒÖś ņÜ®ļ¤ēņØä Ēæ£ 1ņŚÉ ļéśĒāĆļāłļŗż. ņŚ╝ņé░ļåŹļÅä 0.2 MĻ│╝ 1 MņŚÉņä£ UIO-66-NH2ņØś ĒīöļØ╝ļōÉ(II) ņĄ£ļīĆ ĒØĪņ░®ņÜ®ļ¤ēņØĆ Ļ░üĻ░ü 106.5ņÖĆ 40.6 mg/gņ£╝ļĪ£ ņØ┤ņś©ĻĄÉĒÖśņłśņ¦ĆņŚÉ ļ╣äĒĢ┤ ļ¦żņÜ░ ļåÆļŗż. ļśÉĒĢ£ ņŚ╝ņé░ļåŹļÅäĻ░Ć ļåÆņØĆ ņĪ░Ļ▒┤ņŚÉņä£ ĒØĪņ░®ņÜ®ļ¤ēņØ┤ Ļ░ÉņåīĒĢśņśĆļŗż.
3.5 ņäĖņČ£
ĒīöļØ╝ļōÉ(II)ņØä ĒØĪņ░®ĒĢ£ UIO-66-NH2ļĪ£ļČĆĒä░ ĒīöļØ╝ļōÉ(II) ĒÜīņłśļź╝ ņ£äĒĢ┤ ņäĖņČ£ ņŗżĒŚśņØä ņ¦äĒ¢ēĒ¢łļŗż. UIO-66-NH2ļĪ£ļČĆĒä░ ĒīöļØ╝ļōÉ(II)ņØä ņäĖņČ£ ņŗ£ UIO-66-NH2ļź╝ ĻĄ¼ņä▒ĒĢśļŖö ĒīöļØ╝ļōÉ(II)ņØś ņäĖņČ£Ļ│╝ ĒĢ©Ļ╗ś ņ¦Ćļź┤ņĮöļŖä(IV)ņØ┤ ļČäĒĢ┤ļÉśņ¦Ć ņĢŖļŖö ņĪ░Ļ▒┤ņØä ņ░ŠļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśļŗż. ļ│Ė ņŗżĒŚśņŚÉņä£ļŖö Ēŗ░ņśżņÜöņåī(thiourea, CH4N2S), Ēŗ░ņśżņŗ£ņĢłņé░ ņĢöļ¬©ļŖä(ammonium thiocyanate, NH4SCN), Ēāäņé░ļéśĒŖĖļź©(sodium carbonate, Na2CO3)ņØä ņé¼ņÜ®ĒĢśņŚ¼ ņäĖņČ£ņŗżĒŚśņØä ņłśĒ¢ēĒ¢łņ£╝ļ®░ Ļ▓░Ļ│╝ļź╝ Ēæ£ 2ņŚÉ ļéśĒāĆļāłļŗż. Ēāäņé░ļéśĒŖĖļź©ņØä ņäĖņČ£ņĀ£ļĪ£ ņé¼ņÜ®ņŗ£ ĒīöļØ╝ļōÉ(II)ņØä ļ¬©ļæÉ ņäĖņČ£ĒĢĀ ņłś ņ׳ņ¦Ćļ¦ī ņ¦Ćļź┤ņĮöļŖä(IV)ņØ┤ ļČäĒĢ┤ļÉśņ¢┤ ņłśņÜ®ņĢĪņŚÉņä£ 120 mg/LņØ┤ Ļ▓ĆņČ£ļÉśņŚłļŗż. Ēŗ░ņśżņÜöņåīļź╝ ņäĖņČ£ņĀ£ļĪ£ ņé¼ņÜ®ĒĢśļŖö Ļ▓ĮņÜ░ Ēŗ░ņśżņŗ£ņĢłņé░ ņĢöļ¬©ļŖäņŚÉ ļ╣äĒĢ┤ ĒīöļØ╝ļōÉ(II) ņäĖņČ£ļźĀņØĆ ļåÆņ£╝ļéś 0.5MņØś Ēŗ░ņśżņÜöņåīņŚÉņä£ 4 mg/LņØś ņ¦Ćļź┤ņĮöļŖä(IV)ņØ┤ Ļ▓ĆņČ£ļÉśņŚłļŗż. Ēŗ░ņśżņŗ£ņĢłņé░ ņĢöļ¬©ļŖäņØä ņäĖņČ£ņĀ£ļĪ£ ņé¼ņÜ®ņŗ£ ļåŹļÅäĻ░Ć 0.2 MņŚÉņä£ 0.5 MļĪ£ ņ”ØĻ░ĆĒĢśļ®┤ ĒīöļØ╝ļōÉ(II)ņØś ņäĖņČ£ļźĀņØ┤ 60ņŚÉņä£ 80%ļĪ£ ņ”ØĻ░ĆĒĢśļéś ņ¦Ćļź┤ņĮöļŖä(IV)ņØ┤ ļČäĒĢ┤ļÉśņ¦Ć ņĢŖņĢśļŗż. ļö░ļØ╝ņä£ ļ│Ė ļģ╝ļ¼ĖņŚÉņä£ ņé¼ņÜ®ĒĢ£ ņäĖņČ£ņĀ£ņżæņŚÉņä£ Ēŗ░ņśżņŗ£ņĢłņé░ ņĢöļ¬©ļŖäņØ┤ UIO-66-NH2ļĪ£ļČĆĒä░ ĒīöļØ╝ļōÉ(II)ņØś ņäĖņČ£ņĀ£ļĪ£ ņĀüĒĢ®ĒĢśļŗż. HSAB(Hard and Soft Acids and Bases)ņøÉļ”¼ņŚÉ ļö░ļź┤ļ®┤ ĒīöļØ╝ļōÉ(II)ņØĆ ļ¼┤ļźĖ ņé░ņ£╝ļĪ£ ņä╝ ņŚ╝ĻĖ░ņØĖ ņŚ╝ņåīņØ┤ņś©ļ│┤ļŗż ļ¼┤ļźĖ ņŚ╝ĻĖ░ņØĖ SCN-ņÖĆ ņ░®ļ¼╝ņØä ĒśĢņä▒ĒĢśļĀżļŖö Ļ▓ĮĒ¢źņØ┤ Ļ░ĢĒĢśļŗż [18]. ļö░ļØ╝ņä£ UIO-66-NH2ņŚÉ ĒØĪņ░®ļÉ£ ĒīöļØ╝ļōÉ(II)ņØĆ Ēŗ░ņśżņŗ£ņĢłņé░ ņĢöļ¬©ļŖäņÜ®ņĢĪļé┤ņŚÉ ņĪ┤ņ×¼ĒĢśļŖö SCN-ņŚÉ ņØśĒĢ┤ Pd(SCN)42-ĒśĢĒā£ļĪ£ ņäĖņČ£ļÉ£ļŗż.
3.6 ĒīöļØ╝ļōÉ(II)ĒÜīņłśļź╝ ņ£äĒĢ£ ņØ┤ņś©ĻĄÉĒÖś ļ░Å ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ Ļ│ĄņĀĢ ļ╣äĻĄÉ
ņØ┤ņś©ĻĄÉĒÖś Ļ│ĄņĀĢņØĆ ņ£ĀĻĖ░ļ¼╝ ĒśĢĒā£ņØś ņØ┤ņś©ĻĄÉĒÖś ņłśņ¦Ćļź╝ ņØ┤ņÜ®ĒĢ┤ ņÜ®ņĢĪļé┤ņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ļ¬®ņĀüĻĖłņåŹņØä ĒÜīņłśĒĢśĻĖ░ ņ£äĒĢ┤ ņāüņŚģņĀüņ£╝ļĪ£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż. ņØ┤ņś© ĻĄÉĒÖśņłśņ¦Ćļź╝ ņé¼ņÜ®ĒĢ┤ ņŚ╝ņé░ņÜ®ņĢĪņ£╝ļĪ£ļČĆĒä░ ĒīöļØ╝ļōÉ(II)ņØä ļČäļ”¼, ĒÜīņłśĒĢśĻĖ░ ņ£äĒĢ£ ļ¦ÄņØĆ ņŚ░ĻĄ¼ļōżņØ┤ ņäĀĒ¢ēļÉśņŚłļŗż. ĒīöļØ╝ļōÉ(II)ņØĆ ņŚ╝ņé░ ņÜ®ņĢĪņŚÉņä£ AG 1-X8, AG MP-1, Amberlite IRA-900, Purolite A-400TLņÖĆ Ļ░ÖņØĆ ņØīņØ┤ņś©ĻĄÉĒÖś ņłśņ¦Ćļź╝ ņé¼ņÜ®ĒĢ┤ ĒØĪņ░®ĒĢĀ ņłś ņ׳ļŗż [31-33]. ņāüĻĖ░ ņØīņØ┤ņś©ĻĄÉĒÖśņłśņ¦ĆļŖö ĒÖöĒĢÖņĀü ņĢłņĀäņä▒ņØ┤ ļåÆĻ│Ā, 1 M ņØ┤ņāüņØś ņ¦äĒĢ£ ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ļÅä ĒīöļØ╝ļōÉ(II)ņØä ĒØĪņ░®ĒĢĀ ņłś ņ׳ļŗż.
ļ│Ė ņŗżĒŚś Ļ▓░Ļ│╝ņŚÉ ļö░ļź┤ļ®┤ ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ņØĖ UIO-66-NH2ņØś ĒīöļØ╝ļōÉ(II) ĒØĪņ░® Ļ▒░ļÅÖņØĆ ņØ┤ņś©ĻĄÉĒÖś ņłśņ¦ĆņÖĆ ņ£Āņé¼ĒĢśļŗż. Amberlite IRA-900ņØś Ļ▓ĮņÜ░ ĒīöļØ╝ļōÉ(II) ĒØĪņ░®ĒÅēĒśĢņŚÉ ļÅäļŗ¼ ĒĢśļŖöļŹ░ 24ņŗ£Ļ░äņØ┤ ņåīņÜöļÉ£ļŗż [31]. ĒĢśņ¦Ćļ¦ī ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ļŖö ļåÆņØĆ ļ╣äĒæ£ļ®┤ņĀüņ£╝ļĪ£ ņØĖĒĢ┤ 2ņŗ£Ļ░äņØ┤ļé┤ņŚÉ ļ░śņØæĒÅēĒśĢņŚÉ ļÅäļŗ¼ĒĢśņśĆļŗż. ĻĖłņåŹ- ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ņØĖ UIO-66-NH2ļŖö TGA ļČäņäØĻ▓░Ļ│╝ņŚÉ ņØśĒĢśļ®┤ 300 oCņŚÉņä£ļÅä ņĢłņĀĢĒĢśļŗż [17]. ļö░ļØ╝ņä£ Ļ│Āņś©Ļ│ĀņĢĢņĪ░Ļ▒┤ņŚÉņä£ ĻĖłņåŹņØ┤ņś©ņØś ļČäļ”¼ļ¬®ņĀüņ£╝ļĪ£ ņé¼ņÜ®ĒĢśļŖö Ļ▓āņØ┤ Ļ░ĆļŖźĒĢśļŗż. ņØ┤ņÖĆ Ļ░ÖņØ┤ ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ļŖö ĻĖ░ņĪ┤ņØś ņØ┤ņś©ĻĄÉĒÖśņłśņ¦ĆņŚÉ ļ╣äĒĢ┤ Ļ│Āņś©Ļ│ĀņĢĢ ņĪ░Ļ▒┤ņŚÉ ņĀüņÜ®ņØ┤ Ļ░ĆļŖźĒĢśļ®░ ļ╣äĻĄÉņĀü ļ╣©ļ”¼ ļ░śņØæĒÅēĒśĢņŚÉ ļÅäļŗ¼ĒĢśļŖö ņןņĀÉņØ┤ ņ׳ļŗż.
4. Ļ▓░ ļĪĀ
ņŚ╝ņé░ ņÜ®ņĢĪņŚÉņä£ UIO-66-NH2ņŚÉ ņØśĒĢ£ ĒīöļØ╝ļōÉ(II)ņØś ĒØĪņ░®Ļ▒░ļÅÖņØä ņĪ░ņé¼ĒĢśņśĆļŗż. UIO-66-NH2ļŖö 1.0 M ņØ┤ĒĢśņØś ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØä ņĢłņĀĢņĀüņ£╝ļĪ£ ĒØĪņ░®Ē¢łņ£╝ļéś ņŚ╝ņé░ ļåŹļÅäĻ░Ć 3 M ņØ┤ņāüņ£╝ļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒØĪņ░®ļźĀņØ┤ ĻĖēĻ▓®ĒĢśĻ▓ī Ļ░ÉņåīĒ¢łņ£╝ļ®░, ĻĄ¼ņĪ░ņ▓┤Ļ░Ć ļČłņĢłņĀĢĒĢ┤ņĀĖ ņ¦Ćļź┤ņĮöļŖä(IV)ņØ┤ ņÜ®ņČ£ļÉśņŚłļŗż. ļśÉĒĢ£ ņŚ╝ņé░ļåŹļÅäĻ░Ć ņØ╝ņĀĢĒĢ£ ņĪ░Ļ▒┤ņŚÉņä£ ņŚ╝ņåīņØ┤ņś©ņØś ļåŹļÅäļź╝ ņ”ØĻ░Ćņŗ£Ēéżļ®┤ ĒīöļØ╝ļōÉ(II) ĒØĪņ░®ļźĀņØ┤ Ļ░ÉņåīĒĢśņśĆļŗż. 0.2-1.0 MņØś ņŚ╝ņé░ ņÜ®ņĢĪņŚÉņä£ UIO-66-NH2ņØś ĒīöļØ╝ļōÉ(II) ĒØĪņ░®ņØĆ Langmuir ļō▒ņś©ĒØĪņ░®Ļ│╝ ņל ņØ╝ņ╣śĒĢśņśĆļŗż. ļśÉĒĢ£ ĒØĪņ░®ļ░śņØæņØĆ 2ņŗ£Ļ░äņŚÉ ļ░śņØæĒÅēĒśĢņŚÉ ļÅäļŗ¼Ē¢łņ£╝ļ®░ 2ņ░© ļ░śņØæņåŹļÅä ļ¬©ļŹĖņØä ņĀüņÜ®ĒĢśņŚ¼ ņ┤łĻĖ░ļ░śņØæņåŹļÅäļź╝ ĻĄ¼Ē¢łļŗż. 0.2 MĻ│╝ 1 MņØś ņŚ╝ņé░ņÜ®ņĢĪņŚÉņä£ Langmuir ļō▒ņś©ĒØĪņ░®Ļ│ĪņäĀņŚÉņä£ ĻĄ¼ĒĢ£ UIO-66-NH2ņØś ĒīöļØ╝ļōÉ(II) ņĄ£ļīĆ ĒØĪņ░®ņÜ®ļ¤ēņØĆ Ļ░üĻ░ü 106.5ņÖĆ 40.6 mg/gņ£╝ļĪ£ ņŚ╝ņé░ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ ĒØĪņ░®ņÜ®ļ¤ēņØ┤ Ļ░ÉņåīĒĢśņśĆļŗż. NH4SCNņØä ņäĖņČ£ņĀ£ļĪ£ ņé¼ņÜ®ĒĢśļ®┤ UIO-66-NH2 ĻĄ¼ņĪ░ņ▓┤ņØś ņ¦Ćļź┤ņĮöļŖä(IV) ņĢłņĀĢļÅäņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖņ£╝ļ®┤ņä£ ĒīöļØ╝ļōÉ(II)ņØä ņäĖņČ£ĒĢĀ ņłś ņ׳ņŚłļŗż. UIO-66-NH2ļŖö 1 M ņØ┤ĒĢśņØś ņŚ╝ņé░ ņÜ®ņĢĪņŚÉņä£ ĒīöļØ╝ļōÉ(II)ņØä ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ĒØĪņ░®ĒĢĀ ņłś ņ׳ņ£╝ļ®░ ņØ┤ņś©ĻĄÉĒÖśņłśņ¦Ćļ│┤ļŗż ĒØĪņ░®ņÜ®ļ¤ēņØ┤ Ēü¼Ļ│Ā ļ░śņØæņåŹļÅäĻ░Ć ļ╣Āļź┤ĻĖ░ ļĢīļ¼ĖņŚÉ ņāüņÜ®ĒÖö Ļ░ĆļŖźņä▒ņØ┤ ļåÆļŗż. Ē¢źĒøä ĻĖłņåŹ-ņ£ĀĻĖ░ļ¼╝ ĻĄ¼ņĪ░ņ▓┤ņØś ĒÖöĒĢÖņĀü ņĢłņĀĢļÅäļź╝ Ē¢źņāüņŗ£Ēéżļ®┤ņä£ ņ×¼ņé¼ņÜ® Ļ░ĆļŖźņä▒ ļ░Å ļŗżļźĖ ĻĖłņåŹ ņØ┤ņś©ņØ┤ ĒīöļØ╝ļōÉ(II)ņØś ĒØĪņ░®ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņĪ░ņé¼ĒĢśļŖö ņČöĻ░Ć ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.