1. 서 론
현재 가장 널리 사용되는 리튬 이온 이차 전지(Lithiumion batteries, LIBs)는 높은 에너지 밀도와 비교적 뛰어난 충·방전 효율로 인하여 많은 전자 장치의 에너지 공급원으로 사용되고 있다 [1,2]. 이러한 다양한 장점에도 불구하고 지구상에 존재하는 리튬 금속의 제한된 매장량으로 인한 리튬 에너지 저장 시스템의 비싼 제조 비용은 리튬 전지가 지속 가능한 에너지 시스템이 되기에 걸림돌이 되어왔다 [3]. 더욱이 이러한 리튬 이온 기반 시스템의 에너지 저장 밀도를 향상시키기 위해서는 유기용매 기반의 전해질 설계로 넓은 작동 전압을 확보해야 한다 [4]. 그러나 발화성 유기 용매의 사용으로 인하여 발생 가능한 발화 및 폭발 등의 안전성 문제가 해결해야 할 과제로 남아있다 [3]. 따라서, 유기 전해질 기반의 리튬 배터리의 문제점을 극복하기 위하여 안전한 전해질과 고성능의 전극 소재를 사용하는 차세대 이차 전지에 대한 관심이 증가하는 추세이다 [5].
기존의 리튬 이온 배터리를 대체할 새로운 에너지 저장장치로써 앞서 언급한 유기 리튬 이온 배터리의 문제를 갖지 않는 수용성 전해질을 사용하는 소듐 이온 이차 전지(Aqueous sodium-ion batteries, ASIBs)가 최근 학계에서 주목받고 있다 [6-8]. 리튬에 비하여 자연계에 보다 풍부하게 존재하는 소듐(Na)을 기반으로 하는 전극을 사용하므로 배터리 제조 비용의 절감이 가능하다. 한편, 수용액 전해질은 발화 특성이 없으므로 유기 전해질에 비하여 안전하게 사용이 가능하다. 게다가 외부 수분이나 산소 농도에 따른 특성 변화가 없으므로 보다 손쉽게 배터리 제조가 가능하므로 추가적인 비용 절감을 이룰 수 있다 [5]. 또한, 수용성 전해질은 높은 이온전도성을 가지므로 유기전해질에 비해 빠른 충방전에서도 높은 전하 저장 용량, 즉 고출력 특성을 가질 수 있다. 그리고 유기 전해질의 사용 및 처리로 발생하는 환경 오염문제로부터 보다 자유로울 수 있다 [5]. 하지만, 물을 용매로 사용하는 수용액 전해질은 작동 가능한 전압 창 영역이 물이 분해되지 않는 전압구간으로 제한되므로 에너지 밀도가 기존의 유기 전해질 기반 시스템에 비하여 낮은 단점이 있다 [6].
수계 기반 배터리에 사용 가능한 전극 조건은 물이 안정한 포텐셜 구간내에서 산화/환원 반응이 가능한 물질이어야 한다 [6]. 물이 분해되지 않는 포텐셜 구간내에서 레독스 반응을 하는 양극 물질 중에서 프러시안 블루 유사체(Prussian blue analogs, PBAs)는 고유의 열린 골격 구조(Open framework structure)를 가져 산화/환원 반응 시 리튬 이온 뿐 아니라 보다 큰 소듐 및 칼륨과 같은 알칼리 금속 이온과 함께 다양한 다가 금속 이온(divalent metal ions)들을 수용할 수 있다 [9-16]. 또한, 산화/환원 반응 동안 이러한 이온들이 3차원 방향으로 삽입/탈리하므로 빠른 충·방전 특성을 보인다. 그리고 PBA구조의 물질은 산화/환원 반응 동안 미소한 격자 변형(lattice strain)을 보이는 매우 안정적인 구조이므로 수명 안정성이 뛰어나다 [9]. 배위 화합물(coordination compound)의 한 종류인 프러시안 블루 유사체는 전위 금속 양이온과 철 음이온이 사이아나이드(cyanide, CN) 리간드로 연결된 구조를 갖고 있다. 여기서 사이아노이드기(cyano group, –CN)는 철과 강하게 결합하므로 PBA구조는 독성이 없는 친환경적인 물질이다 [17].
프러시안 블루 유사체의 다양한 장점에도 불구하고 전극 재료로서 몇 가지 단점을 갖고 있다. PBA구조의 양극 활물질은 방전시 전해질에 존재하는 양이온을 큐빅 격자 구조내의 큰 침입형 자리(interstitial sites)로 수용한다. 따라서, 층상형 구조를 갖는 양극 재료(예, 리튬 코발트 산화물(Lithium cobalt oxide))에 비하여 양이온을 수용할 수 있는 공간이 제한적이므로 에너지 밀도가 낮다는 단점을 갖는다 [9,18-20]. 게다가 PBA구조의 물질은 주로 수용액 전구체를 사용하여 침전공정으로 빠르고 편리하게 합성되는데, 빠른 침전 반응 속도로 인하여 완전한 결정의 PBA 구조를 형성하지 못한다. 즉, 물 분자가 공침 공정에 참가하여 침입형 자리에 제올라이트 형 물 분자(zeolitic water)를 포함하거나 공공자리에 배위 결합된 물 분자(coordinating water)가 생성된다. 제올라이트 물 분자는 충전/방전시 양이온의 삽입/탈리를 방해하여 전기화학적 에너지 저장 특성을 저하시킨다. 그리고 금속 이온에 배위 결합된 물 분자는 헥사사이아노철(Fe(CN)6)의 공공(vacancy)을 형성하므로 전하 저장 특성을 떨어뜨린다. 이는 PBA 소재의 비교적 낮은 용량을 더욱 악화시키는 요소가 된다.
PBA구조의 물질들의 낮은 용량을 극복하기 위하여 최근 많은 연구자들은 에너지 저장 용량을 향상시키는 연구를 수행 중이다 [19,21]. 전극 내에 존재하는 공공이나 침입형 자리에 있는 물 분자를 제거함으로써 완전한 결정 구조에 가까운 PBA 물질을 합성하여 이론 용량에 가까운 전극 재료를 합성하는 연구들이 많이 수행되는 중이다 [22-24]. 더불어 PBA구조내 전이 금속의 종류(Mn, Fe, Co, Ni, Cu, Zn)에 따라 에너지 저장 용량이 변화하므로 다양한 전이 금속으로 합성하여 용량 향상을 위한 연구도 진행 중이다 [12,25,26]. 이러한 연구들은 합성된 PBA전극의 에너지 용량을 근본적으로 향상시키긴 하나, 합성된 PBA전극이 실제 수계 배터리에 사용되었을 때 사용 환경에 따라 에너지 용량의 변화는 간과하고 있다. 따라서 본 연구에서는 PBA구조 물질 중 수명 안정성이 높고 친환경적이며 낮은 비용의 헥사사이아노철산 니켈(Nickel hexacyanoferrate, NiHCF)을 수계 소듐 이온 배터리의 양극 물질로 사용하였을 때 사용하는 전해질에 따른 용량의 변화를 분석하고 높은 에너지 저장 성능 확보를 위한 최적의 전해질을 선정하고자 하였다. 이를 위해 전극의 산화/환원 반응에 직접적으로 참가하는 소듐 이온을 제외한 전해질내 음이온에 따라 NiHCF전극의 전기화학 특성을 살펴보기 위해 동일한 농도(1 M)를 갖는 Na2SO4와 NaNO3를 수계 전해질로 사용하였다. 사용된 전해질에 따른 NiHCF 전극의 전기화학적 거동과 성능 변화는 다양한 전기화학적 실험으로 분석하였으며, 측정된 실험결과를 바탕으로 최적의 전해질을 도출하였다.
2. 실험방법
2.1 Coprecipitation synthesis of NiHCF
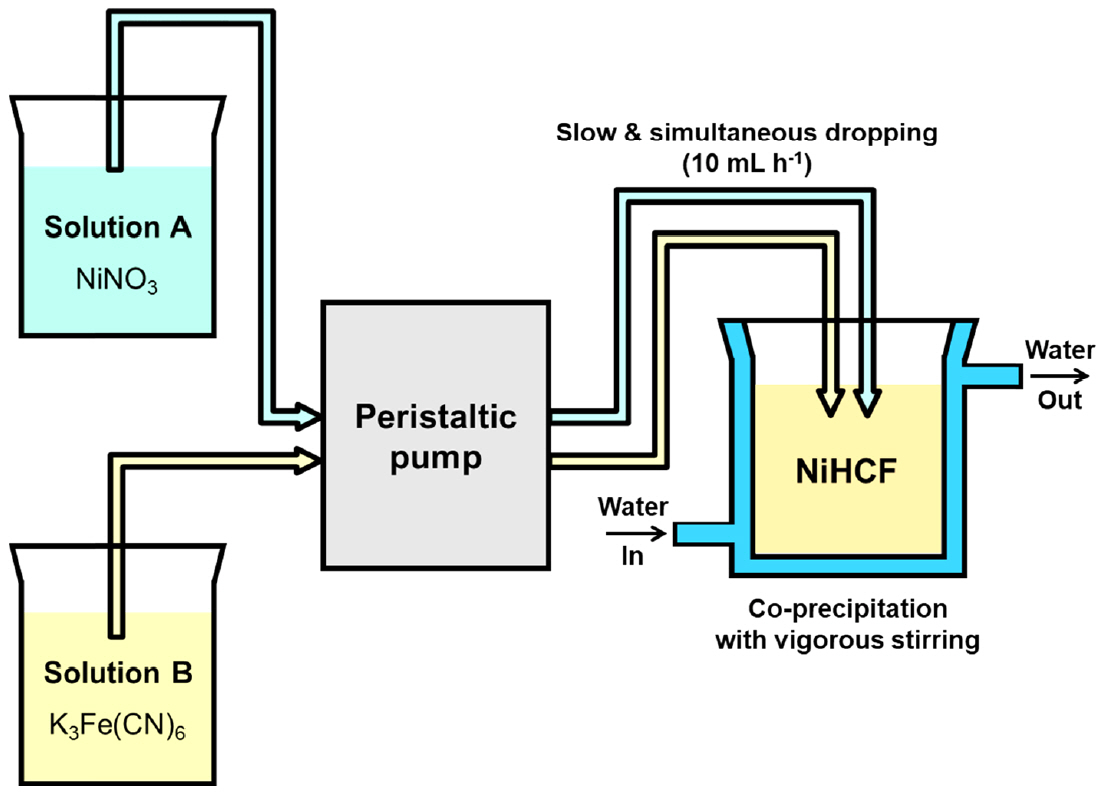
일정한 조성의 배위 화합물(coordination compound)을 편리하게 대량 생산할 수 있는 합성법인 공침법(coprecipitation)을 사용하여 전극 물질인 헥사사이아노철(III)산 니켈(II) (Nickel hexacyanoferrates; NiHCFs)을 합성하였다. 니켈은 코발트와 같은 전이 금속에 비하여 비용이 저렴하고 헥사사이아노철산 이온과 쉽게 결합이 가능하여 Prussian blue analogue (PBA) 구조체를 쉽게 형성할 수 있다. 전이 금속인 니켈을 포함하는 질산니켈육수화물(Nickel nitrate, Ni(NO3)2·6H2O; Duksan science, Korea)과 철을 포함하는 헥사사이아노철(III)산 칼륨(Potassium hexacyanoferrate, K3Fe(CN)6; Alfa Aesar, USA)을 전구 물질로 사용하였다(그림 1). 먼저, 0.02 mol의 Ni(NO3)2·6H2O를 200 mL의 초순수에 용해하여 용액 A를 준비하였고, 0.01 mol의 K3Fe(CN)6를 200 mL의 초순수에 용해하여 용액 B를 준비하였다. 준비한 두 A, B수용액은 연동 펌프(Peristaltic Pump, Shenchen, Lab2015, China)를 이용하여 100 mL의 초순수를 넣은 이중 자켓 비커(Jacketed beaker)에 10 mL h-1의 속도로 20시간 동안 천천히 동시에 한 방울씩 떨어뜨리며 공침하여 NiHCF를 합성하였다 (그림 2). NiHCF 생성의 공침 화학반응식은 다음과 같이 표현된다.
공침 반응 시 온도는 그림 2와 같이 이중 자켓 비커 외벽에 일정한 온도의 물을 항온순환장치(Circulating water bath, Samheung, SH-WB-22CDN, Korea)를 이용하여 순환시켜 합성온도를 70 °C (±1 °C)로 유지하였다. 공침 반응이 일어나는 비커내 용액은 마그네틱 바를 이용하여 강하게 교반하여 반응이 균일하게 일어나도록 유도하였다. 두 용액의 공침 반응으로 생성되는 공침액의 최종 농도는 0.04 M Ni(NO3)2와 0.02 M K3Fe(CN)6 500 mL가 되도록 하였다. 합성된 NiHCF의 균질한 입자 생성을 위해 일정한 온도를 유지하며 12시간 동안 교반 하였다. 공침으로 생성된 침전물은 여과와 세척을 통해 공침액으로부터 분리하였다. 얻어진 NiHCF분말은 흡착된 물과 제올라이트 형 물의 제거를 위해 진공 오븐(Vacuum oven, Jeio tech, OV-11, Korea)에서 80 °C로 12시간 동안 건조하였다.
2.2 Characterizations
합성된 NiHCF 물질 입자와 표면 형상을 관찰하기 위해, 전계 방사형 주사전자현미경(FE-SEM, Hitachi, SU8220, Japan)을 이용하여 5 kV의 가속 전압과 8-9 mm의 작동 거리 조건에서 표면을 관찰하였다. 생성된 입자의 크기 분석을 위해 초순수에 NiHCF 분말을 분산시켜 초음파 진동 분석 조건에서 입도 분석기(particle size analyzer, Marlvern, Matersizer 3000, U.K.)를 이용하여 측정하였다.
합성된 입자의 비표면적과 표면의 기공 구조를 살펴보기 위하여 자동화 가스 흡착 분석기(Quantachrome, AutosorbiQ & Quadrasorb SI, USA)를 이용하여 상대압력(P/P0 = 0.01–0.99)에 따른 질소 가스의 흡착/탈착량을 측정하여 질소 등온흡착곡선(isotherm)을 구하였다. 얻어진 흡착곡선으로부터 multi-point Brunauer-Emmett-Teller (BET) 이론을 이용하여 비표면적을 산출하였고, Non-local density functional theory (NLDFT)를 이용하여 기공 분포도를 나타내었다.
합성된 전극 물질의 격자 구조 및 결정성을 확인하기 위해 X선 회절 분석기(XRD, Rigaku, D/Max-2500, USA)를 이용하여 측정하였다. 이 때 사용한 X–선은 Cu의 Kα선(λ=1.54 Å)이며, 40 kV의 전압과 30 mA의 관전류에서 10–90 °의 2θ 범위 조건에서 분석을 수행하였다. 제조된 물질의 원자 조성 분석을 위해 유도 결합 플라즈마 분광기(ICP, PerkinElmer, Optima 7300DV, USA)를 사용하였다. 유도 결합 플라즈마 분광기는 분석 시편의 금속 만 분석 가능하므로 합성된 NiHCF 시편 성분 중 칼륨(K), 니켈(Ni), 그리고 철(Fe)만 측정하였고, 탄소(C)와 질소(N)는 전구 물질인 K3Fe(CN)6에서 Fe와 결합된 상태로 합성되므로 Fe : C : N의 원소 비율인 1:6:6을 고려하여 계산으로 추정하였다. 원자 조성 분석과 함께 합성된 NiHCF내에 존재하는 물 분자의 양을 측정하기 위하여 자동화 열 중량/시차 주사 열량 분석기(auto TGA-DSC, TA Instruments, Discovery SDT 650, USA)를 이용하였다. 분석을 위한 실험 조건은 질소 분위기에서 300 °C까지 분당 5 °C의 승온 조건으로 상온에서 300 °C까지 NiHCF 분말의 질량 변화를 측정하였다.
합성된 NiHCF 분말의 전기화학적 분석을 위하여 결합제(binder)로써 폴리플루오린화비닐리덴(PVDF; Sigma Aldrich, USA)과 도전 재료(conducting additive)로써 카본 블랙(Ketjen black EC 600 JD)을 사용하여 물리적으로 혼합하여 전극 재료를 준비하였다. NiHCF와 결합제 및 도 전재의 비율은 8:1:1의 질량 비로 1-메틸-2-피롤리딘온(1-Methyl-2-pyrrolidone; Alfa Aesar, USA) 용매에 교반을 통해 고르게 분산시켜 전극 물질 용 슬러리(slurry)를 제조하였다. 전기화학 실험을 위한 집전체로 니켈 기판(Koralco Corp, Korea)을 1 × 2.5 cm2의 크기로 절단하여 사용하였다. 준비한 슬러리를 조절형 필름 도포기(micrometer film applicator, CKSI, Lab-Q, Korea)를 이용하여 닥터 블레이드(doctor blade)법으로 기판 위에 1 × 1 cm2의 면적으로 코팅하였다. 코팅된 전극의 용매와 수분을 제거하기 위해 기판위에 코팅된 전극은 진공 분위기에서 80 °C의 온도로 12시간 동안 건조하였다.
모든 전기화학 분석은 비커 타입의 삼 전극 셀을 이용하여 0.1–1 V (vs. normal hydrogen electrode, NHE; 표준 수소 전극)의 전압 범위에서 진행하였다. 제조된 NiHCF 전극은 작업 전극으로 사용되었고, 상대 전극으로 백금 코일을 사용하였다. 실험을 위한 기준 전극으로 표준 감홍 전극(saturated calomel electrode, SCE; 0.241 V vs. NHE)을 사용하였고 측정된 전기화학 실험의 전압값은 표준 수소 전극을 기준으로 환산하였다. 다양한 전기화학 분석은 전위차계(Potentiostat, Bio-Logic, VMP3, France)와 배터리 사이클러(Battery cycler, WonA Tech, WBCS3000, Korea)로 측정하였다.
전해질에 따른 전기화학 특성 평가를 위해 1 M 농도의 질산나트륨 (NaNO3; Alfa Aesar, USA)수용액과 1 M 농도를 갖는 황산나트륨(Na2SO4; Alfa Aesar, USA)수용액을 사용하였다. NiHCF 전극의 산화/환원 피크의 분리 정도(peak to peak separation)와 반응 전압(redox potential) 분석을 위해 0.5 mV s-1의 속도로 포텐셜을 주사하면서 순환전압전류(CV)곡선을 측정하였다. 에너지 저장의 속도론적 특성 분석을 위해 정전류충방전법(galvanostatic cycling)를 이용하여 1, 5, 10, 그리고 20의 전류 속도(C-rate)에서 비전기용량과 속도 대비 용량 유지율을 측정하였다. 충방전 실험시 전극의 쿨롱 효율 및 에너지 효율을 계산하였다. 전기화학적 임피던스 분광법(Electrochemical impedance spectroscopy)은 개회로 전압 조건(open circuit potential)에서 sin파형의 10 mV의 전압 진폭을 가하여 10-1 Hz부터 106 Hz의 주파수 범위의 조건에서 측정하였다. 임피던스 분광법으로 전해질에 따른 전하 이동 저항을 측정하였다.
3. 결과 및 고찰
3.1 합성된 NiHCF의 물리·화학적 특성 분석
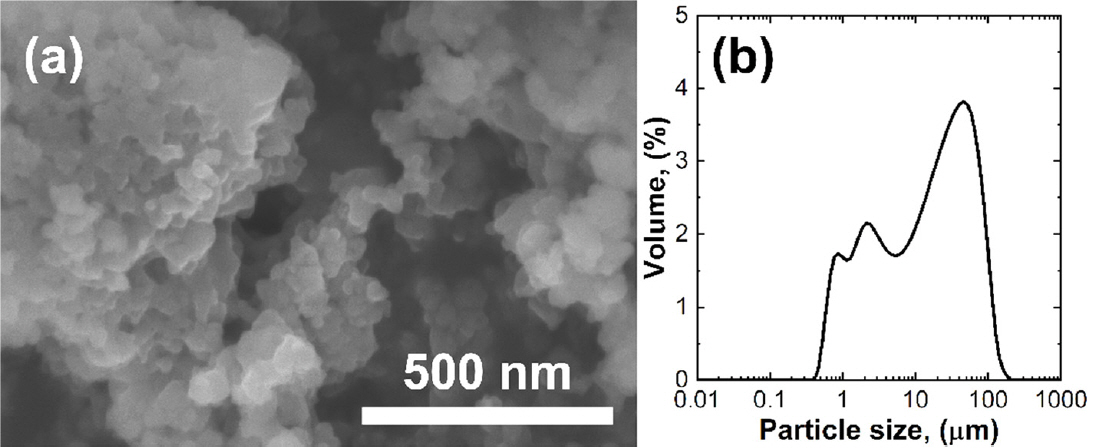
공침법으로 합성된 Nickel hexacyanoferrate(NiHCF) 물질 입자의 입자 형태와 표면 형상을 분석하기 위하여 전계 방사형 주사전자현미경(FE-SEM)을 이용하여 측정하였다. SEM 이미지는 합성된 NiHCF가 불규칙한 형태를 갖고 있으며 많은 불규칙 입자들이 응집하였음을 보여주었다(그림 3(a)). 평균 80 nm의 크기를 갖는 미세한 분말들이 뭉쳐 있는 형태를 이루고 있다. 보다 정량적으로 입자의 크기 분포를 확인하기 위하여 입도 분석기를 이용하여 입자 크기 별 부피 비율을 확인하였다 (그림 3(b)). 입도 분석 결과 입자들은 0.3-100 μm 사이의 넓은 범위의 크기 분포를 갖고 있음을 확인할 수 있다. 이는 SEM 이미지에서 확인되는 입자들의 크기에 비해 전체적으로 더 큰 결과를 보여주었다. 입도 분포 분석 결과가 SEM 이미지로 확인되는 입자들에 비하여 더 높은 값을 갖는 이유는 응집된 NiHCF 입자들이 하나의 입자로 인식되어 분석된 결과로 판단된다.
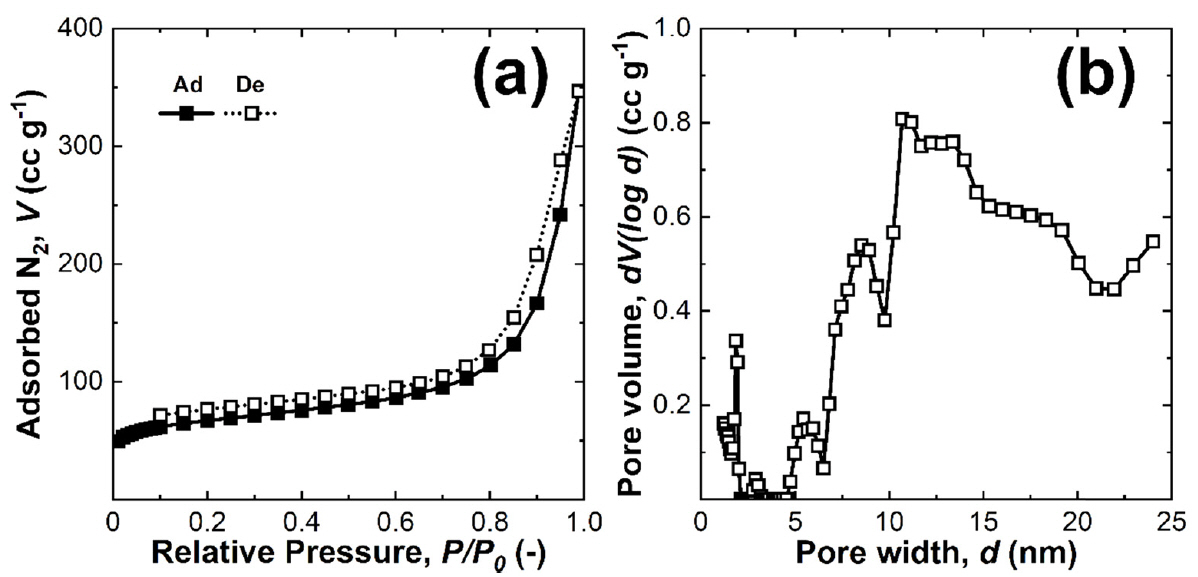
합성된 NiHCF의 표면 형상 이미지로부터 공침으로 제조된 분말들은 거친 표면형상을 갖는 다는 것을 확인할 수 있었다. 이러한 표면 형상을 정량적으로 분석하고 거친 표면 형상으로부터 얻어지는 비표면적을 구하기 위하여 N2 가스를 이용하여 NiHCF 물질 표면에 흡착/탈착되는 양을 N2 압력에 따라 분석하였다. 이렇게 구해진 흡·탈착의 등온곡선으로부터 Multipoint B.E.T.방법으로 비표면적을 계산하였고 기공 크기 별 분포를 분석하였다. 얻어진 흡·탈착 곡선은 형태에 따라 측정된 물질의 기공 크기 분포를 이해할 수 있다 [27]. 그림 4(a)는 흡착과 탈착 곡선이 일치하지 않는 이력현상(hysteresis)을 보여준다. 또한 초기의 낮은 압력구간에서 상대 압력(P/P0) 축 방향으로 오목한 그래프 특징을 보여주며 가운데 압력구간에서 선형적으로 증가하는 곡선을 보이고 있다. 이는 Type IV의 전형적인 흡·탈착 곡선과 잘 일치하는 모습을 보여준다. 흡·탈착의 이력현상은 물질에 존재하는 메조기공(mesopore, 2 nm<d<50 nm)에서의 N2 기체의 모세관 응축 현상(capillary condensation)으로부터 발생한다. 이러한 분석 결과는 기공 크기 분포 그래프에서도 시각적으로 확인할 수 있다(그림 4(b)). 0-3 nm 구간의 기공들과 함께 주로 5-25 nm의 크기 범위를 갖는 기공이 많이 존재한다는 것을 확인 할 수 있다. 제조된 NiHCF물질의 비표면적은 249 m2 g-1로 측정되었다. 이러한 넓은 비표면적과 메조 기공을 갖는 표면 구조는 제조된 NiHCF분말을 전극 활물질로 사용하였을 때 전해질 이온의 접근을 용이하게 함으로써 충방전반응이 쉽게 일어날 수 있도록 하는 구조로 생각된다.
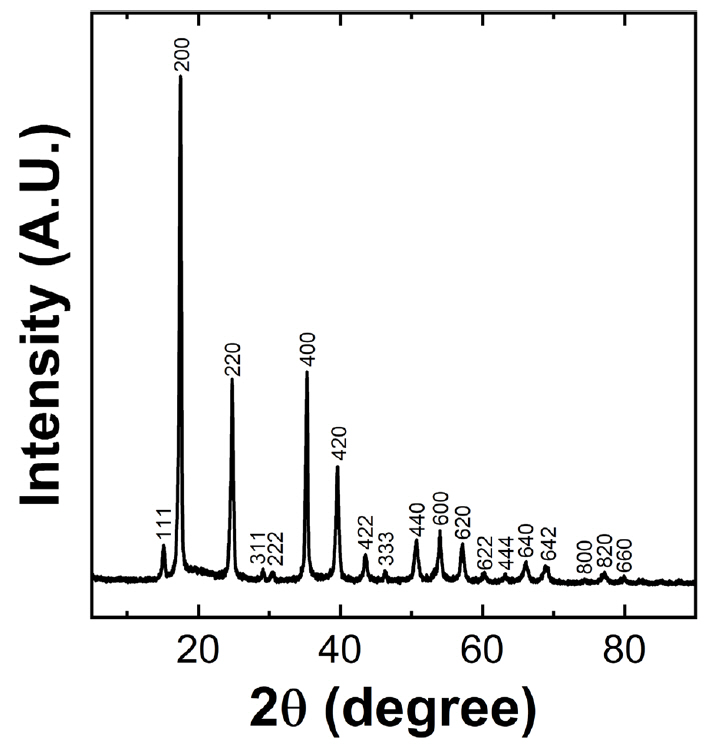
공침으로 합성된 NiHCF 전극 물질의 결정 구조와 결정성을 조사하기 위해 X-ray diffractometer를 이용하여 분석하였다. 그림 5는 합성된 NiHCF 분말에 대해서 측정된 XRD 패턴 결과이다. 얻어진 XRD 패턴의 피크(peak)들에 해당하는 밀러 지수(miller index)를 분석한 결과 제조된 분말은 프러시안 블루 유사체(Prussian blue analogues, PBAs)들이 전형적으로 갖는 면심 입방(Face centered cubic, FCC) 구조로 분석된다 [9]. 또한 제조된 NiHCF 물질의 격자 상수(lattice parameter)를 계산하기 위하여 XRD 패턴과 브래그 법칙(Bragg's law)을 사용한 결과 10.21 Å로 계산되었다. 관측된 XRD 피크들은 문헌에서 확인되는 NiHCF의 결정 피크들과 잘 일치하는 동시에 매우 뚜렷하게 나타나는 것을 확인할 수 있다. 뚜렷한 XRD 피크는 합성된 물질의 높은 결정성을 나타내는 것으로 현재 그 이유는 명확하게 밝혀지진 않았으나 공침 공정을 위해 설정한 70 °C의 높은 온도로 인한 것으로 생각된다. 공침에 의한 프러시안 블루 유사체의 합성은 전이 금속 양이온과 헥사사이아노철 음이온이 수용액 내에서 반응하여 배위 결합 화합물(coordination compound)을 생성하는 공정이다. 공침 공정은 NiHCF의 핵 생성과 격자 성장이 매우 빠르게 일어나므로 수용액 전구체 물 분자가 금속 양이온과 결합하여 공침시 화합물 내부에 배위 결합된다. 배위 결합된 물은 헥사사이아노철 음이온자리에 공공(vacancy)을 발생시켜 결정성을 떨어뜨리게 된다. 공침 공정의 온도가 높을수록 전이 금속 이온 주변을 둘러싸고 있는 물 분자의 탈수가 선호된다고 알려져 있으며, 따라서 합성된 NiHCF내에 제올라이트 형 물 또는 배위 결합된 물의 양이 비교적 적기 때문에 결정성이 높아진 것으로 예측된다 [28]. 공침 온도 변화에 따른 결정성의 변화와 그에 따른 전기화학 특성에 미치는 영향에 대해서는 추가적인 연구가 진행될 예정이다.
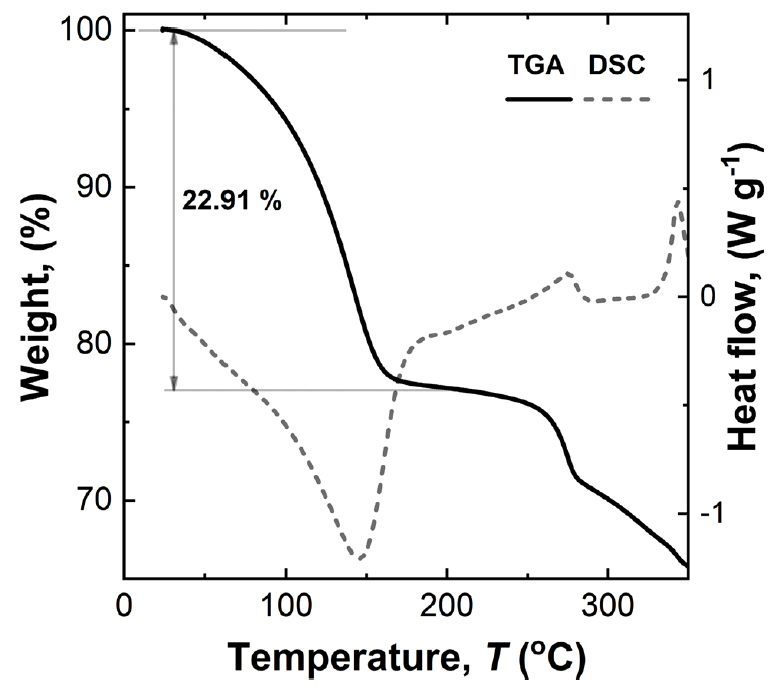
앞서 언급한 것처럼 수용액 전구체로부터 공침으로 제조된 NiHCF 분말의 경우 PBA구조내에 물 분자가 함께 포함되어 합성될 수 있으므로 재료 내에 제올라이트 형 물 분자 또는 배위 결합된 물 분자가 생성될 수 있다. 이러한 물 분자의 양은 재료 내의 vacancy를 증가시켜 비전하저장 용량을 감소시키므로 이에 대한 분석이 필요하다. 따라서 재료내 물 분자의 양을 열 중량/시차 주사 열량 분석(TGA/DSC)으로 측정하였다 (그림 6). 합성된 NiHCF는 80 °C의 온도 조건에서 진공 분위기에서 충분히 건조(12 h) 되었으므로 결합력이 약한 흡착된 물 분자와 제올라이트형 물 분자들은 제거된 상태이다 [29]. 따라서 TGA 실험에서 200 °C 이하 낮은 온도구간에서의 질량 감소로부터 배위 결합된 물 분자의 양을 측정할 수 있다. TGA실험 결과 100 °C 이하 온도에서 계속적인 질량감소가 나타나는데 이는 샘플의 표면으로 재흡착된 물분자가 증발함으로써 발생하는 것으로 추정된다. 그림 6의 시차 주사 열량 곡선(DSC curve)에서 상온에서 약 200 °C이하의 온도 구간에서 흡열 피크가 관찰되는데 이는 배위 결합된 물 분자와 표면에 재흡착된 물분자가 증발하면서 열을 흡수하기 때문으로 추정된다. 280 °C 부근에서의 발열 반응과 TGA에서의 급격한 질량 감소는 NiHCF내 ─C≡N─ 결합이 산화되어서 나타나는 피크이다 [12,29-32]. 따라서, 약 250 °C 이하 온도구간까지 질량 손실률을 측정하여 합성된 NiHCF의 물분자의 함량이 초기 무게의 22.9%임을 확인하였다. 합성된 물질내의 물 분자량 이외에 물질을 구성하는 원소들의 조성은 유도 결합 플라즈마 분광기(ICP-MS)를 활용하여 분석하였다. 이를 이용하여 측정된 칼륨(K), 니켈(Ni), 그리고 철(Fe)의 원소 비율은 0.07 : 1.44 : 1 로 분석되었다 (표 1). 따라서, DSC를 통해 분석한 수분 함량과 ICP-MS를 이용하여 계산된 금속 원소의 비율로부터 합성된 NiHCF는 K0.07Ni1.44Fe(CN)6·4.4H2O의 원자 조성을 갖는 것을 확인하였다. 완전한 결정의 NiHCF의 큐빅 구조에서는 Ni과 Fe의 조성이 1:1을 갖는 것에 비해, 여기서 합성된 NiHCF내 Ni과 Fe의 조성비 1.44:1로 측정되는 이유는 Fe 자리의 공공발생으로 인한 것이다 [22].
3.2 사용된전해질에따른전극의전기화학거동
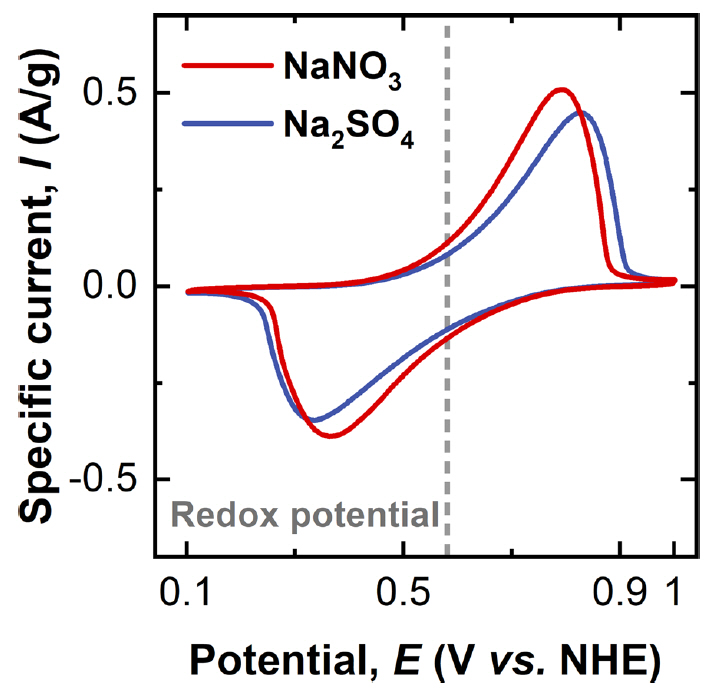
제조된 NiHCF 전극의 사용하는 전해질에 따라 다른 전기화학 거동을 살펴보기 위해 순환전압전류법(Cyclic voltammetry)으로 분석하였다 (그림 7). 구체적으로 전해질 내 존재하는 음이온에 따른 거동의 변화를 살펴보기 위하여 소듐(Na+) 이온을 공통으로 하고 다른 음이온(질산 이온(NO3-)과 황산 이온(SO42-))을 포함하는 두 가지 전해질을 사용하였다(1 M Na2SO4 and 1 M NaNO3). 사용하는 전해질에 따른 소듐 이온의 산화/환원 반응 전압을 측정하기 위해 동일한 전압 주사 속도(scan rate)에서 산화 피크의 포텐셜과 환원 피크의 포텐셜의 평균값을 측정하였다 (표 2). 이때 전극에서 일어나는 소듐 이온의 레독스 반응은 아래와 같다 [33,34]:
충전시 NiHCF내의 철(II)이 철(III)로 산화되며 소듐 이온이 양극 활물질 내부에서 전해질로 탈리 된다. 즉, 전극의 산화/환원에 따라 NiHCF내 Fe이온의 산화수가 2+와 3+사이에서 변화하며 충·방전을 한다. 한편, NiHCF를 구성하는 또 다른 전이 금속인 니켈은 수용성 전해질이 안정한 전압창 영역(-0.36 V–0.87 V (vs. NHE) at pH=6) 내에서는 산화/환원하지 않고 오직 철의 산화/환원만이 일어나기 때문에 한 쌍의 산화/환원 피크가 보여진다 [10, 35, 36]. 사용된 두 전해질에서 측정된 산화/환원 반응 전압은 모두 0.58 V (vs. NHE)로 측정되었다. 측정된 값은 동일한 공침법에 의하여 합성된 NiHCF 문헌의 레독스 포텐셜 값(0.59 V vs. NHE)과도 잘 일치한다 [9].
전해질 내 존재하는 음이온에 따른 산화/환원 반응의 가역성(reversibility)을 분석하기 위해 각 전해질에서 측정된 산화 피크와 환원 피크의 포텐셜 차이를 측정하였다 (표 2). 피크 간 포텐셜 차이는 NaNO3전해질의 경우 0.43 V로 Na2SO4전해질의 0.49 V에 비해 더 낮게 측정되었다. 산화 또는 환원 피크 포텐셜이 레독스 포텐셜로부터 분극되는 이유는 전해질의 저항(Rs)으로 인해 발생하는 분극과 전극/전해질 계면에서 발생하는 활성화 분극 및 농도 분극 때문이다 [37,38]. 전해질내 전하 전달 이온의 농도가 충분하다고 할 때 주로 활성화 분극에 의해서 포텐셜의 차이가 발생한다 [39]. 본 실험에서는 전극과 전해질의 거리를 최소화하여 전해질의 전도성에 따른 영향을 최소화하였으므로 분극 현상은 전극/전해질 계면에서의 전하 이동 저항(Rct)이 전해질에 따라 다른 분극 크기에 주로 영향을 미친 것으로 생각된다. 따라서 NO3- 음이온을 사용한 전해질의 경우 계면 저항이 SO42- 음이온을 포함하는 전해질보다 더 작을 것으로 예측된다. 사용한 전해질에 따라 산화/환원 포텐셜의 차이뿐만 아니라 반응 전류 값도 차이를 보여주었다. NaNO3 전해질을 사용하였을 때 반응 전류 값은 Na2SO4 전해질의 경우보다 더 큰 값을 보여주었다. 이는 NaNO3 전해질을 사용하였을 때 더 많은 전하량이 저장되는 것을 의미한다.
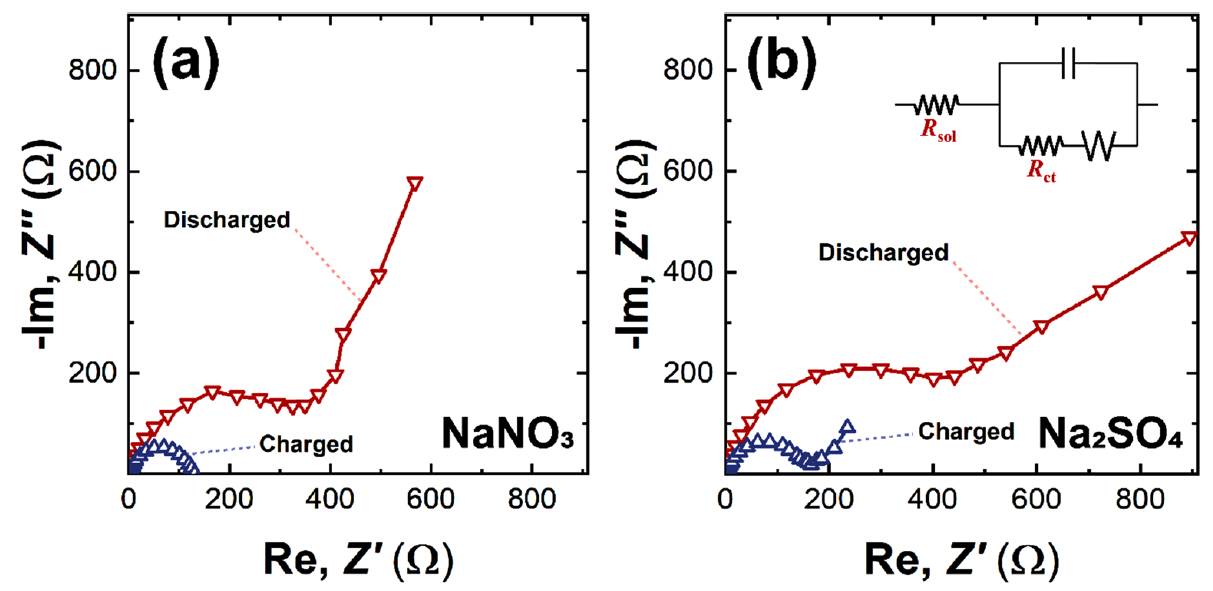
순환전압전류법에서 확인하였던 것처럼 두 전해질에서 다르게 나타나는 분극 크기의 이유를 조사하기 위해 전극/전해질 계면에서의 전하 전달 저항(Rct)을 전기화학 임피던스 분광법(electrochemical impedance spectroscopy)으로 측정하였고, 그 결과를 나이키스트 선도(Nyquiest plot)로 나타내었다 (그림 8). 전기화학 전지에서 삽입/탈리(intercalation/deintercalation) 반응으로 에너지를 저장하는 양극의 전기화학 반응을 묘사하는 등가회로(equivalent circuit)로 Randles 회로(Randles circuit)를 사용하여 모델링 하였다(그림 8(b)의 삽도)). Randles 회로에 대응하는 임피던스를 식으로 나타내면 다음과 같이 주파수의 함수로써 임피던스를 표현할 수 있다 [40,41].
여기서 Rsol과 Rct는 각각 전해질 저항(solution resistance)과 전하 전달 저항(charge transfer resistance)에 해당된다. Cd는 전극 계면과 전해질 이온 사이에 형성되는 전기 이중층의 비전기용량(electric double layer capacitance)을 나타내며 f는 주파수(frequency)를 나타낸다. 전극에 대한 임피던스 측정 시 고주파수 범위에서 식 (3)의 허수부(오른쪽 항)가 매우 작아지므로 측정되는 임피던스 값은 Rsol에 수렴하고, 저주파 영역으로 갈수록 임피던스는 Rsol+ Rct에 수렴한다. 따라서 이 두 값의 차이로부터 전하 전달 저항을 계산할 수 있다. 식 (3)을 그림 8의 나이키스트 선도에 피팅하여 전하 전달 저항을 표 3과 같이 계산하였다. 사용한 두 가지 전해질에 대해 충전된 상태와 방전된 상태에서 각각 전하 전달 저항을 구하였다.
NiHCF 물질은 수용액 배터리의 양극 활물질로서, 방전 반응시 전극내 철이온이 환원하는 동시에 전해질에 존재하는 소듐 이온이 전극 물질 내부로 삽입된다. 방전된 전극에서 측정된 전하이동 저항이 충전된 전극에 비하여 더 높은 이유는, 소듐이 삽입된 충전 상태에서는 소듐의 추가적인 삽입이 어렵기 때문으로 추정된다. 그에 반해 소듐이 탈리된 방전 상태에서는 소듐의 추가적인 삽입이 상대적으로 용이하므로 더 낮은 전하이동 저항이 측정된 것으로 생각된다 (표 3). 또한 사용한 음이온의 종류에 따라 NiHCF 전극은 NaNO3전해질에서 Na2SO4전해질 보다 더 낮은 전하 이동 저항을 보여주었다. 이는 앞선 순환전압전류 곡선에서 예측하였던 것처럼 NaNO3전해질에서 Na2SO4전해질 보다 더 높은 가역성을 보이는 이유가 바로 계면에서의 낮은 전하 이동 저항 때문으로 분석할 수 있다. 즉, 낮은 전하 전달 저항은 산화 또는 환원 반응의 포텐셜이 평형 레독스 포텐셜로부터의 분극을 줄이고, 따라서 좀 더 가역적인 반응을 일으키는 것으로 생각할 수 있다. 이러한 실험 결과는 전해질을 구성하는 음이온이 전극/전해질 계면에서의 전하 이동 저항을 변화시켜 전극의 전기화학적 거동에 영향을 줄 수 있다는 것을 보여준다. 실용적인 관점에서 실험 결과는 NaNO3전해질은 Na2SO4전해질에 비해 낮은 전하 전달 저항을 만들고 그에 따라 NiHCF 전극이 높은 비전기용량과 뛰어난 율속 특성을 갖게 함을 의미한다. 따라서 수계 소듐 이온 배터리의 전해질로서 NaNO3전해질이 Na2SO4전해질 보다 더욱 적합한 것으로 생각된다.
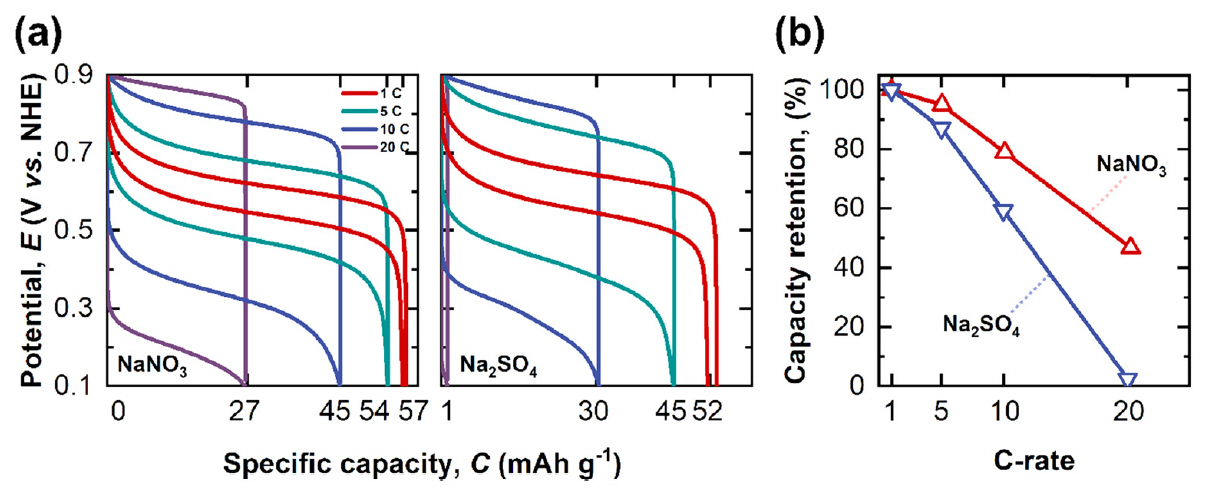
사용하는 전해질에 따른 NiHCF전극의 전기화학적 에너지 저장 특성과 충·방전 속도에 따른 용량 변화(율속 특성)를 측정하기 위해 정전류충방전법(galvanostatic charge-discharge)을 이용하여 측정하였다(그림 9(a-b)). 충·방전 속도에 따른 용량 분석은 1, 5, 10, 그리고 20 C-rate에서 측정하였다. 합성된 전극의 1 C-rate에서의 비전기용량은 NaNO3전해질과 Na2SO4전해질에서 각각 57 mAh g-1와 52 mAh g-1로 측정되었으며 NaNO3 전해질 사용시 더 높은 비전기용량을 나타냄을 확인하였다. 비록 전해질을 구성하는 음이온은 전극의 산화/환원 반응에 직접적으로 참여하지는 않지만 전극의 전기화학적 성능에 영향을 미친다는 것을 본 실험을 통해 알 수 있다. 이는 앞서 분석한 것처럼 전해질에 따라 전극의 계면 저항의 변화 때문으로 생각할 수 있다. 다양한 C-rate에서 측정한 비전기용량 실험결과를 보면 충·방전 속도를 1 C-rate에서 20 C-rate로 증가시켰을 때 Na2SO4 전해질을 사용하였을 경우 52 mAh g-1 에서 1 mAh g-1 로 감소하였으며 이는 약 2.4%의 용량 보존율을 나타낸다. 그에 반하여 NaNO3 전해질을 사용하였을 경우 용량은 57 mAh g-1 에서 27 mAh g-1 로 46.6%의 용량 보존율을 보여주었다. 높은 율속 특성 또한 NaNO3전해질과 NiHCF 전극 사이의 낮은 전하 전달 저항에 기인하는 것으로 생각된다. 요약하면, 전해질을 구성하는 음이온은 소듐 이온의 NiHCF전극으로 삽입/탈리의 전 기화학 반응에 영향을 미치며 그에 따라 비전기용량과 율속 특성에 영향을 미친다는 것을 보여준다.
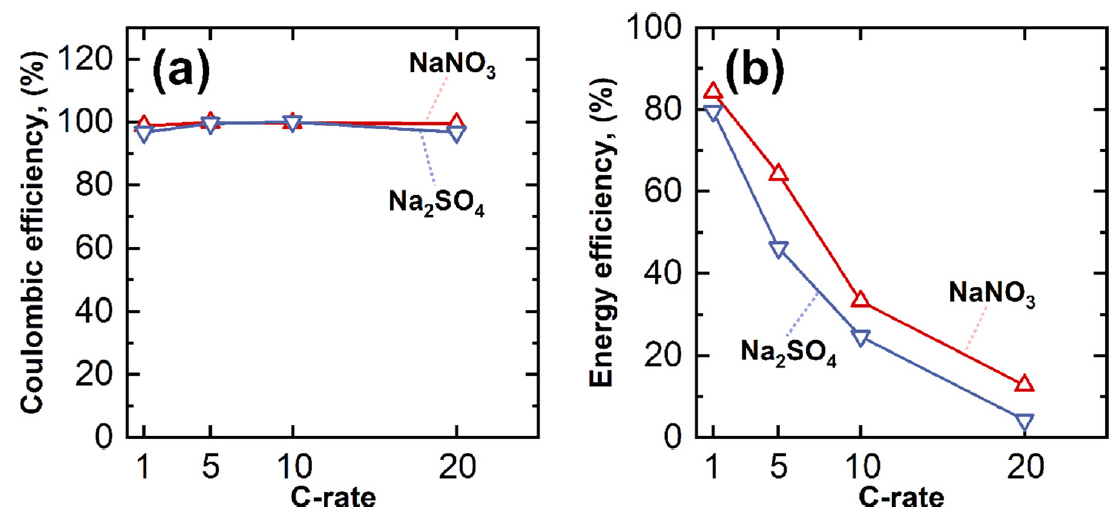
NiHCF전극의 전해질에 따른 전기화학적 거동 및 성능의 차이와 함께 충·방전 간의 쿨롱 효율과 에너지 효율을 분석하였다 (그림 10). 그림 10(a)에서 확인할 수 있는 것처럼 NiHCF전극은 사용된 두 전해질 모두에서 97% 이상의 높은 쿨롱 효율을 보여주었다. 이는 합성된 NiHCF전극의 열린 골격 구조(open framework structure)와 넓은 비표면적으로 인하여 전극/전해질간의 넓은 전기화학적 계면 형성에 기인하는 것으로 분석된다 [33,34]. 열린 골격구조는 알칼리 금속 이온이 격자 내부를 쉽게 삽입/탈리 할 수 있게 한다. 그리고 넓은 계면은 산화/환원시 전하 전달 저항을 감소시켜 충전된 전하 용량을 방전시 거의 다 사용할 수 있게하여 높은 쿨롱 효율을 보이는 것으로 해석된다. 한편, 에너지 효율은 1 C-rate를 제외하고는 두 전해질 모두에서 80%이하의 낮은 효율을 보여준다(그림 10(b)). 에너지 효율이 감소하는 이유는 충전과 방전 사이의 전압차이 때문이다. 그림 9의 정전류충방전 실험에서 보았던 것처럼 충전 곡선의 전위 평탄면(potential plateau)과 방전 곡선의 전위 평탄면 사이의 차이는 분극으로 발생하는 것이다. 즉, 두 전해질에서 높은 C-rate에서의 낮은 에너지 효율은 NiHCF전극에서 분극이 크게 일어났기 때문으로 생각할 수 있다. 추가적으로 NaNO3 전해질에서의 에너지 효율이 Na2SO4 전해질에서의 에너지 효율보다 더 높게 측정되는데, 이는 앞에서 살펴본 것 처럼 NaNO3 전해질과의 계면에서 낮은 전하 전달 저항때문으로 생각할 수 있다.
다른 크기와 형태의 두 음이온(SO4-와 NO3-)을 갖는 전해질에서의 전기화학 실험 결과는 NaNO3 전해질을 사용하였을 때 전극의 에너지 저장 반응이 더 가역적인 것을 보여주었다. 전극의 가역적인 반응은 율속특성에도 영향을 미쳐 NaNO3 전해질에서 우세한 율속 특성이 나타났다. 가역적 특성과 높은 율속 특성의 이유는 전극/전해질 계면의 낮은 계면 저항으로 분석되었다. 따라서 프러시안 블루 구조체인 NiHCF의 낮은 전하 저장 용량을 극복하는 방법으로 전해질 선정이 중요한 인자라는 것이 본 연구의 중요한 의미라 하겠다. 특히 충방전 반응에 직접적으로 참가하지 않는 음이온에 의해서 전극 용량이 의존한다는 사실은 여러 전기화학 실험을 통해 확인되었다. 본 실험 결과는 프러시안 블루 구조체를 갖는 다양한 에너지 저장 재료에 적용될 수 있을 것으로 생각된다. 따라서 차후에는 프러시안 구조체내에 니켈이 아닌 다른 전이금속(Mn, Fe, Co, Cu, Zn)이 사용되었을 때에도 음이온에 따라 전기화학 거동이 변화하는 지 살피는 연구가 필요할 것이다.
4. 결 론
본 연구에서는 수계 소듐 이온 배터리용 양극 활물질로서 수명 안정성이 뛰어난 헥사사이아노철산 니켈(Nickel hexacyanoferrate, NiHCF)을 공침법으로 합성하였고 전극으로서 에너지 저장 밀도 향상을 위해 최적 소듐 이온 전해질을 찾고자 하였다. 합성된 NiHCF는 불규칙한 크기의 입자들이 응집한 형태였으며 메조 기공(2 nm<d<50 nm)을 갖는 다공성 표면이 형성되었다. 결정학적으로 완전한 결정을 갖는 NiHCF에서의 원소간 비율(Ni:Fe=1:1)과 다소 다른 원자 비율(Ni:Fe=1.44:1)을 보여주었다. 불완전 결정의 이유는 Fe자리에 배위 결합된 물(coordinating water)과 제올라이트형 물 분자(zeolitic water)로 인하여 Ni에 비하여 상대적으로 적은 양의 Fe로 NiHCF가 구성되었기 때문이다.
전해질내 음이온이 NiHCF전극의 에너지 저장 거동에 미치는 영향을 살펴본 살펴보기 위하여 크기와 구조가 다른 SO4-와 NO3-을 포함하는 전해질에서 전기화학 거동이 분석되었다. 동일한 산화/환원 포텐셜(0.58 V vs. NHE)값이 두 전해질에서 측정되었으나, NaNO3전해질의 경우 Na2SO4전해질에 비하여 더 낮은 분극이 측정되었다. 분극의 주요한 발생 원인은 전극/전해질 계면에서의 전하 전달 저항 때문으로 생각되며, 낮은 분극 덕분에 NaNO3 전해질에서 더 높은 비전기용량(1 C-rate 에서 57 mAh g-1)과 높은 율속 특성(20 C-rate에서 초기 용량의 46.6% 보존율)을 보여주었다. 결론적으로 수계 전해질내에 존재하는 음이온은 소듐이온이 NiHCF전극으로 삽입/탈리 반응에 영향을 미치며 그에 따라 전하 저장 용량과 율속 특성에 영향을 미친다는 것을 확인하였다.