1. 서 론
팔라듐은 백금, 로듐, 루테늄, 이리듐, 오스뮴과 함께 백금족 원소로 불리며, 백금족 중에서 녹는점과 밀도가 가장 낮다. 백금족의 전세계 매장량은 7만 톤에 불과한 것으로 알려져 있으며, 주로 남아공(89.9%), 러시아(5.6%), 짐바브웨(1.7%) 및 미국(1.3%)에 집중되어 있다 [1]. 팔라듐은 우수한 촉매능력으로 인해 전세계 소비량의 절반 이상이 자동차 촉매변환기에 사용되고 있으며 [2,3], 기타 도금, 보석, 치과재료 및 각종 전자장비에 사용된다 [4]. 팔라듐의 수요는 꾸준히 증가하고 있는 반면, 팔라듐의 생산량은 2006년을 기점으로 점점 감소하는 추세이다 [5]. 따라서 수요에 비해 부족한 팔라듐을 원활히 공급하기 위해 2차자원에서 팔라듐을 회수하기 위한 연구가 활발히 진행되고 있으며, 회수된 팔라듐을 통해 수요의 약 33% 가량을 공급하고 있다 [5]. 특히, 차량용 촉매에는 평균 0.1~0.3%의 백금족 원소가 함유되어 있어 우수한 도시광산자원으로 불리며, 이는 천연 광석과 비교해 적게는 수백 배에서 많게는 수천 배에 달하는 양이다 [1]. 따라서 차량용 폐촉매에 함유된 팔라듐을 회수하기 위한 연구는 활발히 진행되고 있다 [6,7]. 그러나 팔라듐이 미량 포함된 도금폐액과 같은 2차 자원에 대한 연구는 부족한 실정이다. 팔라듐의 가격이 금보다 비싸고 지각에 희소한 만큼 2차자원에 함유된 미량의 팔라듐을 회수하기 위한 연구는 반드시 필요하다.
도금폐액에 존재하는 미량의 팔라듐은 일반적으로 치환을 통해 농축시키며, 아연으로 치환시 내부의 아연금속을 팔라듐이 둘러싼 형태로 환원된다. 이로 인해 치환물을 진한 염산 용액으로 수회 세척한 후에도 미량의 아연이 팔라듐 금속 내부에 잔존하므로, 두 금속을 분리해 고순도의 팔라듐 금속을 회수하기 위해서는 치환물을 완전히 침출시키는 과정이 필요하다. 따라서 선행 연구에서 염산용액에 산화제로 과산화수소를 첨가해 팔라듐과 아연금속 혼합물의 침출조건을 조사했다 [8].
본 연구에서는 도금폐액에 함유된 팔라듐을 아연으로 환원시킨 치환물의 염산 침출액에서 용매추출로 팔라듐(II)과 아연(II)을 분리하기 위한 연구를 수행했다. 먼저, 합성용액을 제조해 팔라듐(II)을 추출하는 것으로 알려진 상용화 추출제(LIX 63, Cyanex 301, DOS, TBP, Alamine 308, Alamine 336, Aliquat 336)로 산농도 변화에 따른 팔라듐(II)과 아연(II)의 추출거동을 조사했다 [9-13]. 그런 다음, 팔라듐 치환물의 실제 침출조건인 7 M 염산용액에서 팔라듐(II)에 대해 선택성이 뛰어난 LIX 63, Cyanex 301, DOS의 농도를 변화시켜 팔라듐(II)과 아연(II)의 분리를 위한 최적조건을 구했다. 한편, 팔라듐(II)과 미량의 아연(II)을 동시에 추출한 LIX 63에 대해 다단추출 실험을 수행했다. 또한 탈거제로 염산 및 산화제의 혼합용액과 왕수를 사용해서 Cyanex 301에 추출된 팔라듐(II)의 탈거거동을 조사하였다. 본 연구에서 얻은 추출과 탈거의 최적조건을 통해 팔라듐 치환물로부터 고순도 팔라듐(II)용액을 회수할 수 있는 습식공정을 제안하였다.
2. 실험재료 및 실험방법
2.1 실험재료
염산용액에서 용매추출에 의한 팔라듐(II)과 아연(II)의 추출거동을 조사하기 위해 염화팔라듐 (PdCl2, Alfa Aldrich, 99.9%)과 염화아연(ZnCl2, Duksan Co., 99%)을 증류수에 용해시켜 두 금속이 혼합된 용액을 준비했다. 합성용액에서 금속 농도는 팔라듐(II) 0.1 g/L, 아연(II) 0.5 g/L로 고정했다. 또한 용액의 산도는 염산(HCl, Daejung Co., 35%)으로 조절했다. 산성 추출제로 LIX 63(Daihachi, 70%)과 Cyanex 301(Cytec Inc., 70%)을 사용했고, 중성 추출제로 DOS(Alfa Aesar, 97%)와 TBP(Yakuri Pure Chemical Co., 98%)를 사용했으며, 음이온 추출제로 Alamine 308(BASF Co., 95%), Alamine 336(BASF Co., 95%) 및 Aliquat 336(BASF Co., 93%)을 사용했다. 희석제로 등유(Daejung Chemicals and metals Co., 100%)를 사용했으며, Aliquat 336의 경우 용매추출시 제 3상의 형성을 억제하기 위해 개질제로 10% decaol (Daejung Co., >98%)을 첨가했다. 탈거용액을 제조하기 위해 염산 및 황산(Daejung Co., 95%)용액에 과산화수소(H2O2, Daejung Co., >30%), 차아염소산나트륨(NaClO, Sigma-Aldrich, 10-15%), 염소산나트륨(NaClO3, Daejung Co., >98%), thiourea((NH2)2CS, Daejung Co., >96%)을 첨가했다. 본 연구에 사용된 모든 시약은 분석등급이며, 추출제와 등유는 별도의 정제없이 사용했다.
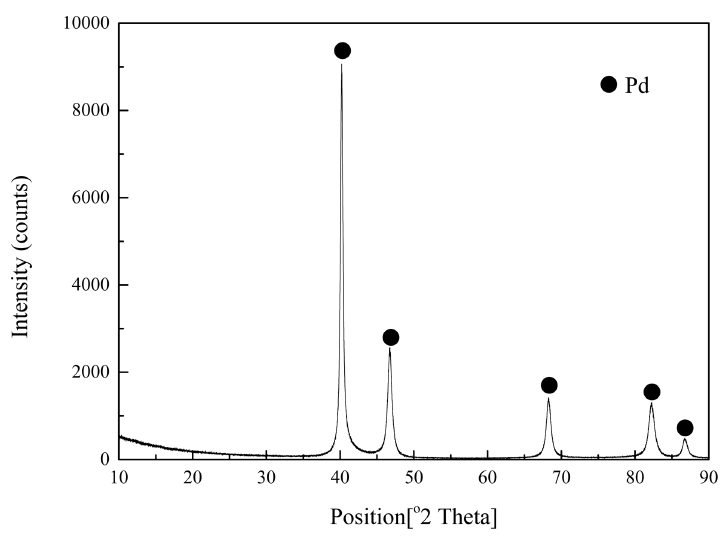
도금폐액에서 아연으로 치환된 팔라듐금속은 국내의 한 업체로부터 제공받았다. 치환된 팔라듐금속은 불순물을 제거하기 위해 진한 염산용액으로 수회 세척했다. 세척된 치환물을 XRD(Empyrean, Panalytical, Netherlands)로 분석한 결과를 그림 1에 나타냈으며, XRD 분석결과 치환물에서 팔라듐만 검출되었다. 그러나 회사에서 제공받은 치환물을 왕수로 침출해 ICP-OES(Arcos, Spectro, Germany)로 분석한 결과 팔라듐(II)과 함께 미량의 아연(II)이 검출됐다. 따라서 팔라듐 치환물을 왕수로 모두 용해시킨 다음, 침출액에서 팔라듐(II)과 아연(II)의 농도를 측정하여 치환물에서 팔라듐과 아연의 함량을 구했다. 광액밀도 2 g/L의 조건에서 치환물이 왕수에 모두 침출되었으며, 침출액에서 팔라듐(II)과 아연(II)의 농도는 각각 1.926 g/L와 0.074 g/L였다. 치환물의 조성을 침출액의 농도로부터 구한 결과 팔라듐 치환물은 96.3%의 팔라듐 금속과 3.7%의 아연금속으로 구성되어 있는 것을 알 수 있었다.
2.2 실험방법
용매추출실험을 통해 팔라듐(II)과 아연(II)의 분리에 효과적인 추출제를 선정하기 위해 합성용액을 제조해 실험했다. 합성용액에서 팔라듐(II)과 아연(II)의 농도는 각각 0.1과 0.5 g/L로 고정했으며, 염산 및 추출제 농도를 변화시켜 금속의 추출거동에 미치는 영향을 조사했다. 한편, 도금폐액에서 아연분말로 치환한 팔라듐의 실제 침출액을 얻기 위해 팔라듐 치환분말을 2 g/L의 광액농도로 60°C의 7M 염산용액에 0.5% H2O2를 첨가해 2시간 동안 침출해서 완전히 용해시켰다 [8].
용매추출 실험은 Burrell wrist action shaker (model 75, USA)를 사용해 일정 부피의 수상 및 유기상을 50 mL 광구병에 넣고 30분간 교반해 수행했으며, 교반후 혼합용액을 분액깔때기에서 30분간 정치하여 수상과 유기상으로 분리했다. 이때 분리한 유기상은 탈거실험에 사용했다. 추출후 수상에 잔존하는 금속농도는 ICP-OES로 측정했고, 유기상에 추출된 금속 농도는 물질수지로 구했다. 금속이온의 추출률과 탈거율을 구하는 식을 다음에 나타냈다.
여기서 mini과 me는 각각 추출 전후 수상에서 금속의 질량을 의미하고, m*ini과 m*e는 탈거 전후 유기상에서 금속의 질량을 나타낸다.
3. 결과 및 고찰
3.1. 추출에 미치는 산 농도의 영향
염산용액에서 팔라듐(II)과 아연(II)의 분리에 효과가 있는 추출제를 조사하기 위해 산성, 중성 및 음이온 추출제를 사용해 두 금속이온의 추출거동을 조사했다. 먼저, 산 농도가 추출률에 미치는 영향을 알아보기 위해 염산농도를 0.5에서 9 M까지 변화시켰고, 이때 추출제 농도는 0.1 M로 고정했다.
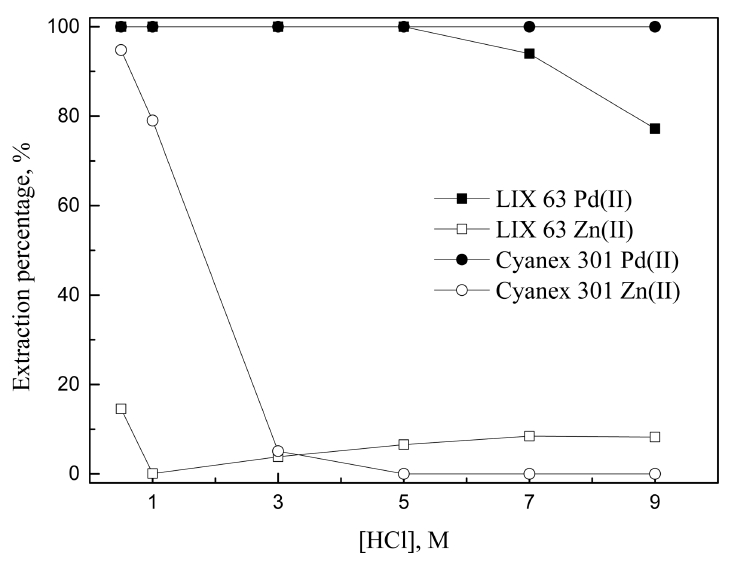
염산농도 0.5에서 9M사이의 범위에서 산성 추출제인 LIX 63과 Cyanex 301에 의한 팔라듐(II)과 아연(II)의 추출 거동을 그림 2에 나타냈다. 염산 5M까지 LIX 63에 팔라듐(II)이 99.9% 이상 추출됐으나, 염산농도가 증가함에 따라 추출률이 감소하여 9M에서는 77.2% 추출됐다. 염산용액에서 팔라듐(II)은 염소이온과 착물을 형성하며 염산농도가 0.1 M이상인 용액에서 대부분 PdCl42-로 존재한다 [14]. 팔라듐 (II)을 LIX 63으로 추출시 염산농도 0.1 M 이하에서는 주화학종인 PdCl3-가 킬레이트 반응기구에 의해 추출되나, 1 M 이상의 염산 용액에서는 PdCl42-가 용매화반응에 의해 추출된다고 알려져 있으며 이를 다음 식에 나타냈다 [15].
상기식에서 HA는 LIX 63을 나타낸다.
본 논문에서 염산 농도는 0.5 M 이상이므로 식 (4)에 의해 팔라듐(II)이 추출된다. 염산농도가 증가함에 따라 팔라듐(II)의 추출률이 감소하는 것은 용액내 염소이온농도가 증가하면 식 (4)의 역반응이 일어나기 때문이다 [16]. LIX 63에서 아연(II)의 추출률은 0.5에서 1M로 염산농도가 증가함에 따라 14.5에서 0.1%로 감소했다. 반면 1에서 9M로 산농도가 증가할 때 아연(II)의 추출률은 0.1에서 8.3%로 증가했다. 1 M 이하의 염산용액에서는 Zn2+와 ZnCl+ 이온이 주로 존재하며, 이들 양이온은 이온교환에 의해 LIX 63에 추출될 수 있다. 염산 농도가 1 M 이상인 경우, 아연은 ZnCl2, ZnCl3-, ZnCl42-와 같은 착물로 존재하며 식(4)와 같은 용매화반응에 의해 LIX 63에 추출될 수 있다.
0.1 M의 Cyanex 301은 염산농도에 관계없이 팔라듐(II)을 완전히 추출했으며, 낮은 산농도에서는 아연(II)의 추출률이 94.8%로 높았으나 염산농도 3 M 이상에서 5.1% 이하로 급격히 감소하는 경향을 보였다. Cyanex 301에서 팔라듐(II)의 추출은 HSAB(Hard Soft Acid Base) 원리로 설명이 가능하다. Cyanex 301의 S는 무른 염기이므로 무른 산인 팔라듐(II)과 결합하려는 경향이 강하다 [17]. 이에 반해 아연(II)은 경계산으로 팔라듐(II)에 비해 결합력이 작다 [18]. Cyanex 301에 의한 팔라듐(II)과 아연(II)의 추출 반응은 아직 명확하게 밝혀지지 않았다 [19,20].
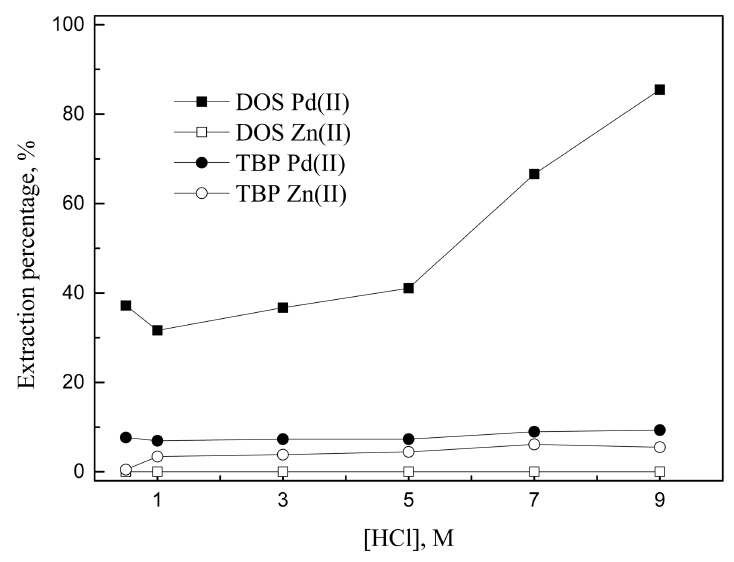
중성추출제인 DOS와 TBP에 의한 팔라듐(II)과 아연(II)의 추출거동을 그림 3에 나타냈다. 그림 3에서 DOS는 팔라듐(II)에 대해 높은 선택성을 보였으며, 염산 농도가 0.5 에서 9M로 증가함에 따라 팔라듐(II)의 추출률이 37.2에서 85.5%로 증가했다. 식 (5)에 DOS(R2S)에 의한 팔라듐(II)의 추출반응을 나타냈다.
그림 3에서 산 농도가 증가함에 따라 팔라듐의 추출률이 증가하는 것은 위 반응식과 잘 일치한다. 일반적으로 DOS에 의한 팔라듐(II) 추출반응은 속도가 느려 평형까지 수시간이 소요된다고 알려져 있다 [1]. DOS에 의한 팔라듐(II)의 추출속도를 높이기 위해 4차 암모늄염을 촉매로 첨가하면 Pd(II)에 대한 선택성이 감소한다고 보고되었다 [1,21]. 본 연구에서는 다른 추출제와 추출특성을 비교하기 위해 반응시간을 30분으로 고정했다. 따라서 DOS로 추출 시 팔라듐(II)의 추출률에 다소 변화가 있었으며, 그림 3에서 DOS에 의한 팔라듐(II) 및 아연(II)의 추출자료는 3회 실험을 통해 얻은 평균값이다. 한편 그림 3에서 염산농도와 무관하게 TBP를 사용시 팔라듐(II)과 아연(II)의 추출률은 매우 낮았다.
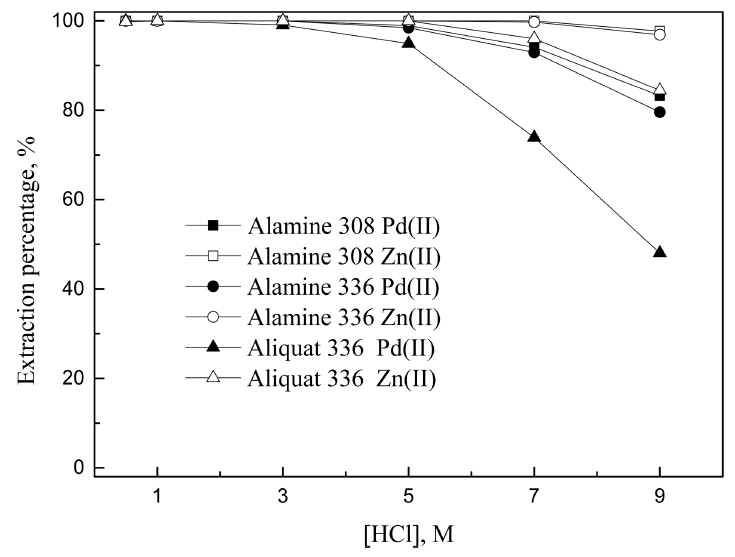
음이온 추출제인 Alamine 308, Alamine 336, Aliquat 336에 의한 Pd(II) 및 Zn(II)의 추출거동을 그림 4에 나타냈다. 3차 아민은 염산에 의해 수소화된 다음 음이온 추출제로 작용하며, 이를 식 (6)과 (7)에 나타냈다 [9,22]. 한편 4차아민인 Aliquat336에 의한 팔라듐(II)의 추출반응을 식(8)에 나타냈다 [15,23].
상기 식에서 R3N은 3차 아민을, R4NCl은 4차 아민을 나타낸다.
식 (7)과 (8)을 보면 3차와 4차 아민으로 팔라듐(II)을 추출하면 염소이온이 이온교환되는 것을 알 수 있다. 즉, 염산 농도가 증가하면 팔라듐(II)의 추출률이 감소하며, 이는 그림 4의 결과와 잘 일치한다. 본 실험결과 3차 아민으로 추출시 4차 아민인 Aliquat336보다 염산농도의 영향을 적게 받는데, 이는 3차 아민이 염산과 결합한 다음 팔라듐(II)을 추출하기 때문으로 판단된다. 전반적으로 3차 또는 4차 아민 추출제는 낮은 산 농도에서는 팔라듐(II)과 아연(II)을 모두 추출하며, 7 M 이상의 진한 염산용액에서는 아연(II)의 추출률이 팔라듐(II)보다 높았다. 그러나 본 논문에서 사용한 양이 온추출제나 중성추출제에 비해 팔라듐(II)과 아연(II)의 분리성을 나타내는 분리인자 측면에서 효과가 작았다.
3.2. 추출에 미치는 추출제 농도의 영향
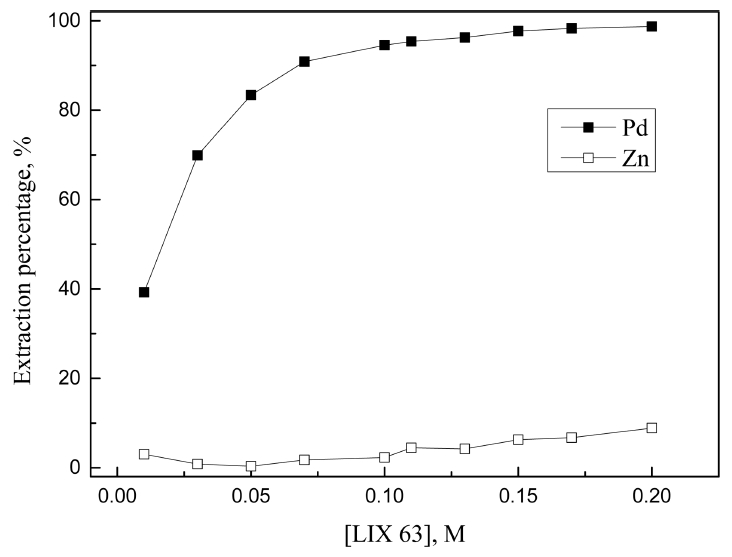
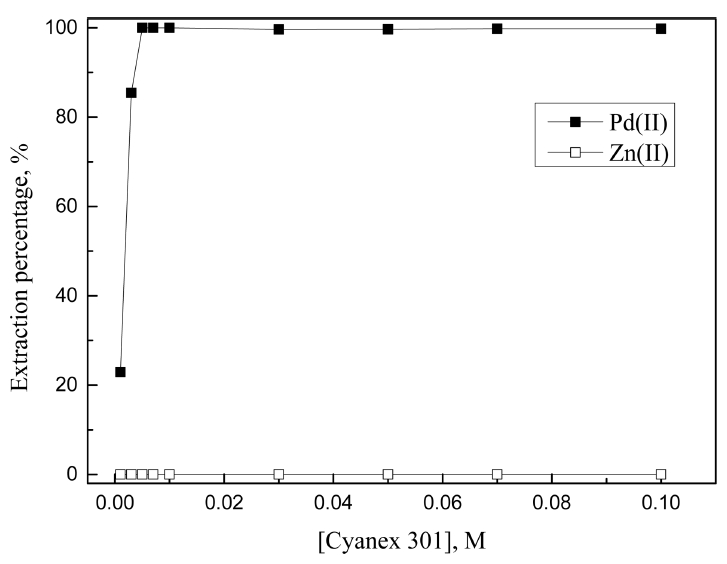
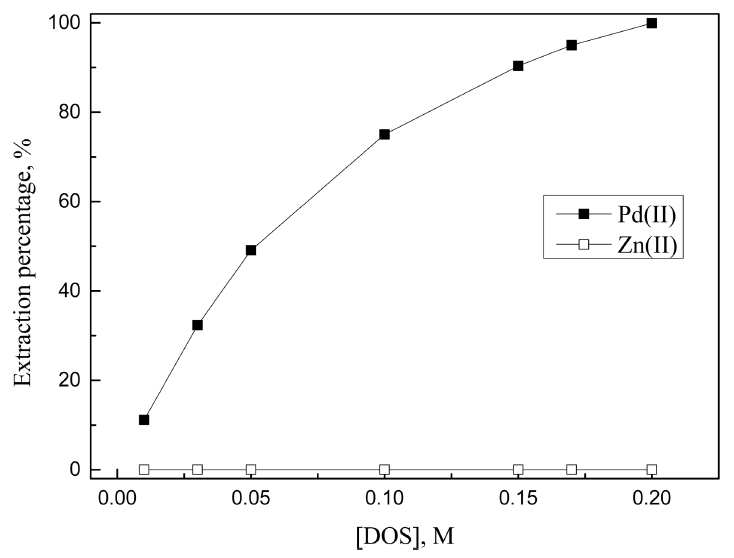
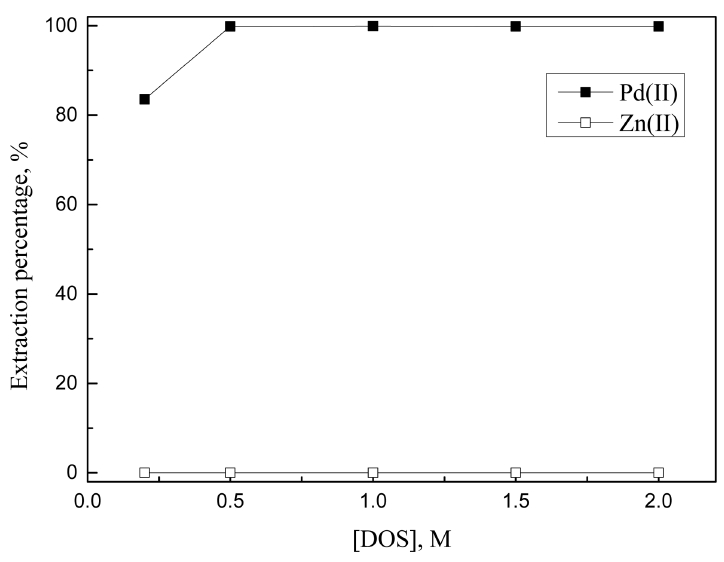
3.1. 절에서 진한 염산농도에서 LIX 63, Cyanex 301, DOS에 의한 Pd(II)와 Zn(II)의 분리가능성을 확인했다. 도금폐액에서 아연분말로 치환된 팔라듐 금속을 완전히 침출하기 위해서는 7 M 이상의 염산용액이 필요하다 [8]. 따라서 7 M 염산용액에서 분리가능성이 있는 상기 세 추출제 농도를 0.001에서 최대 0.2 M까지 변화시켜 합성용액으로 추가실험을 수행한 결과를 그림 5, 6, 7에 나타냈다.
LIX 63에서 추출제 농도가 0.01에서 0.2 M로 증가함에 따라 팔라듐(II)의 추출률은 39.2에서 98.7%로 증가했고, 아연(II)의 추출률 역시 3.0에서 8.9%로 약간 증가했다. 7 M의 염산용액에서 LIX 63은 팔라듐(II)에 대한 선택성이 높았으나 모든 조건에서 미량의 아연(II)을 동시에 추출했다. 따라서 팔라듐(II)의 추출률이 높은 0.2 M LIX 63을 최적조건으로 선택했으며, 이 때 팔라듐(II)과 아연(II)의 추출률은 각각 98.7과 8.9%였다. Cyanex 301의 경우 추출제 농도에 관계없이 팔라듐(II)만을 선택적으로 추출했으며, 추출제 농도가 0.001에서 0.005 M로 증가함에 따라 추출률이 22.9에서 99.9%로 증가했다. 또한 0.005 M 이상에서 팔라듐(II)이 완전히 추출되므로, 최적조건을 0.005 M Cyanex 301로 결정했다. DOS는 Cyanex 301과 마찬가지로 추출제 농도에 관계없이 팔라듐(II)을 선택적으로 추출했는데, 추출제 농도가 0.01에서 0.2 M로 증가함에 따라 팔라듐(II)의 추출률이 11.1에서 99.9%까지 증가했다. 7 M 염산용액에서 팔라듐(II)을 완전히 추출하기 위해 0.2 M의 LIX 63과 DOS, 0.005 M의 Cyanex 301이 필요했으며, LIX 63은 8.9%의 아연(II)을 함께 추출했다.
3.3. LIX 63, Cyanex 301 및 DOS용액으로부터 탈거
LIX 63, Cyanex 301 및 DOS에 추출된 Pd(II)와 Zn(II)을 탈거하기 위해 무기산에 산화제 또는 thiourea 등을 첨가해 탈거용액을 제조해서 탈거실험한 결과를 표 1에 나타냈다. 7 M 염산용액에서 0.2 M의 LIX 63은 98.7%(98.7 mg/L) 팔라듐(II)과 8.9%(44.5 mg/L) 아연(II)을 추출했다. 0.005 M Cyanex 301과 0.2 M DOS는 팔라듐만(II)을 99.9% 이상 선택적으로 추출해 유기상에서 팔라듐(II)의 농도는 99.9 mg/L 이상이었다. 탈거실험결과 염산 또는 황산의 단일 무기산 용액으로는 모든 유기상에서 팔라듐(II)의 탈거가 어려웠으며, 0.2 M LIX 63에서만 약 17.4%의 아연(II)을 탈거할 수 있었다. 산화제 H2O2, NaClO, NaClO3와 염산의 합성용액은 LIX 63에서 아연(II)을, Cyanex 301에서는 팔라듐(II)을 90% 이상 효과적으로 탈거했다. 그러나 황산과 산화제의 혼합용액은 대부분의 추출제에서 팔라듐(II) 및 아연(II)의 탈거율이 1% 미만이었으며, 오직 5 M H2SO4과 NaClO 혼합용액으로 Cyanex 301에서 90.7% 이상 팔라듐(II)을 탈거할 수 있었다. 이와 반대로 thiourea와 염산 혼합용액은 Cyanex 301을 제외한 나머지 추출제에 대해 효과가 있었다. Thiourea는 무른 성질을 가지고 있으며, 분자에 있는 S와 N과 같은 2개의 공여 원자로 인해 팔라듐(II)과 강한 착물을 형성할 수 있다 [1,24]. 그러나 S 원자를 포함하고 있는 Cyanex 301의 작용기는 무른 염기이므로 thiourea 혼합물로는 탈거가 어려울 것으로 생각된다. 0.5 M의 염산과 0.5 M thiourea의 혼합용액을 사용해 LIX 63과 DOS로부터 각각 94,7%, 99.2%의 팔라듐(II)을 효과적으로 탈거했다. 단, LIX 63에서는 팔라듐(II)뿐만 아니라 아연(II)도 모두 탈거되었다.
일반적으로 Cyanex 301에서 팔라듐(II)을 탈거하기 위해 왕수를 사용한다 [9]. 그러나 왕수는 환경적인 문제로 실제 산업현장에서 기피한다. 따라서 왕수의 대체 탈거액으로 염산과 NaClO 및 NaClO3 혼합용액을 사용해 추가실험을 수행했다. 사전실험을 통해 NaClO 및 NaClO3를 첨가한 염산 용액에서 염산농도를 5 M 이상으로 증가시키더라도 팔라듐(II)의 탈거에 미치는 영향이 매우 작은 것을 확인했다. 따라서 혼합용액에서 염산농도는 5M로 고정시켰으며, NaClO와 NaClO3의 농도를 0.1에서 2(NaClO-%, NaClO3-g/L)까지 변화시켰다. 탈거액에서 산화제 농도에 따른 0.005 M Cyanex 301에 추출된 팔라듐(II)의 탈거율을 그림 8에 나타냈다. 5 M 염산용액에서 NaClO의 농도가 0.5%인 경우 99% 이상 팔라듐(II)이 탈거되었으며, NaClO3로 팔라듐(II)을 완전히 탈거하기 위해서는 1 g/L 이상이 필요했다.
3.4. 실제 치환된 팔라듐 금속 침출액으로부터 용매추출에 의한 분리
3.4.1. 추출
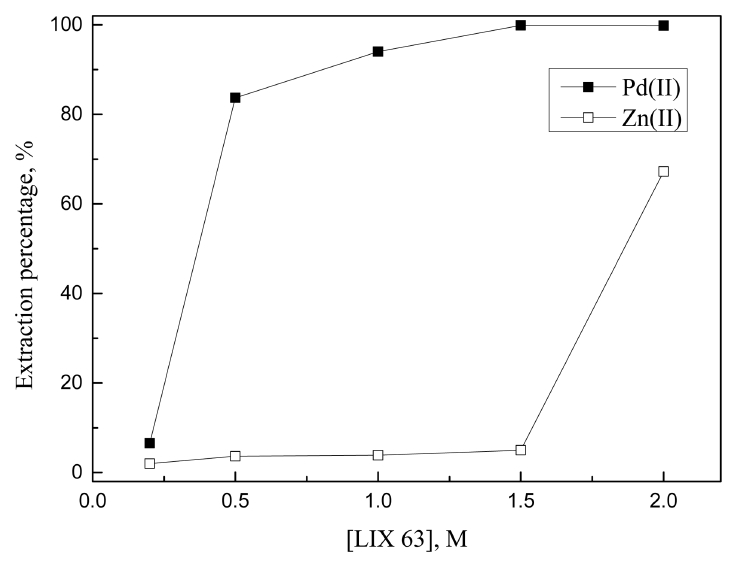
합성용액에서 얻은 최적 추출조건을 바탕으로 실제 치환된 팔라듐의 염산침출액에서 용매추출 실험을 수행했다. 실제 침출용액은 60°C의 7 M 염산용액에 2 g/L의 광액밀도 조건으로 치환된 팔라듐 분말을 첨가한 뒤 0.5% H2O2를 넣고 2시간 동안 반응시켜 얻었다 [8]. 실제 침출용액에서 팔라듐(II)과 아연(II)의 농도는 각각 1.926과 0.074 g/L였다. 침출액에서 아연(II)의 농도가 미량인 것은 아연분말로 치환시킨 팔라듐 금속분말의 불순물 제거를 위해 염산용액으로 수회 세척하는 과정에서 아연이 용해되어 제거됐기 때문이다. 합성용액에서 팔라듐(II)과 아연(II)을 효과적으로 분리했던 LIX 63, Cyanex 301, DOS에 대해 추출제 농도를 변화시켜 실제 침출액에서 용매추출실험을 수행했고, 결과를 그림 9, 10, 11에 나타냈다. LIX 63의 농도가 1.5 M 이상인 조건에서 팔라듐(II)은 99.9% 이상 추출됐으며, 2.0 M LIX 63에서 아연(II)의 추출률은 67.3%로 급격히 증가했다. 따라서 두 금속을 분리하기 위해서는 LIX 63의 농도를 1.5 M 미만으로 유지하는 것이 유리하다. Cyanex 301과 DOS에서는 팔라듐(II)이 선택적으로 추출되었는데, 실제 침출액에서 팔라듐(II)을 완전히 추출하기 위해서는 각각 0.1과 0.5 M 농도 이상의 추출제가 필요했다. Cyanex 301과 DOS 모두 실제 침출액에서 팔라듐(II)을 완전히 추출했으나 DOS의 경우 긴 추출반응시간과 가격이 비싼 단점으로 인해 LIX63과 Cyanex 301을 사용해서 추가실험을 진행했다.
3.4.2. 다단식 추출
Cyanex 301은 팔라듐(II)만을 선택적으로 추출했으나 LIX 63에 비해 탈거가 어려운 단점이 있다. 따라서 LIX 63으로 미량의 아연(II)을 분리하는 것이 가능하다면 추출과 탈거 특성을 고려시 LIX 63이 실제 산업현장에 적용하기에 적합하다. 실제 침출액에서 LIX63으로 용매추출시 팔라듐(II)과 아연(II)의 추출률에는 큰 차이가 있다. 이와 같이 두 금속간 추출률에 큰 차이가 존재하는 경우 낮은 농도의 추출제로 다단식 용매추출을 통해 두 금속을 분리하는 것이 가능하다. 따라서 실제 침출액에서 팔라듐(II)과 아연(II)을 LIX63으로 분리할 목적으로 0.5 M의 LIX 63을 추출제로 2단의 다단식추출 실험했고, 결과를 표 2에 나타냈다. 실험결과 최종적으로 99% 팔라듐(II)과 28% 아연(II)이 추출되어 2단의 추출로도 두 금속의 분리가 어려웠다. 따라서 7M의 염산용액에서 팔라듐(II)의 추출에 선택성을 보인 LIX 63, DOS, Cyanex 301 중 Cyanex 301을 선택해서 탈거실험을 진행했다.
3.4.3. 탈거
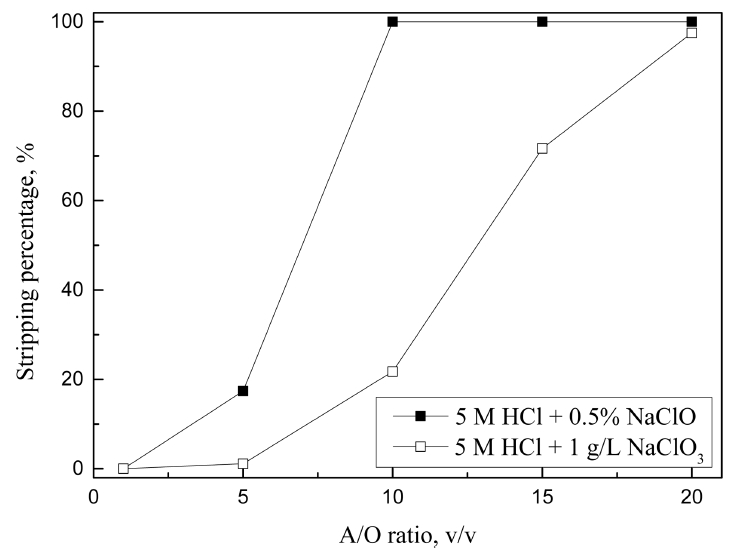
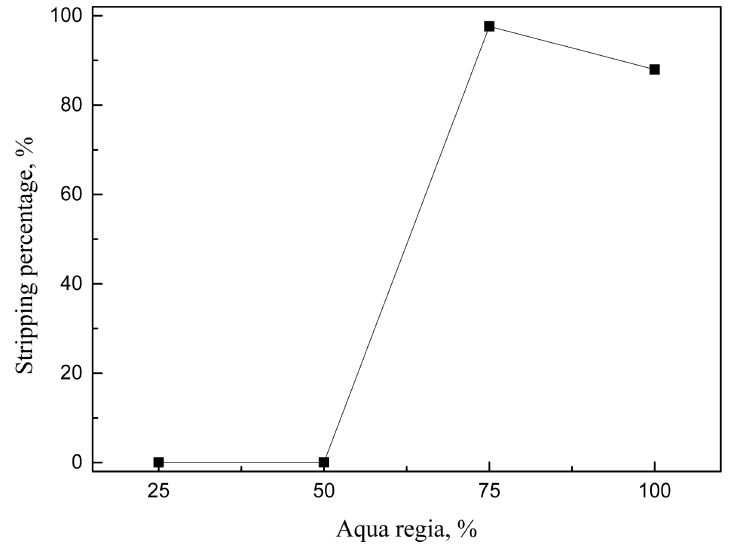
Cyanex 301은 팔라듐(II)만을 선택적으로 추출하므로 유기상에서 팔라듐(II)을 탈거하면 고순도 팔라듐용액을 제조 할 수 있다. 표 1을 보면 Cyanex 301에 추출된 팔라듐(II)의 탈거액으로 5M의 염산용액에서 NaClO나 NaClO3를 첨가한 혼합용액이 효과가 있었다. 그러나 상기 조성의 혼합용액을 실제 침출액에서 팔라듐(II)이 추출된 Cyanex 301에 탈거액으로 사용시 팔라듐(II)의 탈거율은 5% 미만이었다. 이는 실제 침출용액에서 팔라듐(II)의 농도가 1.926 g/L로, 합성용액과 비교해 농도가 19배 이상 높기 때문이다. 실제 침출액을 대상으로 Cyanex 301에 추출된 팔라듐(II)을 탈거하기 위해 상기 조성의 탈거액을 사용시 탈거액에서 팔라듐(II)의 농도는 96.3 mg/L(탈거율이 5%)이다. 즉, 탈거액에서 팔라듐의 농도(II)는 합성용액이나 실제 용액에서 추출된 두 조건의 Cyanex 301에서 비슷하다. 그러므로 실제 침출액을 추출한 Cyanex 301에서 탈거율이 5% 미만인 것은 유기상에서 팔라듐(II)의 높은 농도에 기인한다. 실제 침출액에서 팔라듐(II)을 추출한 유기상의 탈거율을 높이기 위해 탈거액인 수상의 부피를 변화시켜 탈거실험을 수행했고, 그 결과를 그림 12에 나타냈다. 5 M HCl과 0.5% NaClO의 혼합용액의 경우 수상과 유기상의 부피비가 10인 조건과, 5 M HCl과 1 g/L NaClO3 혼합용액에서는 수상과 유기상의 부피비가 20인 조건에서 팔라듐(II)의 탈거율이 각각 99.9%와 97.5%이었다. 그러나 이처럼 탈거를 위해 수상의 부피비를 증가시키면 탈거액중 팔라듐(II)의 농도는 큰 폭으로 감소한다. 한편, 비교를 위해 왕수의 농도를 변화시켜 0.1 M Cyanex 301에서 팔라듐(II)의 탈거율을 조사했고, 실험결과를 그림 13에 나타냈다. 상기 실험에서 수상과 유기상의 부피는 동일하게 유지했고, 왕수농도는 희석을 통해 25, 50, 75, 100%로 조절했다. 75% 왕수를 탈거액으로 사용시 0.1 M Cyanex 301에서 97 %의 팔라듐(II)이 탈거되었다.
도금폐액에서 얻은 실제 팔라듐 치환물을 염산으로 침출한 용액에서 Caynex 301로 추출하면 팔라듐(II)만을 선택적으로 추출하는 것이 가능하다. Cyanex 301에 추출된 팔라듐(II)은 5 M HCl과 0.5% NaClO의 혼합액(A/O=10) 및 75%의 왕수로 탈거할 수 있으며, 탈거액에 환원제를 첨가해 팔라듐 금속으로 회수할 수 있다. 환원제로는 히드라진과 포름산 등이 사용될 수 있는데, 강산 및 산화제가 함유된 용액에서 상기 환원제로 팔라듐을 환원시키기 어려우므로 용액의 pH를 1 이상으로 조절하는 것이 바람직하다. 따라서 탈거후 탈거액에 함유된 팔라듐(II)을 환원시켜 금속으로 회수하는 공정을 감안하면 왕수보다는 염산과 NaClO의 혼합용액이 Cyanex 301에 추출된 팔라듐(II)의 탈거액으로 유리하다.
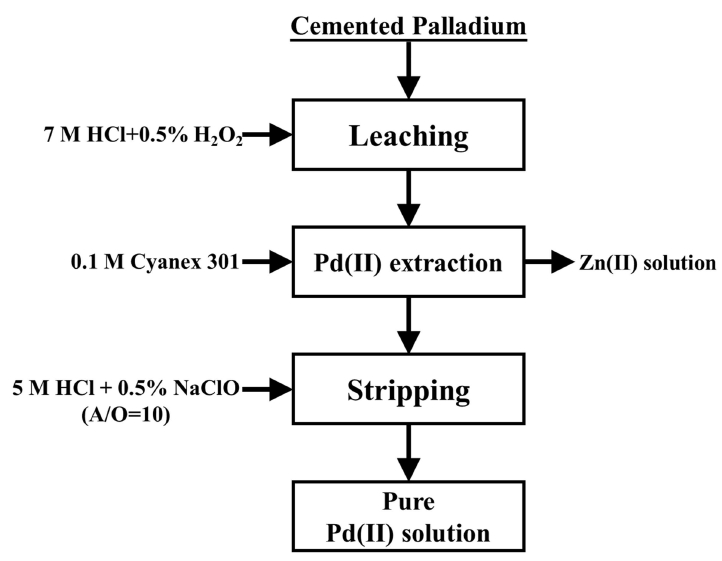
본 연구결과 팔라듐 치환물의 염산침출액에서 추출에 의한 팔라듐(II)과 아연(II)의 분리 및 추출액에서 팔라듐(II)의 탈거에 관한 최적 조건을 구했다. 이와 같이 구한 최적 조건에서 팔라듐 치환물로부터 고순도 팔라듐(II)용액을 회수하기 위한 습식공정도를 그림 14에 나타냈다. 먼저 도금폐액에서 얻은 팔라듐 치환물을 2 g/L 광액농도로 첨가해 7 M 염산과 0.5% H2O2용액에서 60°C로 2시간동안 완전히 침출한다. 이와 같이 얻은 침출액을 0.1 M Cyanex 301로 추출하면 팔라듐(II)이 선택적으로 추출되고 수상에는 아연(II)이 남는다. 팔라듐(II)이 추출된 0.1 M Cyanex 301에서 5 M 염산과 0.5% NaClO 혼합용액을 사용해 수상과 유기상의 부피비가 10인 조건에서 탈거하면 팔라듐(II)을 모두 탈거해 순수한 팔라듐(II) 용액을 회수할 수 있다.
4. 결 론
도금폐액에 함유된 팔라듐(II)을 아연분말로 치환한 팔라듐 치환물에서 고순도 팔라듐(II)용액을 회수하기 위해 침출과 용매추출로 구성된 습식공정에 대해 조사했다. 먼저 팔라듐(II)과 아연(II)이 혼합된 합성 염산용액을 제조하여 염산농도 및 추출제의 종류에 따른 두 금속이온의 분리가능성을 조사했다. 염산농도를 0.5 M에서 9M까지 변화시켜 실험한 결과 산성추출제인 LIX 63과 Cyanex 301 및 중성추출제인 DOS가 실제 침출액과 같은 7 M 염산농도에서 팔라듐(II)을 선택적으로 추출하는 것이 확인되었다. 이에 반해 음이온추출제인 Alamine 308, Alamine336 및 Aliquat 336은 두 금속이온의 분리에 적합하지 않았다.
실제 팔라듐 치환물을 7M의 염산용액으로 침출한 용액에서 LIX 63, Cyanex 301 및 DOS로 추출한 결과 LIX 63에는 팔라듐(II)과 함께 미량의 아연(II)이 추출되었으나, Cyanex 301과 DOS에는 팔라듐(II)만이 추출되어 두 금속 이온을 분리할 수 있었다. 한편, LIX 63에 추출된 아연(II)은 2단의 다단식 추출로도 분리가 어려웠다. 따라서 팔라듐(II)만이 선택적으로 추출된 Cyanex 301에서 75%의 왕수 또는 5 M 염산과 0.5% NaClO 혼합용액으로 수상과 유기상의 부피비를 조절하여 팔라듐(II)을 탈거했고, 97~99% 이상 탈거율을 얻었다. 본 실험결과로부터 실제 공정에서 발생한 팔라듐 치환물로부터 침출과 용매추출로 고순도 팔라듐(II)용액을 회수할 수 있는 습식공정을 개발하였다.