1. 서 론
전자 산업의 발달로 인하여 전자소재의 사용량이 증가하면서 전자스크랩의 발생량도 증가하고 있다. 전자소재의 재료에는 Cu, Ni, Sn, In 등의 금속들뿐만 아니라 Au, Ag, Pd 등의 귀금속도 함유되어 있다 [1-3]. 전자스크랩을 적절하게 처리하지 않고 폐기할 경우 환경오염을 유발할 수 있으며, 귀중한 유가금속이 낭비 될 수 있다 [2,5,20]. 귀금속은 산업소재로서 내식성 및 전기전도도가 뛰어나 주로 집적회로나 도선 등에 사용되며, 전자스크랩에 함유되어 있는 귀금속은 다른 금속에 비해 소량 존재하나 한정적 자원량으로 인해 높은 가치를 가진다. 따라서 이러한 전자스크랩로부터 유가금속을 회수하는 기술이 중요시 되고 있으며, 선진국에서는 전자스크랩으로부터 유가금속을 회수하는 기술이 상용화되어 있으며 다양한 시스템이 구축되어 있다 [3,17]. 국내의 경우, 대부분의 자원을 수입하기 때문에 폐자원으로부터 유가금속을 회수하는 기술을 개발하는 것이 중요하다. 오래전부터 Au, Ag, Pd 등 귀금속류를 회수하기 위해 주로 시안화법이나 왕수법을 주로 사용되어 왔다. 그러나 시안화물로부터 발생하는 시안화물 폐수나 왕수 폐수의 경우 유독하기 때문에 환경오염의 원인이 되어 왔다. 이러한 환경적 문제를 줄이기 위해 티오요소(thiourea) 나 티오황산(thiosulfate) 등의 시안화 대체물질을 사용하여 귀금속을 침출하는 연구가 계속되고 있다 [4,13,15]. 티오요소를 사용할 경우 티오요소가 은과 반응하여 은-티오요소 착이온(Ag(CS(NH2)2)3+)을 형성하여 은의 침출을 용이하게 한다 [6-8,16]. 그러나 침출반응 중 티오요소가 분해되어 소모량이 다소 많아 실용화에 제약이 있는 실정이다. 본 연구에서는 전자스크랩으로부터 환경친화적이고 경제성 있는 은 회수를 위하여 티오요소 침출 및 사이클론 전해채취 공정[9]에 의해 은 회수 공정 개발의 일환으로 먼저 전자스크랩을 티오요소 용액을 사용하여 은 침출에 대한 최적 공정을 도출하고자 티오요소 및 염산 농도, 고액농도비, 온도, 교반속도, 산화제(FeCl3) 첨가효과 등 침출반응에 영향을 미치는 효과를 조사하고자 하였다. 또한 은 뿐만 아니라 전자스크랩에 함유되어 있는 Al, Fe, Ca, Sr, Zn 등의 불순물들의 침출 거동도 조사하였다.
2. 실험 재료 및 방법
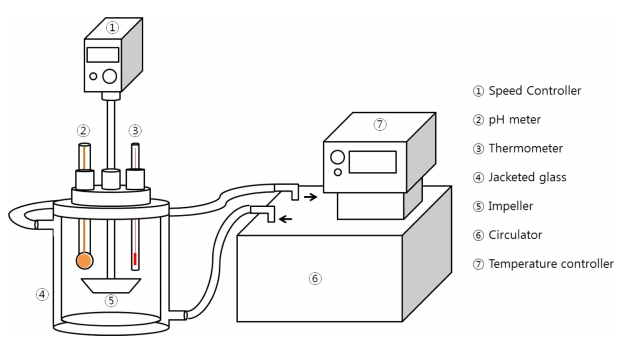
본 연구에서 사용된 원료로는 LTCC(Low Temperature Co-fired Ceramics) 전극 공정부산물(이하 전자스크랩)을 업체로부터 입수하여 평균 입도 20~30 μm의 입도로 파·분쇄하여 사용하였으며, 이에 대한 조성을 표 1에 나타내었다. 침출액으로는 티오요소(samchun Co., 98%)용액에 염산을 소량 첨가하여 사용하였다. 실험온도를 일정하게 유지하기 위해 그림 1과 같이 항온수조와 이중반응조를 설치하였으며, 티오요소 용액에 전자스크랩 분말을 투입하고 상향식 교반기를 사용하여 일정한 속도로 교반하였다. 반응 시작 후 일정시간마다 샘플을 채취하여 희석한 후 ICP-AES(optima-4300DV, perkin-elmer)를 사용하여 용액 중의 금속이온 농도를 측정하였고, pH미터 (orion star A211)를 사용하여 pH값과 산화환원전위(Eh)값을 측정하였다. 분석결과를 토대로 식(1)을 이용하여 시간에 따른 금속이온의 침출율을 계산하였다.
여기서 Mt는 반응시간 t분 후 용액 중의 은 농도(mg/L), M0는 전자스크랩에 함유되어 있는 은 농도(mg/L)를 나타낸다.
3. 결과 및 고찰
3.1. 은-티오요소의 Eh-pH diagram
Marcel Pourbaix에 의해 만들어진 Eh-pH 도표는 화학적으로 안정한 상을 pH와 전위 (potential or Eh)의 관점으로 도시한 것으로, 용액중에 각 성분들의 안정한 영역을 알 수 있기 때문에 금속의 침출 반응 가능성 등을 예측하는데 유용하게 사용할 수 있다. 이에 대한 분석을 하기 위하여 수용액중에서 Eh 및 pH 에 따라 은 과 티오요소와의 가능한 반응식을 세우고, Eh-pH 도표를 작성하여 은과 티오요소와의 안정한 화합물이 생성되는 영역을 확인하고자 하였다. 여기서 은의 농도는 실험에 사용한 농도와 비슷하게 활동도를 10-3으로 계산하였고, 티오요소 농도 역시 실험에 사용된 농도 범위로 하기 위하여 활동도를 각각 100, 10-1로 설정하고 25 ºC에서 Eh-pH diagram을 작성하였는데 이에 대해 그림 2에 나타내었다.
일반적으로 은의 경우 산성용액에서 티오요소에 의해 식 (2)와 같은 안정한 착이온을 형성한다고 알려져 있다 [6,11-12]. 그러나 티오요소가 산성용액에서 산화되어 식(3)과 같이 formamidine disulfide(NH2(NH)CSSC(NH)NH2)라는 1차 분해산물이 생성되며, 티오요소 농도가 더욱 증가하면 식 (4)와 같이 일부 유리황이 생성된다고 알려져 있다 [6,18].
그림 2에서 점선으로 표시한 것은 물의 안정도 영역으로 수소 및 산소 분압을 1기압으로 가정하여 작성하였다. 사선으로 표시한 부분이 은-티오요소 착화합물(Ag(CN(NH2)2)3+)의 안정 영역으로 은을 침출하기 위한 적정 Eh 및 pH값의 범위를 나타낸다. 그림으로부터 은을 침출하기 위한 적정 Eh 값은 0~300 mV 이하, pH값은 4.0 이하인 산성영역이 적절하다는 것을 알 수 있다. 또한 은 농도가 감소하면 은-티오요소 착화합물의 안정하게 존재하는 영역이 다소 넓어지기 때문에 은 침출에 유리하다는 것을 알 수 있다.
3.2. 티오요소에 의한 은 침출 결과
티오요소는 은과 결합하여 Ag(CN(NH2)2)3+ 착이온을 형성하여 전자스크랩에서 은의 용해를 촉진시킨다. 침출액 중 티오요소 농도에 따른 은 침출변화를 알아보기 위해 0.1, 0.3, 0.5, 0.6, 0.8, 1.0 M 티오요소를 0.1 M 염산에 용해하여 35 ºC에서 300 rpm으로 교반하여 침출 실험을 실시하였다. 실험결과 그림 3에서 알 수 있듯이 티오요소의 농도가 증가할수록 은의 침출속도 및 침출율이 증가함을 보였다. 0.1M 티오요소 용액에서는 4시간 경과후에 50%은 침출율을 보였고, 0.8 M의 티오요소 농도에서는 약 98%의 은 침출율을 보였다. 한편 티오요소가 1.0 M에서는 은 침출율이 약간 감소하는 경향을 보이는데 이러한 이유로는 일부 티오요소가 분해되어 (3)식과 같이 formamidine disulfide가 형성되고, 식(4)와 같이 황의 형성으로 인해 부동태막이 생성되어 은의 침출율이 저하되는 것으로 사료되며 이러한 현상은 Kim의 연구결과와도 유사하다 [18]. 표 2는 침출반응 후의 각 금속성분들의 농도(mg/L)를 나타내었다. 은의 경우는 0.8 M 티오요소에서 약 347 mg/L을 나타냈고, 은 이외의 알루미늄, 칼슘, 스트론튬 등의 경우는 침출율은 15% 이하로 낮았으나 수백 mg/L정도 함유되어 있다. 철의 경우는 약 80%의 침출율을 나타내었지만 철의 함유량은 낮아 약 20~30 mg/L 정도를 보였으며 아연의 경우는 80 mg/L 전후의 농도를 나타냈다. 한편, 침출반응 중 pH 및 Eh값을 측정한 결과, 평균적으로 pH는 0.3 이었고, Eh는 300 mV로 일정하여 은-티오요소 착이온이 안정한 영역에 반응이 진행되었다는 것을 확인할 수 있었다.
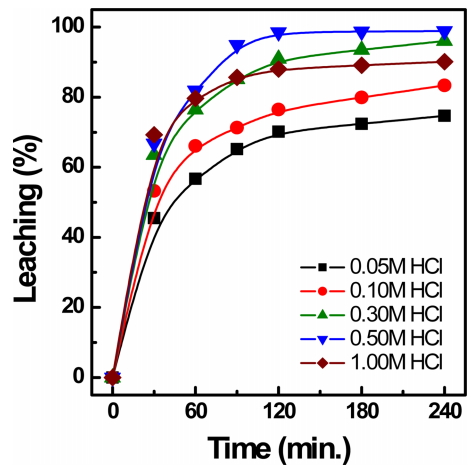
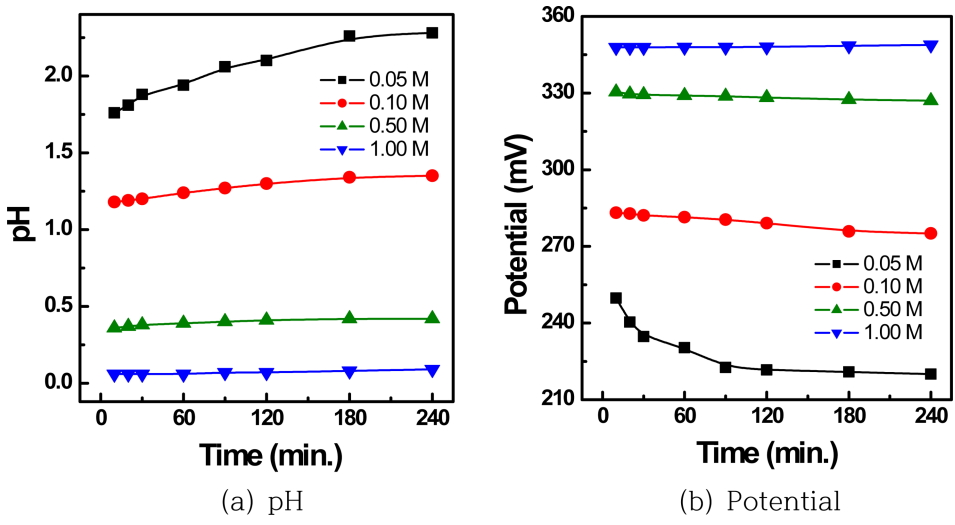
침출액의 산도(pH)가 은 침출에 영향을 미치는지 알아보기 위해 0.5 M 티오요소 용액에 염산용액을 0.05, 0.1, 0.3, 0.5, 1.0 M 첨가하여 산도를 조절한 후 35 ºC에서 300 rpm으로 침출실험을 실시한 결과를 그림 4 및 표 3에 나타내었다. 염산농도를 0.05 M 에서 0.5 M으로 증가시킬 경우 은의 침출속도와 침출율이 증가하였고, 1.0 M 염산농도에서는 은의 침출율이 감소한 경향을 보였는데, 이러한 현상은 염산농도에 대한 시간에 따른 pH와 전위를 측정하여 그림 5에 나타내었으며 적정 농도의 염산에서는 은의 침출율이 향상되지만 과량의 염산이 사용되면 용액의 산화전위가 증가하여 티오요소의 분해반응이 촉진되어 은의 침출율이 감소되기 때문이라 생각된다 [18]. 표 3은 염산농도 변화에 따른 pH와 Eh의 값을 표시하였는데, 염산농도가 증가함에 따라 pH는 감소하나 Eh값은 약간 증가하는 것을 보였다. 기타 은 이외의 불순물 원소들의 침출율에는 큰 변화가 없었다. 따라서 0.5 M 티오요소에 염산 농도는 0.3~0.5M 정도 첨가하여 반응시키는 것이 효과적이다.
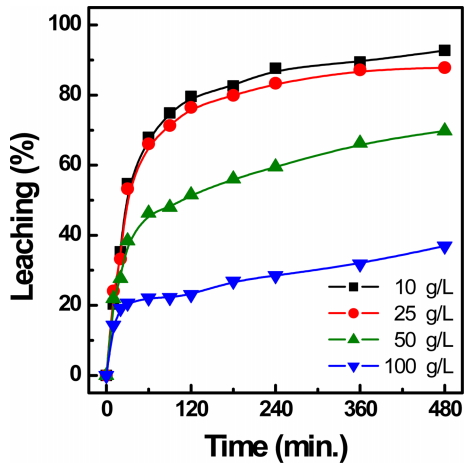
침출액과 전자스크랩의 고액농도비 변화에 따른 은의 침출율 변화를 고찰하기 위해 고액농도비를 10, 25, 50, 100 g/L으로 변화시키면서 반응시간을 480분까지 연장하여 은 침출 거동을 고찰하였는데 이에 대한 결과를 그림 6에 나타내었고, 반응 후 침출액의 금속이온 농도를 표 4에 나타내었다. 침출율은 고액농도비가 증가할수록 감소하는 경향을 보였고, 고액농도비가 10 g/L인 경우 은 침출율이 92%로 가장 높았다. 하지만 전자스크랩에 함유된 은의 함량이 낮아 실제로 침출액중의 은 농도가 134 mg/L로 낮았다. 한편 고액농도비를 50 g/L 이상 증가시킬 경우에는 은의 침출율이 크게 감소하며 100 g/L에서는 8시간 경과해도은 침출율은 36% 정도로 낮았다. 따라서 침출율과 침출액 농도를 고려할 경우에는 고액농도비를 25 g/L 부근으로 유지하여 침출반응을 실시하는 것이 효과적이라는 것을 알 수 있었다.
침출반응 속도를 증가시키기 위해 3가 철(Fe3+)을 산화제로 사용하여 침출효과를 고찰하였다.
그림 7에 산화제(FeCl3) 농도 변화에 따른 영향을 고찰한 결과를 나타내었다. 산화제를 첨가할 경우, 동일 조건에서 산화제를 첨가하지 않았을 때보다 은 침출율이 증가하는 경향을 보이며, 7.0 당량 첨가 시 240분 침출 후 약 90%의 은 침출율을 나타내었다. 산화제인 3가 철이 존재할 경우에는 다음 식(11)과 같은 반응에 의해 은 침출율이 증가할 수 있다 [10].
그러나 산화제 농도가 10.0 당량에서는 오히려 은의 침출율이 감소하는 경향을 보였는데, 이러한 이유로는 산화제 농도가 과량으로 존재할 경우에는 식(3) 및 (4)와 같이 산성용액 중에서 티오요소가 분해되어 생성된 분해산물인 formamidine disulfide가 산화되어 부동태인 유리황이 생성되어 은의 침출을 방해한다고 보고되어 있다 [6,11]. 따라서 산화제(FeCl3) 농도는 7.0 당량 이하로 첨가하는 것이 바람직하다. 표 5에는 산화제 첨가 영향에 대한 반응 후 침출액 중 금속이온들의 농도를 나타내었는데, 철을 제외한 불순물의 침출율은 17% 이하로 나타났다.
침출반응에서 교반속도 영향을 고찰하기 위해 교반속도를 200, 300, 400, 500, 600 rpm으로 변화시키면서 침출 실험을 실시하여 그 결과를 그림 8에 나타내었다 [14]. 교반속도가 증가할수록 침출액의 물질전달 속도를 증가시켜 은의 침출율 및 침출속도가 증가하는 경향을 보였고, 500 rpm에서는 2시간 후에 95%의 높은 침출율을 보였고 600 rpm에서는 더 이상 증가현상은 보이지 않았다. 표 6은 침출반응 후의 침출액 중 금속이온들을 농도를 나타내었으며, 철을 제외한 불순물들은 16% 이하로 큰 변화를 보이지는 않았다. 교반속도 변화에 따라 pH와 Eh를 측정한 결과, pH의 경우는 0.96~1.01 값을 나타냈고, Eh의 경우는 291 mV로 측정이 되어 은-티오요소 착이온이 안정한 것을 확인하였다. 따라서 교반속도의 증가로 인해 용액 중 은-티오요소 반응이 활발히 일어나 은의 침출율이 증가함을 도출하였다.
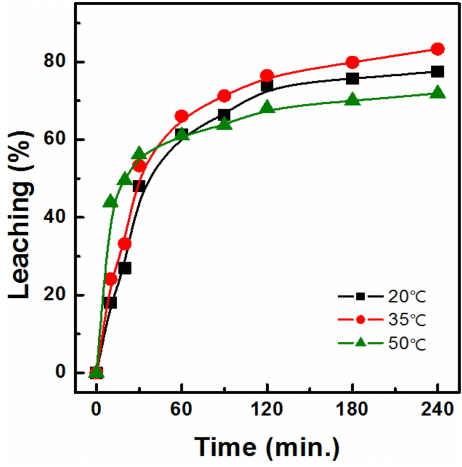
침출반응 온도 영향을 고찰하기 위해 20, 35, 50 ºC로 변화시키면서 침출실험한 결과를 그림 9에 나타내었다. 그림에서 온도가 20 ºC로 감소할 경우 은의 침출율이 감소하는 경향을 보였으며, 온도 50 ºC에서는 실험시간 30분까지 급격한 침출율을 보였으나 60분 후부터 침출율의 증가폭이 현저히 감소하는 결과가 나타났다. 따라서 온도가 50 ºC 이상일 때 티오요소와 formamaidine disulfide가 분해되어 콜로이드상 황의 형성으로 은-티오요소 착이온 형성이 감소하며 이로 인하여 은 침출율이 감소되는 것으로 생각되며 이러한 현상은 Kim등의 연구결과와도 일치한다 [6]. 온도변화에 따라 침출 반응중의 pH와 Eh를 측정한 결과, pH는 1.26~1.46, Eh는 265~277 mV 이었다. 따라서 침출 반응온도는 35 ºC 부근이 효과적임을 알 수 있었다. 표 7에는 온도 변화에 따른 침출반응 후의 금속이온들의 농도를 나타내었는데, 철을 제외한 불순물의 침출율은 16% 이하로 큰 변화는 없었다.
4. 결 론
본 연구에서는 산성용액 중 티오요소를 사용하여 전자스크랩에 함유한 은을 침출하기 위해 티오요소 농도, 염산농도, 고액농도비, 산화제 농도, 교반속도, 온도에 대한 실험결과 다음과 같은 결론을 얻을 수 있었다.
1) 티오요소 농도가 0.8 M까지 증가할수록 은의 침출율과 침출속도가 증가하는 것을 보였으나, 티오요소 농도가 1.0M으로 증가하게 되면 티오요소의 분해반응으로 침출율이 더 이상 증가하지 않아 티오요소 농도는 0.8M 정도가 적절하였다.
2) 염산 농도를 0.5 M까지 증가시킬 경우 은 침출율이 증가하지만, 염산농도를 1.0 M 이상으로 증가할 경우 티오요소의 분해가 발생하며 은의 침출율이 감소하기 때문에 염산농도는 0.5 M 이하가 적절하였다.
3) 고액농도비가 증가할수록 은 침출율은 감소하였고, 10 g/L일 때 침출율이 가장 높았지만 50 g/L 이상에서는 티오요소의 양이 충분하지 않아 침출율이 감소되어 효율적인 은 침출효율을 위해서 고액농도비는 25 g/L가 적절하다는 것을 알 수 있었다.
4) 산화제인 FeCl3를 7.0 당량까지 첨가시 은 침출율이 증가하지만 10.0 당량 첨가시에는 용액 중 다량의 산화제로 인해 티오요소의 분해반응이 촉진되어 은의 침출율이 감소하는 경향을 보였다.
5) 침출액 교반속도가 증가할수록 침출율 및 침출속도가 증가하는 경향을 보였고, 500 rpm에서 약 95 %의 은 침출이 가능하였다.
6) 침출반응 온도가 50 ºC 이상 증가할 경우에는 용액 중 티오요소 분해반응이 촉진되어 은 침출 율이 감소되기 때문에 반응온도는 35 ºC 부근이 적절하다는 것을 알 수 있었다.
7) 상기결과들로부터 전자스크랩 고액농도비 25 g/L, 0.8 M 티오요소, 0.5M 염산, 온도 35 ºC, 산화제 7.0 당 량, 교반속도 500 rpm의 조건으로 4시간 침출시킨 결과, 약 99% 이상의 은 성분을 침출할 수 있었고 철의 침출율의 경우 약 60%, 기타 칼슘, 알루미늄, 스트론튬, 아연 의 경우는 16% 이하의 침출율을 보였다.