1. ņä£ ļĪĀ
ļ”¼ĒŖ¼ņØ┤ņ░©ņĀäņ¦ĆņØś ņé¼ņÜ®ņ£╝ļĪ£ ņØĖĒĢ┤ ļŗłņ╝łĻ│äņĀäņ¦ĆņØś ņłśņÜöļŖö ņ¦ĆņåŹņĀüņ£╝ļĪ£ Ļ░ÉņåīĒĢśĻ│Ā ņ׳ņ£╝ļéś ņĢäņ¦üĻ╣īņ¦ĆļÅä ļ¦ÄņØĆ ņ¢æņØś ļŗłņ╝łĻ│äņĀäņ¦ĆĻ░Ć ņāØņé░ļÉśĻ│Ā, ĒÅÉĻĖ░ļ¼╝ļĪ£ ļ░£ņāØĒĢśĻ│Ā ņ׳ļŗż. 2015ļģä ņé░ņŚģĒåĄņāü ņ×ÉņøÉļČĆ ņ×ÉņøÉņāØņé░ņä▒ĻĖ░ļ░śĻĄ¼ņČĢņé¼ņŚģņŚÉ ņØśĒĢśļ®┤ ļŗłņ╝ł-ņ╣┤ļō£ļ«┤ņĀäņ¦ĆņØś ņłśņ×ģļ¤ēņØĆ ņĢĮ 900ĒåżņŚÉ ņØ┤ļź┤ļ®░, ĒĢ©ņ£ĀļÉśņ¢┤ ņ׳ļŖö ļŗłņ╝łĻ│╝ ņ╣┤ļō£ļ«┤ņØś ņ¢æņØĆ Ļ░üĻ░ü ņĢĮ 335Ēåż ļ░Å ņĢĮ 200ĒåżņŚÉ ļŗ¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĪ░ņé¼ļÉśņŚłļŗż [1]. ņØ┤ņÖĆ Ļ░ÖņØĆ ĒÅÉņĀäņ¦ĆņŚÉļŖö ņĀäņ¦ĆņØś ņóģļźśņŚÉ ļö░ļØ╝ņä£ ļŗłņ╝ł, ņĮöļ░£ĒŖĖ, Ēؼņ£ĀĻĖłņåŹ ļō▒ņØ┤ ĒĢ©ņ£ĀļÉśņ¢┤ ņ׳ņ£╝ļ®░, ņ£ĀĻ░ĆĻĖłņåŹņØä ĒÜīņłśĒĢ©ņ£╝ļĪ£ņŹ© ņ×ÉņøÉņØä ĒÜ©ņ£©ņĀüņ£╝ļĪ£ ņ×¼ĒÖ£ņÜ®ĒĢśĻ│Ā, ĒÅÉĻĖ░ļĪ£ ņØĖĒĢ┤ ļ░£ņāØĒĢśļŖö ĒÖśĻ▓ĮņĀüņØĖ ļ¼ĖņĀ£ļź╝ ļÅÖņŗ£ņŚÉ ĒĢ┤Ļ▓░ĒĢĀ ņłś ņ׳ļŗż.
ĒÅÉļŗłņ╝ł-ņ╣┤ļō£ļ«┤ņĀäņ¦Ć ņ×¼ĒÖ£ņÜ®ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļōżņØ┤ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņ¦äĒ¢ēļÉśņ¢┤ ņÖöņ£╝ļ®░ ļŗłņ╝łĻ│╝ ņ╣┤ļō£ļ«┤ņØś ļ╣äņĀÉņ░©ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ╣┤ļō£ļ«┤ņØä ņĀ£Ļ▒░ĒĢ£ Ēøä ļŗłņ╝łņØ┤ ĒĢ©ņ£ĀļÉśņ¢┤ ņ׳ļŖö ļČäļ¦ÉņØä ĒÖ®ņé░ņŚÉ ņ╣©ņČ£ĒĢśĻ│Ā, ĒÖ®ņé░ļŗłņ╝łļĪ£ ĒÜīņłśĒĢśļŖö Ļ│ĄņĀĢņØ┤ Ļ░£ļ░£ļÉśņŚłļŗż [2]. ĻĘĖļ¤¼ļéś ņ╣┤ļō£ļ«┤ ņĀ£Ļ▒░ļź╝ ņ£äĒĢ£ ņ”Øļźśļ▓ĢņØĆ ļŗżļ¤ēņØś ņŚÉļäłņ¦ĆĻ░Ć ņåīļ╣äļÉśļ®░ ļŗłņ╝ł, ņĮöļ░£ĒŖĖ ļō▒ ņ£ĀĻ░ĆĻĖłņåŹņØś ņåÉņŗżņØ┤ ļ¦ÄņØĆ ļŗ©ņĀÉņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż. ļö░ļØ╝ņä£ Ļ│Āņł£ļÅäņØś ĻĖłņåŹ ĒÜīņłśļź╝ ņ£äĒĢ┤ ņŖĄņŗØļ▓ĢņØ┤ ņĀ£ņĢłļÉśņŚłņ£╝ļ®░, ņŖĄņŗØļ▓ĢņØĆ ņäĀĒāØņĀü ļČäļ”¼ Ļ░ĆļŖź, Ļ│Āņł£ļÅä ņĀ£ĒÆł ņāØņé░, ņŚÉļäłņ¦Ć ņĀĆĻ░É ļō▒ņØś ņØ┤ņĀÉņØä ņ¦ĆļŗłĻ│Ā ņ׳ļŗż. ņ╣©ņČ£, ņ╣©ņĀä, ņØ┤ņś© ĻĄÉĒÖś ļ░Å ņÜ®ļ¦żņČöņČ£ļ▓ĢņŚÉ ņØśĒĢ£ ļŗłņ╝ł-ņ╣┤ļō£ļ«┤ ņĀäņ¦ĆļĪ£ļČĆĒä░ ĻĖłņåŹņØś ĒÜīņłś ļ░®ļ▓ĢņŚÉ Ļ┤ĆĒĢ£ ļ¦ÄņØĆ ņŚ░ĻĄ¼ļōżņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż [3-8]. ĻĖ░ņĪ┤ņØś ĒÅÉļŗłņ╝ł-ņ╣┤ļō£ļ«┤ņĀäņ¦ĆļĪ£ļČĆĒä░ ņ£ĀĻ░ĆĻĖłņåŹņØĖ ļŗłņ╝łĻ│╝ ņ╣┤ļō£ļ«┤ņØś ĒÜīņłśļź╝ ņ£äĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŻ╝ļĪ£ ņÜ®ļ¦żņČöņČ£ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļŗłņ╝łĻ│╝ ņ╣┤ļō£ļ«┤ņØä ļČäļ”¼ĒĢśļŖö ļ░®ļ▓ĢņØ┤ ņĀ£ņŗ£ļÉśņŚłņ£╝ļéś, ļČäļ”¼ĒĢśĻ│Āņ×É ĒĢśļŖö ņ╣┤ļō£ļ«┤ņØ┤ ļŗżļ¤ēņ£╝ļĪ£ ļōżņ¢┤ ņ׳ļŖö Ļ▓ĮņÜ░ ĒĢ©ņ£ĀļÉśņ¢┤ ņ׳ļŖö ņ╣┤ļō£ļ«┤ņØś ĒĢ©ļ¤ēļ¦īĒü╝ ņÜ®ļ¦żņČöņČ£ņĀ£ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ņĢ╝ ĒĢśļ®░ ļŗłņ╝ł, ņĮöļ░£ĒŖĖ, ņ╣┤ļō£ļ«┤ņØä ļČäļ”¼ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņŚ¼ļ¤¼ ņóģļźśņØś ņÜ®ļ¦żņČöņČ£ņĀ£ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņÜ®ļ¦żņČöņČ£Ļ│ĄņĀĢņØä ļ░śļ│ĄĒĢ┤ņĢ╝ĒĢśļŖö ļŗ©ņĀÉņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż. ņØ┤ņÖĆ Ļ░ÖņØĆ ļ¼ĖņĀ£ņŚÉ ļīĆĒĢ£ ĒĢ┤Ļ▓░ļ░®ņĢłņ£╝ļĪ£ ĒÖ®ĒÖöļ¼╝ņØä ņØ┤ņÜ®ĒĢ£ ņ╣©ņĀä ļ░śņØæņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļ│┤Ļ│ĀļÉśņŚłņ£╝ļ®░, ĒÖ®ĒÖöļ¼╝ ņ╣©ņĀäļ▓ĢņØś Ļ▓ĮņÜ░ ļé«ņØĆ pHņŚÉņä£ ĻĖłņåŹņØś ņäĀĒāØņĀü ņ╣©ņĀäņØä ĒåĄĒĢ┤ ņ×¼ņé¼ņÜ®ņØ┤ Ļ░ĆļŖźĒĢśļŗżĻ│Ā ĒĢśņśĆļŗż. ĒÖ®ĒÖöļ¼╝ ņ╣©ņĀäņØĆ ĻĖłņåŹ ĒÖ®ĒÖöļ¼╝ņØś ņÜ®ĒĢ┤ļÅäĻ░Ć ļé«ĻĖ░ ļĢīļ¼ĖņŚÉ ņÜ®ņĢĪņŚÉņä£ ņżæĻĖłņåŹņØä ļŹö ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņĀ£Ļ▒░ĒĢ£ļŗżļŖö Ļ▓āņØ┤ ļ¦ÄņØĆ ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ ņ×ģņ”ØļÉśņŚłņ£╝ļ®░, Na2S, NaHS, H2S ļō▒ņØ┤ ņ╣©ņĀäņĀ£ļĪ£ ņŻ╝ļĪ£ ņé¼ņÜ®ļÉśņŚłļŗż. ļśÉĒĢ£ ĻĖłņåŹ ĒÖ®ĒÖöļ¼╝ņØś ņÜ®ĒĢ┤ļÅäņÖĆ pHņŚÉ ļö░ļØ╝ ņäĀĒāØņĀüņ£╝ļĪ£ ņ╣©ņĀäļÉśļ®░ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņŚÉņä£ ļŗżņ¢æĒĢ£ ĻĖłņåŹņØä ņ╣©ņĀäņŗ£ĒéżĻĖ░ ņ£äĒĢ£ ņĄ£ņĀüņØś pH Ļ░ÆņŚÉ ļīĆĒĢ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż [9-13].
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļŗłņ╝ł-ņ╣┤ļō£ļ«┤ ĒÅÉņĀäņ¦ĆļĪ£ļČĆĒä░ ļŗłņ╝łņØä ĒÜīņłśĒĢśņŚ¼ ņ×¼ĒÖ£ņÜ®ĒĢśĻĖ░ ņ£äĒĢ£ ļ░®ņĢłņ£╝ļĪ£ ĒÅÉņĀäņ¦ĆņŚÉ ĒĢ©ņ£ĀļÉśņ¢┤ ņ׳ļŖö ņ╣┤ļō£ļ«┤ņØä ĒÜ©ņ£©ņĀüņ£╝ļĪ£ ņĀ£Ļ▒░ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņłśĒ¢ēļÉśņŚłļŗż. ļŗłņ╝ł-ņ╣┤ļō£ļ«┤ ņ╣©ņČ£ņÜ®ņĢĪņŚÉņä£ ņ╣┤ļō£ļ«┤ņØä ĒÖ®ĒÖöņ╣┤ļō£ļ«┤ņ£╝ļĪ£ ņ╣©ņĀäņŗ£ņ╝£ ņĀ£Ļ▒░ĒĢśļŖö ĒÖ®ĒÖöļ¼╝ ņ╣©ņĀäļ░śņØæņØä ņØ┤ņÜ®ĒĢśņśĆļŗż. ņ£Āņé¼ĒĢ£ pH ņśüņŚŁņŚÉņä£ ņ╣©ņĀäļÉśļŖö ļŗłņ╝łĻ│╝ ņ╣┤ļō£ļ«┤ņØä ĻĖ░ņĪ┤ņŚÉ ņŻ╝ļĪ£ ņé¼ņÜ®ļÉ£ Na2SņÖĆ ĒĢ©Ļ╗ś FeS, (NH4)2Sļź╝ ņ╣©ņĀäņĀ£ļĪ£ ņé¼ņÜ®ĒĢśņŚ¼ ĒÖ®ĒÖöļ¼╝ ņóģļźśņÖĆ ņ▓©Ļ░Ćļ¤ē ļ│ĆĒÖöņŚÉ ļö░ļźĖ ņ╣┤ļō£ļ«┤ ĒÜīņłśņ£©ņŚÉ ļīĆĒĢśņŚ¼ Ļ│Āņ░░ĒĢśņśĆļŗż. ņØ┤ļź╝ ĒåĄĒĢ┤ ļŗłņ╝ł-ņ╣┤ļō£ļ«┤ ņ╣©ņČ£ņÜ®ņĢĪņØś pH ņĪ░Ļ▒┤ņŚÉņä£ ņĄ£ņĀüņØś ĒÖ®ĒÖöļ¼╝ ņ╣©ņĀäņĀ£ļź╝ ņäĀņĀĢĒĢśĻ│Ā, ļŗłņ╝ł-ņ╣┤ļō£ļ«┤ ĒÅÉņĀäņ¦Ć ņ×¼ĒÖ£ņÜ® Ļ│ĄņĀĢņŚÉ ņĀüņÜ®ĒĢśĻ│Āņ×É ĒĢśņśĆļŗż.
2. ņŗżĒŚśļ░®ļ▓Ģ
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņé¼ņÜ®ļÉ£ ņŗ£ļŻīļŖö Ēöäļ×æņŖżņŚÉņä£ ņĀ£ņ×æĒĢ£ ņé░ņŚģņÜ® ļŗłņ╝ł-ņ╣┤ļō£ļ«┤ ĒÅÉņĀäņ¦Ć(Saft, NCX 125)ļź╝ ņØ┤ņÜ®ĒĢśņśĆņ£╝ļ®░, ņĀäĻĘ╣ ļČäļ¦ÉĒÜīņłśļź╝ ņ£äĒĢ£ ĒĢ┤ņ▓┤ Ļ│╝ņĀĢņØä ĻĘĖļ”╝ 1ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. ĻĘĖļ”╝ 2ļŖö ĒÅÉļŗłņ╝ł-ņ╣┤ļō£ļ«┤ņĀäņ¦Ć ĒÖ®ĒÖöļ¼╝ņ╣©ņĀä Ļ│ĄņĀĢļÅäļź╝ ļéśĒāĆļéĖ Ļ▓āņ£╝ļĪ£ ĒÅÉļŗłņ╝ł-ņ╣┤ļō£ļ«┤ņĀäņ¦ĆļĪ£ļČĆĒä░ ĒÜīņłśĒĢ£ ņ¢æĻĘ╣ ļ░Å ņØīĻĘ╣ņØś ļČäļ¦ÉņØä Ļ░üĻ░ü 50 gņö® 1 :1 ļ╣äņ£©ļĪ£ Ēś╝ĒĢ®ĒĢśņŚ¼ ĒÖ®ņé░ 2MņØś ņĪ░Ļ▒┤ņ£╝ļĪ£ Ļ│ĀņĢĪļ╣ä(L/S) 20, ļ░śņØæņś©ļÅä 90 ┬░CņŚÉņä£ 3ņŗ£Ļ░ä ņ╣©ņČ£ĒĢśņŚ¼ ļŗłņ╝ł-ņ╣┤ļō£ļ«┤ Ēś╝ĒĢ®ņÜ®ņĢĪ(pH 0.8)ņØä ņ¢╗ņŚłņ£╝ļ®░, ņÜ®ņĢĪņØś ņä▒ļČä ļČäņäØĻ▓░Ļ│╝ļź╝ Ēæ£ 1ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. ļ░śņØæĻĖ░ņŚÉ 200 mlņØś ļŗłņ╝ł-ņ╣┤ļō£ļ«┤ ņ╣©ņČ£ņÜ®ņĢĪņØä ņŻ╝ņ×ģĒĢśĻ│Ā, 300 rpmņ£╝ļĪ£ ĻĄÉļ░śĒĢśņśĆļŗż. ĒÖ®ĒÖöļéśĒŖĖļź©(Na2S┬Ę9H2O, JUNSEI, 98%), ĒÖ®ĒÖöņĢöļ¬©ļŖä((NH4)2S, SIGMA-ALDRICH, 20% in H2O), ĒÖ®ĒÖöņ▓Ā(FeS, SIGMA-ALDRICH, 99.9%)ņØä ņ╣┤ļō£ļ«┤ ĒĢ©ļ¤ē ļīĆļ╣ä 0.5, 1.0, 1.5, 2.0ļ░░ļĪ£ ņ▓©Ļ░ĆĒĢśņŚ¼ ļ░śņØæņŗ£ņ╝░ļŗż. ĒÖ®ĒÖöļéśĒŖĖļź©Ļ│╝ ĒÖ®ĒÖöņ▓ĀņØĆ ļČäļ¦Éņŗ£ļŻī, ĒÖ®ĒÖöņĢöļ¬©ļŖäņØĆ ņÜ®ņĢĪņāüĒā£ļĪ£ ņ▓©Ļ░ĆĒĢśĻ│Ā ņŗżļ”¼ņĮśļ¦łĻ░£ļĪ£ ļ░Ćļ┤ēĒĢ£ Ēøä, 1ņŗ£Ļ░ä ļÅÖņĢł ļ░śņØæņŗ£ņ╝░ļŗż. ņŚ¼Ļ│╝ļź╝ ĒåĄĒĢ┤ ņŚ¼ņĢĪņāśĒöīņØä ĒÜīņłśĒĢśĻ│Ā, ņłśņäĖņÖĆ ņŚ¼Ļ│╝ļź╝ ļ░śļ│ĄĒĢśņŚ¼ ņ╣©ņĀäļ¼╝ņØä ĒÜīņłśĒĢśņśĆņ£╝ļ®░, 100 ┬░CņŚÉņä£ 12ņŗ£Ļ░ä Ļ▒┤ņĪ░ĒĢśņśĆļŗż. ļČäļ¦ÉņØś Ļ▓░ņĀĢņä▒, ĒśĢņāüņØä ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ XRD(X-ray Diffraction, Rigaku Corp., D/MAX-2500), FESEM(Field Emission Scanning Electron Microscope, TESCAN, MIRA3)ļź╝ ņØ┤ņÜ®ĒĢśņśĆņ£╝ļ®░, XRF(X-ray Fluorescence analysis, SHIMADZU, XRF-1800)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ĻĄ¼ņä▒ ņä▒ļČä ļČäņäØņØä ņŗżņŗ£ĒĢśņśĆļŗż. ņ╣©ņĀäļ¼╝ņØä ņĀ£Ļ▒░ĒĢ£ ņŚ¼Ļ│╝ņĢĪ ņżæ ņ£ĀĻ░ĆĻĖłņåŹņØś ļåŹļÅäļŖö ICP(Inductively Coupled Plasma Atomic Emission Spectroscopy, Varian, Liberty RL Sequential)ļź╝ ņØ┤ņÜ®ĒĢ┤ ļŗłņ╝ł, ņ╣┤ļō£ļ«┤, ņĮöļ░£ĒŖĖ ļō▒ ĻĖłņåŹņØś ļåŹļÅäļź╝ ĒÖĢņØĖĒĢśņśĆļŗż.
3. Ļ▓░Ļ│╝ ļ░Å Ļ│Āņ░░
ļŗłņ╝ł-ņ╣┤ļō£ļ«┤ ĒÖ®ņé░ņÜ®ņĢĪņŚÉņä£ ņ╣┤ļō£ļ«┤ņØś ņäĀĒāØņĀü ļČäļ”¼ļź╝ ņ£äĒĢ£ ņŗżĒŚśņ£╝ļĪ£ņä£ ĒÖ®ĒÖöļéśĒŖĖļź©, ĒÖ®ĒÖöņ▓Ā, ĒÖ®ĒÖöņĢöļ¬©ļŖäņØä ņé¼ņÜ®ĒĢśņŚ¼ ĒÖ®ĒÖöņ╣┤ļō£ļ«┤ņ£╝ļĪ£ ĒÜīņłśĒĢśĻ│Āņ×É ĒĢśņśĆļŗż. Cd2+ņØś Ļ▓ĮņÜ░, S2-ņÖĆņØś ļ░śņØæņŚÉ ņØśĒĢśņŚ¼ CdS ĒśĢĒā£ļĪ£ ņ╣©ņĀäļÉśļŖö Ļ▓āņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļŗłņ╝ł-ņ╣┤ļō£ļ«┤ ņÜ®ņĢĪņ£╝ļĪ£ļČĆĒä░ ņ╣┤ļō£ļ«┤ņØä ņäĀĒāØņĀü ļČäļ”¼ĒĢśĻ│Āņ×É ĒĢśņśĆņ£╝ļ®░, ļ░śņØæņŗØņØĆ ņŗØ (1)Ļ│╝ Ļ░Öļŗż.
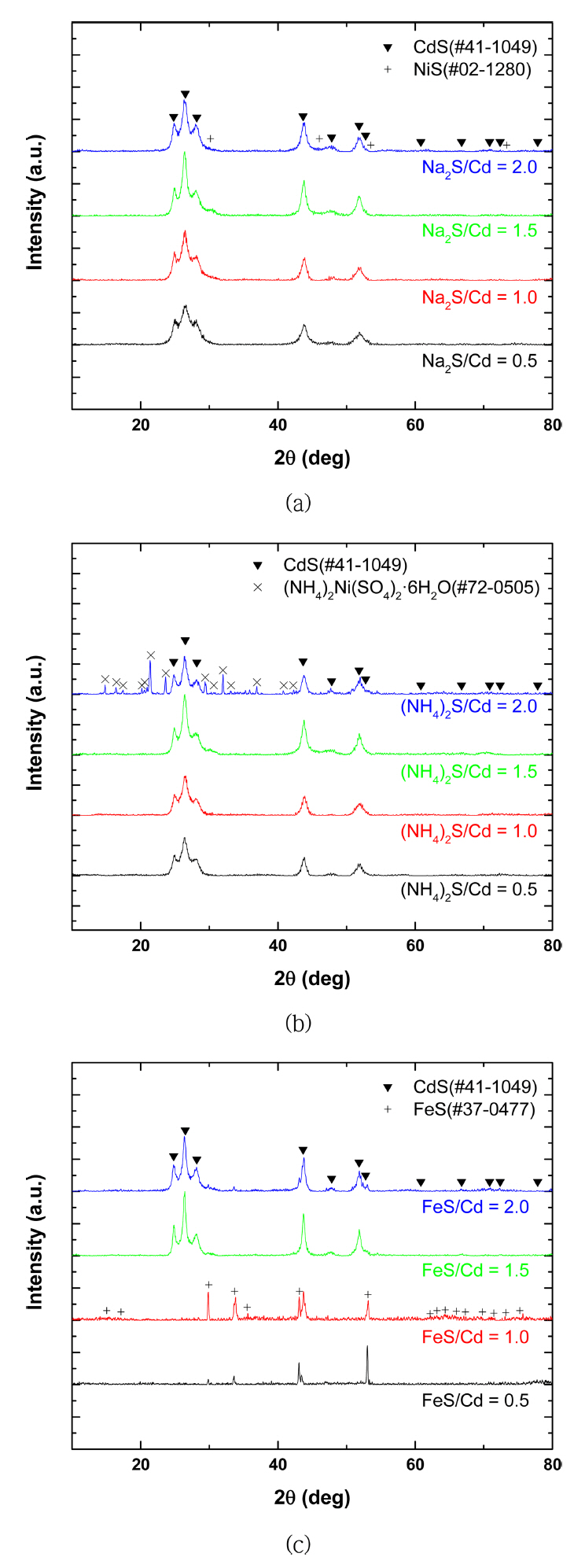
ĒÖ®ĒÖöļ¼╝/ņ╣┤ļō£ļ«┤ ļ¬░ ļ╣äņŚÉ ļö░ļźĖ ĒÖ®ĒÖöļ¼╝ ņ╣©ņĀäļ░śņØæņŚÉņä£ ņ╣©ņĀäļÉ£ ļČäļ¦ÉņØś Ļ▓░ņĀĢņä▒ņØä ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ XRD ļČäņäØņØä ņ¦äĒ¢ēĒĢśņśĆņ£╝ļ®░ ĻĘĖ Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 3ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. Na2S, (NH4)2Sļź╝ ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ ļ¬░ ļ╣äņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ CdSĻ░Ć ņ╣©ņĀäļÉśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, ņØ┤ļŖö ņĢ×ņä£ ņĀ£ņŗ£ĒĢ£ ņŗØ (1)Ļ│╝ ņØ╝ņ╣śĒĢ£ļŗż. (NH4)2S/Cd = 2.0ņØ╝ ļĢī, CdSņÖĆ ĒĢ©Ļ╗ś (NH4)2Ni(SO4)2┬Ę6H2O peakĻ░Ć ļéśĒāĆļé¼ņ£╝ļ®░, Ļ│╝ļ¤ēņØś NH4+ņØ┤ņś©ņØ┤ Ni2+, SO42-ņØ┤ņś©Ļ│╝ ļ░śņØæĒĢśņŚ¼ ņ╣©ņĀäļÉ£ Ļ▓░Ļ│╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż [14]. ĒÜīņĀłĒī©Ēä┤ņØĆ (NH4)2Ni(SO4)2┬Ę6H2OņØś PDF database ļ░Å ņäĀĒ¢ēņŚ░ĻĄ¼Ļ▓░Ļ│╝ņÖĆ ņØ╝ņ╣śĒĢśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż. FeSņØś Ļ▓ĮņÜ░ FeS/Cd Ōēż 1.0ņØĖ Ļ▓ĮņÜ░ FeS peakļ¦ī ņĪ┤ņ×¼ĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļŖö ļ¼╝ņŚÉ ņÜ®ĒĢ┤ļÉśņ¦Ć ņĢŖļŖö FeSņØś ņä▒ņ¦łņŚÉ ņØśĒĢ£ Ļ▓░Ļ│╝ļĪ£ ĒÖ®ņé░ņØä ņ▓©Ļ░ĆĒĢśņŚ¼ ņÜ®ņĢĪņØś pHļź╝ 0.2ļĪ£ ņĪ░ņĀłĒĢśĻ│Ā 24ņŗ£Ļ░ä ņØ┤ņāü ļ░śņØæņŗ£ņ╝░ņØīņŚÉļÅä FeSĻ░Ć ņÜ®ĒĢ┤ļÉśņ¦Ć ņĢŖņĢäņä£ ļéśĒāĆļé£ Ļ▓░Ļ│╝ļĪ£ ņé¼ļŻīļÉ£ļŗż. FeS/Cd Ōēź 1.5 ņĪ░Ļ▒┤ņŚÉņä£ļŖö Fe2+ņÖĆ Cd2+ ņØ┤ņś© Ļ░äņØś ņ╣śĒÖśļ░śņØæņŚÉ ņØśĒĢ┤ CdSĻ░Ć ņ╣©ņĀäļÉśļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż.
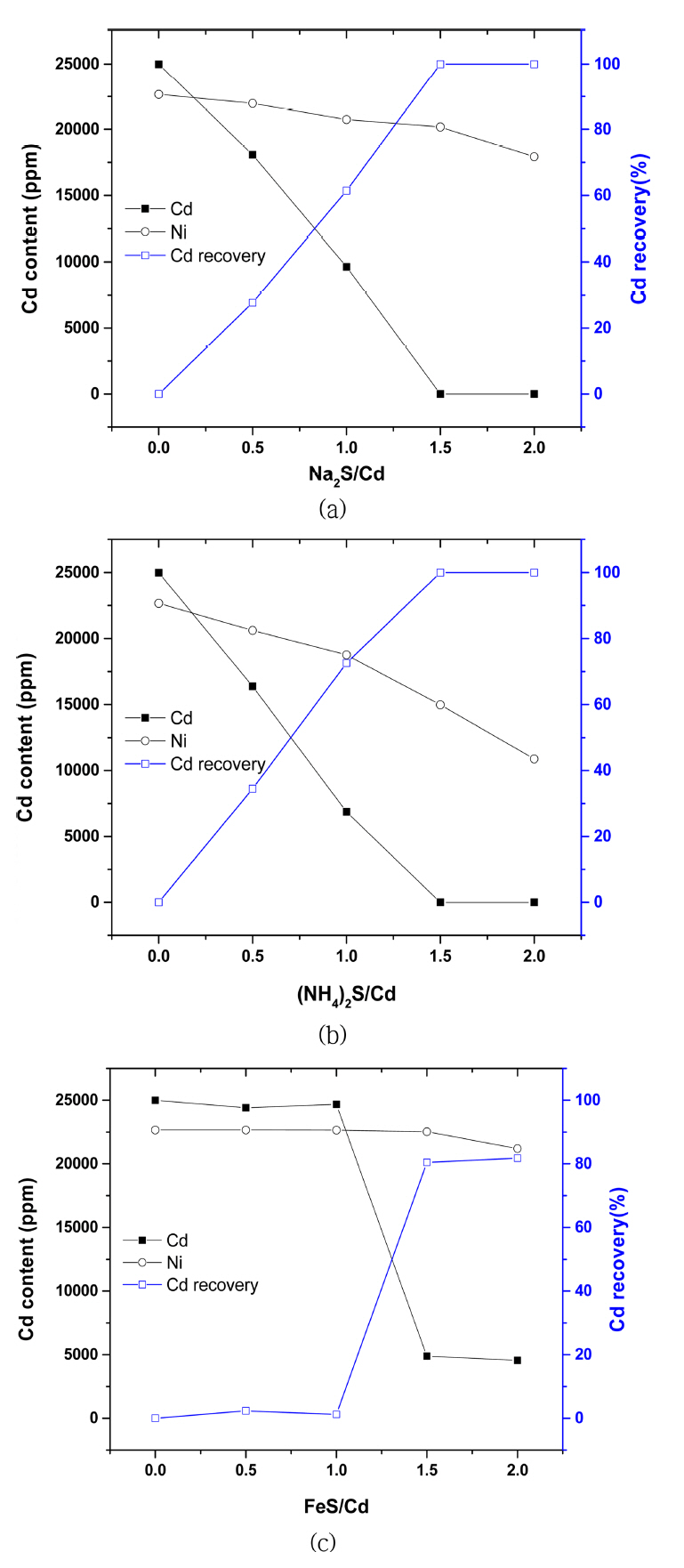
Ēæ£ 2ļŖö XRFļź╝ ņØ┤ņÜ®ĒĢ┤ ņ╣©ņĀäļČäļ¦ÉņØś ņä▒ļČäļČäņäØņØä ņ¦äĒ¢ēĒĢ£ Ļ▓░Ļ│╝ņØ┤ļ®░, ņŻ╝ņÜö ņøÉņåīņØĖ Cd, Ni, S, FeņØś ĒĢ©ļ¤ēņØä Ēæ£ņŗ£ĒĢśņśĆļŗż. Na2S/Cd ļ¬░ ļ╣äĻ░Ć 0.5ņŚÉņä£ 2.0ļĪ£ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņ╣©ņĀäļČäļ¦ÉņØś ņ╣┤ļō£ļ«┤ ĒĢ©ļ¤ēņØĆ 82%ņŚÉņä£ 74%ļĪ£ Ļ░ÉņåīĒĢśĻ│Ā, ļŗłņ╝ł ņä▒ļČäņØĆ 2%ņŚÉņä£ 9%ļĪ£ ņ”ØĻ░ĆĒĢśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņśĆļŗż. (NH4)2Sļź╝ ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ ņ╣©ņĀäļČäļ¦ÉņØś Cd ĒĢ©ļ¤ēņØĆ 60%Ļ╣īņ¦Ć Ļ░ÉņåīĒĢśļ®░, ļŗłņ╝ł ĒĢ©ļ¤ēņØĆ 19%ļĪ£ ņ”ØĻ░ĆĒĢśņśĆļŗż. ņĢ×ņäĀ XRDņŚÉņä£ ļéśĒāĆļé£ ļ░öņÖĆ Ļ░ÖņØ┤ (NH4)2Ni(SO4)2┬Ę6H2OĻ░Ć ņ╣©ņĀäļÉśņ¢┤ ļŗłņ╝ł ĒĢ©ļ¤ēņØ┤ ņ”ØĻ░ĆĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉśļ®░ ĒÖ®ĒÖöļ¼╝ ņ╣©ņĀäļ░śņØæņØä ĒåĄĒĢ┤ CdSĻ░Ć ņ╣©ņĀäļÉśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļéś, Ļ│╝ļ¤ēņØś (NH4)2Sļź╝ ņ▓©Ļ░ĆĒĢśļŖö Ļ▓ĮņÜ░ ĒĢ©Ļ╗ś ņ╣©ņĀäļÉśļŖö ļŗłņ╝łņØś ņ¢æņØ┤ ņ”ØĻ░ĆĒĢśņŚ¼ ņ╣┤ļō£ļ«┤Ļ│╝ ļŗłņ╝łņØä ļČäļ”¼ĒĢśļŖöļŹ░ ņ¢┤ļĀżņøĆņØ┤ ņĪ┤ņ×¼ĒĢśņśĆļŗż. FeSļź╝ ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ XRD Ļ▓░Ļ│╝ņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ FeS/Cd Ōēż 1.0ņØś ņĪ░Ļ▒┤ņŚÉņä£ ņ╣┤ļō£ļ«┤ņØ┤ Ļ▓ĆņČ£ļÉśņ¦Ć ņĢŖĻ│Ā, ņ▓ĀņØś ĒĢ©ļ¤ēņØ┤ 70%ļĪ£ ļéśĒāĆļéś ĒÖ®ĒÖöļ¼╝ ņ╣©ņĀäļ░śņØæņØ┤ ņØ╝ņ¢┤ļéśņ¦Ć ņĢŖņØĆ Ļ▓āņØä ņĢī ņłś ņ׳ļŗż. ļśÉĒĢ£ ļŗżļźĖ ĒÖ®ĒÖöļ¼╝ņØä ņ▓©Ļ░ĆĒĢśņśĆņØä ļĢī ĒÖ®ĒÖöļ¼╝/ņ╣┤ļō£ļ«┤ ļ¬░ ļ╣äĻ░Ć 2.0ņØĖ Ļ▓ĮņÜ░ ņ╣©ņĀäļČäļ¦ÉņØś ņ▓ĀņØś ĒĢ©ļ¤ēņØĆ ņĄ£ļīĆ 1%ņØś Ļ▓░Ļ│╝ļź╝ ļ│┤ņØĖ Ļ▓āņŚÉ ļ╣äĒĢ┤ FeS/Cd Ōēź 1.5 ņĪ░Ļ▒┤ņŚÉņä£ļŖö ļŗłņ╝ł 1% ļ»Ėļ¦ī, ņ▓Ā 5% ņØ┤ņāüņØś Ļ▓░Ļ│╝ļź╝ ļ│┤ņØ┤ļ®░ ĻĖ┤ ļ░śņØæņŗ£Ļ░äņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ļ░śņØæņØ┤ ņÖäļŻīļÉśņ¦Ć ņĢŖņØĆ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.
ĒÖ®ĒÖöļ¼╝ ņ╣©ņĀäļ░śņØæņŚÉ ņØśĒĢ┤ ņ╣©ņĀäļÉ£ ļČäļ¦ÉņØä ņŚ¼Ļ│╝ĒĢśĻ│Ā, ĒÜīņłśĒĢ£ ņŚ¼Ļ│╝ņĢĪ ņżæ ņ£ĀĻ░ĆĻĖłņåŹņØś ļåŹļÅäļź╝ ICPļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļČäņäØĒĢ£ Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 4ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. ņ╣┤ļō£ļ«┤Ļ│╝ ļŗłņ╝łņØś ļåŹļÅä ļ░Å ņ╣┤ļō£ļ«┤ņØś ĒÜīņłśņ£©ņØä Ļ│äņé░ĒĢśņŚ¼ ļéśĒāĆļé┤ņŚłļŗż. ĒÖ®ĒÖöļ¼╝ ņ▓©Ļ░Ćļ¤ēņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ĒÖ®ĒÖöļ¼╝ ņ╣©ņĀäļ░śņØæņŚÉ ņØśĒĢ┤ ņŚ¼ņĢĪņØś ņ╣┤ļō£ļ«┤ņØś ĒĢ©ļ¤ēņØ┤ Ļ░ÉņåīĒĢśļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż. FeSļź╝ ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ ņĢ×ņäĀ Ļ▓░Ļ│╝ņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ FeS/Cd Ōēż 1.0ņØś ņĪ░Ļ▒┤ņŚÉņä£ ņ╣┤ļō£ļ«┤ ĒĢ©ļ¤ēņØ┤ ļ│ĆĒÖöĒĢśņ¦Ć ņĢŖĻ│Ā, ļ¬░ ļ╣äĻ░Ć 2.0 ņØ╝ ļĢī ņ╣┤ļō£ļ«┤ ĒĢ©ļ¤ēņØ┤ ņĢĮ 4500 ppmņ£╝ļĪ£ Ļ░ÉņåīĒĢśņśĆņ£╝ļ®░ ļŗłņ╝łņØś ĒĢ©ļ¤ēņØĆ ņĄ£ņóģņĀüņ£╝ļĪ£ ņĢĮ 6% Ļ░ÉņåīĒĢśņŚ¼ ĒÖ®ĒÖöļ¼╝ ņ╣©ņĀäļ░śņØæņŚÉ ņØśĒĢ£ ņ╣┤ļō£ļ«┤ ĒÜīņłśĻ░Ć ņÖäļŻīļÉśņ¦Ć ņĢŖņØĆ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. ņØ┤ņŚÉ ļ░śĒĢ┤ Na2S/Cd, (NH4)2S/Cd Ōēź 1.5 ņØ╝ ļĢī ņ╣┤ļō£ļ«┤ ĒĢ©ļ¤ēņØĆ 0 ppmņ£╝ļĪ£ 100% ĒÜīņłśļÉśļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ņ£╝ļ®░ ļŗłņ╝łņØś ĒĢ©ļ¤ēļÅä ĒÖ®ĒÖöļ¼╝ ņ▓©Ļ░Ćļ¤ēņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņ¦ĆņåŹņĀüņ£╝ļĪ£ Ļ░ÉņåīĒĢśņŚ¼, ļ¬░ļ╣äĻ░Ć 2.0 ņØ╝ ļĢī Ļ░üĻ░ü 79.2%, 48%ļĪ£ Ļ░ÉņåīĒĢśļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļŖö ĒÖ®ĒÖöļ¼╝ ņ▓©Ļ░Ćļ¤ēņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņ╣©ņĀäļÉśļŖö ņ╣┤ļō£ļ«┤Ļ│╝ ļŗłņ╝łņØś ņ¢æņØ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØä ļ│┤ņŚ¼ņŻ╝ļ®░, ņ╣┤ļō£ļ«┤Ļ│╝ ļŗłņ╝łņØś ļČäļ”¼ļź╝ ņ£äĒĢ┤ņä£ļŖö Na2Sļź╝ ņ▓©Ļ░ĆĒĢśļŖö Ļ▓āņØ┤ ļ│┤ļŗż ĒÜ©ņ£©ņĀüņØĖ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.
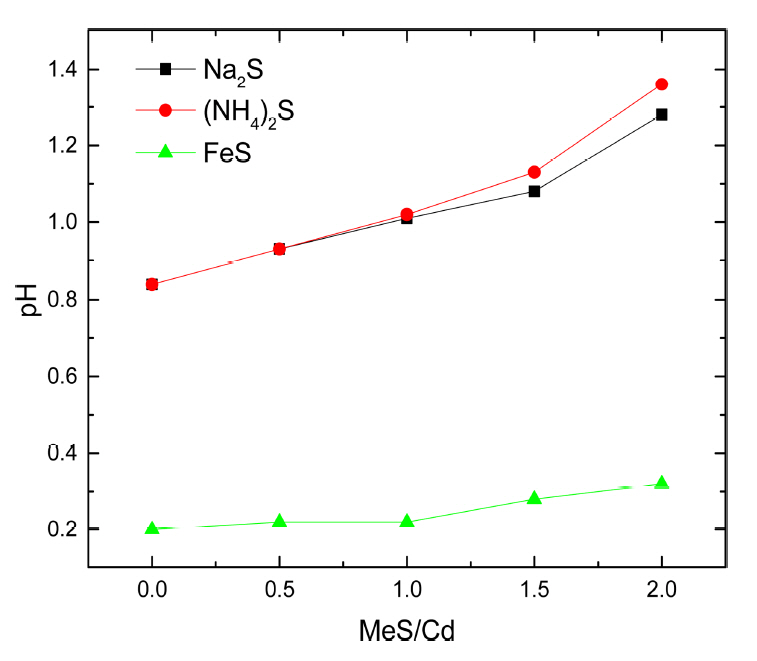
ĻĘĖļ”╝ 5ļŖö ņ▓©Ļ░ĆĒĢ£ ĒÖ®ĒÖöļ¼╝ņØś ņóģļźśņÖĆ ļ¬░ ļ╣äņŚÉ ļö░ļźĖ ņ╣©ņĀäļ░śņØæ Ēøä ņÜ®ņĢĪņØś pH ļ│ĆĒÖöļź╝ ļéśĒāĆļéĖ Ļ▓āņØ┤ļŗż. ļ░śņØæņØ┤ ņ¦äĒ¢ēļÉ©ņŚÉ ļö░ļØ╝ pHĻ░Ć ņ”ØĻ░ĆĒĢśņśĆņ£╝ļ®░, ĒÖ®ĒÖöļ¼╝ ņ▓©Ļ░Ćļ¤ēņØ┤ ņ”ØĻ░ĆĒĢĀņłśļĪØ pHĻ░Ć ņ”ØĻ░ĆĒĢśļŖö Ļ▓ĮĒ¢źņØä ļéśĒāĆļé┤ņŚłļŗż. Na2Sļź╝ ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ ņ▓©Ļ░Ćļ¤ēņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ pHļŖö 0.8ņŚÉņä£ 1.3Ļ╣īņ¦Ć ņ”ØĻ░ĆĒĢśņśĆĻ│Ā, (NH4)2SņØś Ļ▓ĮņÜ░ pH 1.4Ļ╣īņ¦Ć ņ”ØĻ░ĆĒĢśļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļŖö ļåÆņØĆ pHļź╝ Ļ░¢ļŖö Na2S, (NH4)2SĻ░Ć ņ▓©Ļ░ĆļÉśļ®┤ņä£ ļéśĒāĆļé£ Ļ▓░Ļ│╝ļĪ£ pHĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņ╣┤ļō£ļ«┤ ņ╣©ņĀäņØ┤ ņ”ØĻ░ĆĒĢśņśĆņ£╝ļéś ļÅÖņŗ£ņŚÉ ņ╣©ņĀäļÉ£ ļŗłņ╝łņØ┤ ņ”ØĻ░ĆĒĢśņśĆļŗż. ņäĀĒ¢ēļÉ£ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ļŗłņ╝łņØś ņ╣©ņĀäņØĆ pH 0ņŚÉņä£ ņŗ£ņ×æļÉśņ¢┤ pHĻ░Ć ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłņ£╝ļ®░, ņØ┤ļŖö ņ╣©ņĀäļ¼╝ņŚÉņä£ ļŗłņ╝łņØś ĒĢ©ļ¤ēņØ┤ ņ”ØĻ░ĆĒĢśļŖö ņŗżĒŚś Ļ▓░Ļ│╝ņÖĆ ņØ╝ņ╣śĒĢśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż [15]. FeS ņ▓©Ļ░Ćļ¤ēņŚÉ ļö░ļźĖ pH ļ│ĆĒÖöļŖö FeS/Cd Ōēż 1.0ņØś ņĪ░Ļ▒┤ņŚÉņä£ ĒÖ®ĒÖöļ¼╝ ņ╣©ņĀä ļ░śņØæņØ┤ ņØ╝ņ¢┤ļéśņ¦Ć ņĢŖĻ│Ā, Ļ│╝ļ¤ēņØä ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ņŚÉļÅä ļ░śņØæņØ┤ ņÖäļŻīļÉśņ¦Ć ņĢŖņØĆ Ļ▓░Ļ│╝ļĪ£ ņØĖĒĢ┤ ņ┤łĻĖ░ pH 0.2ņŚÉņä£ FeS/Cd = 2.0ņØ╝ ļĢī pH 0.3ņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśņŚ¼ ļŗżļźĖ ļæÉ ņ╣©ņĀäņĀ£ņŚÉ ļ╣äĒĢ┤ pHņØś ļ│ĆĒÖöĻ░Ć Ēü¼ņ¦Ć ņĢŖņØĆ Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż.
ĒÜīņłśĒĢ£ CdS ļČäļ¦ÉņØś ņ×ģņ×É ĒśĢņāü ļ░Å Ēü¼ĻĖ░ļź╝ FESEMņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, ĻĘĖ Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 6ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. ĒÖ®ĒÖöļ¼╝ ņ╣©ņĀäļ░śņØæņŚÉ ņØśĒĢ┤ ņ╣©ņĀäļÉśļŖö CdS ņ×ģņ×ÉļŖö 50 nm ņØ┤ĒĢśņØś ļ»ĖņäĖĒĢ£ 1ņ░© ņ×ģņ×ÉļōżņØ┤ ņØæņ¦æĒĢśņŚ¼ 2ņ░© ņ×ģņ×Éļź╝ ņØ┤ļŻ©ņ¢┤ ņØæņ¦æļÉśņ¢┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ Ļ┤Ćņ░░ļÉ£ļŗż. 1ņ░© ņ×ģņ×ÉļŖö ļ╣äņĀĢĒśĢņŚÉ Ļ░ĆĻ╣īņÜ┤ 10 nm ņĀĢļÅäņØś ņ×ģņ×ÉļōżļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳Ļ│Ā, 1ņ░© ņ×ģņ×ÉļōżņØ┤ ņØæņ¦æĒĢśļ®┤ņä£ Ēæ£ļ®┤ņØ┤ Ļ▒░ņ╣£ ĻĄ¼ĒśĢņØś ņ×ģņ×ÉļĪ£ ņä▒ņןĒĢ£ ĒśĢĒā£ļĪ£ ļ│┤ņØĖļŗż. Ēü¼ĻĖ░ļŖö ļČłĻĘĀņØ╝ĒĢśņŚ¼ 0.1 ~ 1 ╬╝mļĪ£ ļČäĒżļÉśņ¢┤ ņ׳ļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļŖö ņŗżĒŚśņĪ░Ļ▒┤ļ▓öņ£äņŚÉņä£ Ļ▓░ņĀĢņä▒ņןļ│┤ļŗżļŖö ĒĢĄņāØņä▒ņØ┤ ņÜ░ņäĖĒĢśņŚ¼ ĒśĢņä▒ļÉ£ 1ņ░© ņ×ģņ×ÉļōżņØ┤ ļåÆņØĆ Ēæ£ļ®┤ņŚÉļäłņ¦ĆļĪ£ ņØĖĒĢ┤ ņä£ļĪ£ ņØæņ¦æļÉ©ņ£╝ļĪ£ņŹ© ņĪ░ļīĆĒĢ£ ņ×ģņ×ÉĻ░Ć ņāØņä▒ļÉ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż. ļ░śņØæļ░®ļ▓Ģ, ņĪ░Ļ▒┤ ļō▒ ļ│ĆĒÖöļź╝ ĒåĄĒĢ┤ ĻĘĀņØ╝ĒĢ£ Ēü¼ĻĖ░ņØś ņ×ģņ×Éļź╝ ņ╣©ņĀäņŗ£Ēé¼ ņłś ņ׳ļŖö ļ░®ņĢłņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
4. Ļ▓░ ļĪĀ
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņé░ņŚģņÜ® ļŗłņ╝ł-ņ╣┤ļō£ļ«┤ ĒÅÉņĀäņ¦Ć ņ×¼ĒÖ£ņÜ® Ļ│ĄņĀĢņŚÉņä£ ņ╣┤ļō£ļ«┤Ļ│╝ ļŗłņ╝łņØä ĒÜ©ņ£©ņĀüņ£╝ļĪ£ ļČäļ”¼ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ĒÖ®ĒÖöļ¼╝ ņ╣©ņĀäļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņäĀĒāØņĀüņ£╝ļĪ£ ņ╣┤ļō£ļ«┤ņØä ļČäļ”¼ĒĢśļŖö ļ░®ļ▓ĢĻ│╝ ĻĘĖ Ļ▓░Ļ│╝ņŚÉ ļīĆĒĢśņŚ¼ Ļ│Āņ░░ĒĢśņśĆļŗż.
1) ļŗłņ╝ł-ņ╣┤ļō£ļ«┤ ņ╣©ņČ£ņÜ®ņĢĪņŚÉ ĒÖ®ĒÖöļ¼╝ņØä ņ▓©Ļ░Ć ņŗ£ ļ░£ņāØĒĢśļŖö ņØ┤ņś©ņ╣śĒÖśņŚÉ ņØśĒĢ£ ĒÖ®ĒÖöļ¼╝ ņ╣©ņĀäļ▓Ģ(S2- + Cd2+ ŌåÆ CdS)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņ╣┤ļō£ļ«┤ņØä ļČäļ”¼ĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░ ĒÖ®ĒÖöļ¼╝ ņ▓©Ļ░Ćļ¤ēņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņ╣┤ļō£ļ«┤ ĒÜīņłśņ£©ņØ┤ Ē¢źņāüļÉ£ļŗż.
2) (NH4)2S/Cd = 2.0ņØś ļ╣äņ£©ļĪ£ ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ Ļ│╝ļ¤ēņØś NH4+ņØ┤ņś©ņØ┤ Ni2+ ņØ┤ņś©Ļ│╝ ļ░śņØæĒĢśņŚ¼ (NH4)2Ni(SO4)2┬Ę6H2OĻ░Ć ļéśĒāĆļé¼ņ£╝ļ®░, ņ╣©ņĀäļÉśļŖö ļŗłņ╝łņØś ņ¢æņØ┤ ņ”ØĻ░ĆĒĢśņŚ¼ ņ╣┤ļō£ļ«┤Ļ│╝ ļŗłņ╝łņØä ļČäļ”¼ĒĢśļŖöļŹ░ ņ¢┤ļĀżņøĆņØ┤ ņĪ┤ņ×¼ĒĢśņśĆļŗż.
3) FeS/Cd Ōēż 1.0ņØĖ Ļ▓ĮņÜ░ FeSņØś ņÜ®ĒĢ┤ļÅäņŚÉ ņØśĒĢ┤ ņØ┤ņś©ņ╣śĒÖśļ░śņØæņØ┤ ņØ╝ņ¢┤ļéśņ¦Ć ņĢŖĻ│Ā, ņ▓©Ļ░Ćļ¤ēņØä ņ”ØĻ░Ćņŗ£ņ╝£ļÅä ņ╣┤ļō£ļ«┤ ĒÜīņłśĻ░Ć ņÖäļŻīļÉśņ¦Ć ņĢŖņĢśļŗż.
4) Na2S ņ▓©Ļ░Ćļ¤ēņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņ╣©ņĀäļČäļ¦ÉņØś ļŗłņ╝ł ĒĢ©ļ¤ēņØĆ 9%ļĪ£ ņ”ØĻ░ĆĒĢśņśĆņ£╝ļéś ņØ┤ņ░©ņāüņØ┤ ņāØņä▒ļÉśņ¦Ć ņĢŖĻ│Ā, ļŗłņ╝ł-ņ╣┤ļō£ļ«┤ ņÜ®ņĢĪ ļé┤ņØś ņ╣┤ļō£ļ«┤ņØ┤ ļ¬©ļæÉ ĒÜīņłśļÉśņŚłļŗż.
5) ņÜ®ņĢĪņØś pHļŖö ĒÖ®ĒÖöļ¼╝ ņ▓©Ļ░Ćļ¤ēņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņ”ØĻ░ĆĒĢśņŚ¼ ņ╣©ņĀäļÉśļŖö ļŗłņ╝łņØś ņ¢æņØ┤ ņ”ØĻ░ĆĒĢśņśĆļŗż.
6) ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ļŗłņ╝łĻ│╝ ņ╣┤ļō£ļ«┤ņØä ļČäļ”¼ĒĢśĻĖ░ ņ£äĒĢ£ ĒÖ®ĒÖöļ¼╝ļĪ£ Na2SĻ░Ć Ļ░Ćņן ĒÜ©ņ£©ņĀüņØĖ ņ╣©ņĀäņĀ£ņ×äņØä ĒÖĢņØĖĒĢśņśĆļŗż.