1. ņä£ ļĪĀ
ņØ╝ļ░śņĀüņ£╝ļĪ£ ĻĖłĒĢ®ĻĖłņØä ņØ┤ņÜ®ĒĢ£ ņןņŗĀĻĄ¼ļŖö ņØĖļ▓ĀņŖżĒŖĖļ©╝ĒŖĖ ņŻ╝ņĪ░ļ▓Ģņ£╝ļĪ£ ņĀ£ņĪ░ļÉśļ®░, ņŻ╝ņĪ░ļÉ£ ņĀ£ĒÆł Ēæ£ļ®┤ņØś ļČĆļÅÖĒā£ļ¦ēņØä ĒÖöĒĢÖņĀüņ£╝ļĪ£ ņĀ£Ļ▒░ĒĢ£ Ēøä, ĻĖ░Ļ│äņĀüņØĖ ņŚ░ļ¦ł Ļ│ĄņĀĢņØä Ļ▒░ņ│É ņÖäņä▒ļÉ£ļŗż. Ēæ£ļ®┤ ļČĆļÅÖĒā£ļ¦ēņØä ņĀ£Ļ▒░ĒĢ┤ Ļ┤æĒāØņØä Ē¢źņāüņŗ£ĒéżļŖö Ļ│ĄņĀĢņØä ņŖżĒŖĖļ”¼ĒĢæ(stripping)ņØ┤ļØ╝Ļ│Ā ĒĢśļ®░, ņĄ£ĻĘ╝Ļ╣īņ¦Ć ņØ┤ Ļ│ĄņĀĢņŚÉ ņŗ£ņĢäļéśņØ┤ļō£ ņÜ®ņĢĪņØ┤ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż [1].
ņŗ£ņĢäļéśņØ┤ļō£ ņŖżĒŖĖļ”¼ĒĢæ(cyanide stripping)ņØĆ Ļ│╝ņé░ĒÖöņłśņåī(hydrogen peroxide)ļź╝ ņé░ĒÖöņĀ£, ņŗ£ņĢłĒÖöļéśĒŖĖļź©(sodium cyanide)ņØ┤ļéś ņŗ£ņĢłĒÖöņ╣╝ņŖś(potassium cyanide)ņØä ņ░®ļ¼╝ņĀ£ļĪ£ ņ▓©Ļ░ĆĒĢ£ ņÜ®ņĢĪņØä 90 ┬░C ņØ┤ņāüņ£╝ļĪ£ Ļ░ĆņŚ┤ Ēøä, ņŻ╝ņĪ░ļÉ£ ĻĖłĒĢ®ĻĖłņØä ņ╣©ņ¦Ćņŗ£ĒéżļŖö Ļ▓āņØ┤ļŗż [2]. ņØ┤ļ¤¼ĒĢ£ ņŗ£ņĢäļéśņØ┤ļō£ Ļ│ĄņĀĢņØĆ Au-CuĻ│ä ļģĖļ×Ćņāē ļ░Å ņĀüņāē ĻĖłĒĢ®ĻĖł ĻĘĖļ”¼Ļ│Ā Au-NiĻ│ä ļ░▒ņāē ĻĖłĒĢ®ĻĖłņØä 14 K, 18 K ļō▒ ņóģļźśņŚÉ ņāüĻ┤ĆņŚåņØ┤ ļÅÖņŗ£ņŚÉ ņ▓śļ”¼Ļ░Ć Ļ░ĆļŖźĒĢ£ ļ▓öņÜ®ņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż. ļśÉĒĢ£ ņĀĆļĀ┤ĒĢ£ Ļ│ĄņĀĢļ╣äņÜ®Ļ│╝ ļŗ©ņŗ£Ļ░ä ņ▓śļ”¼Ļ░Ć Ļ░ĆļŖźĒĢśĻ│Ā, ņÜ®ņČ£ļÉ£ AuņØś ĒÜīņłśņ£©ņØ┤ ļåÆņØĆ ņןņĀÉņ£╝ļĪ£ ļ¦ÄņØĆ ĻĄŁĻ░ĆņŚÉņä£ ņØ┤ņÜ®ĒĢśĻ│Ā ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņŗ£ņĢäļéśņØ┤ļō£ ņÜ®ņĢĪņØś ņ×Éņ▓┤ ņ£äĒŚśņä▒Ļ│╝ Ļ│ĄņĀĢ Ēøä ĒÖśĻ▓ĮņĀüņØĖ ļ¼ĖņĀ£ļĪ£ ņØ┤ļ»Ė ņ£Āļ¤Į ļō▒ņØś ņäĀņ¦äĻĄŁņŚÉņä£ļŖö ņé¼ņÜ®ņØ┤ ĻĖłņ¦ĆļÉśņŚłĻ│Ā, ņØ┤ļź╝ ļīĆņ▓┤ĒĢśĻĖ░ ņ£äĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ĒÖ£ļ░£ĒĢśļŗż.
ĻĖ░ņĪ┤ ņŗ£ņĢäļéśņØ┤ļō£ ņŖżĒŖĖļ”¼ĒĢæ ļīĆņ▓┤ Ļ│ĄņĀĢņ£╝ļĪ£ļŖö ĒĢĀļØ╝ņØ┤ļō£ ņŖżĒŖĖļ”¼ĒĢæ(halide stripping)Ļ│╝ Ēŗ░ņś¼ ĒÖöĒĢ®ļ¼╝ ņŖżĒŖĖļ”¼ĒĢæ(thiol compound stripping) ļ░®ļ▓ĢņØ┤ ņĀ£ņĢłļÉśņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ ļ░®ļ▓ĢļōżļÅä ņŗ£ņĢäļéśņØ┤ļō£ ņŖżĒŖĖļ”¼ĒĢæĻ│╝ ņ£Āņé¼ĒĢśĻ▓ī ņé░ĒÖöņĀ£ņÖĆ ņ░®ļ¼╝ņĀ£ļĪ£ ĻĄ¼ņä▒ļÉ£ ņŖżĒŖĖļ”¼ĒĢæ ņÜ®ņĢĪņ£╝ļĪ£ ņŻ╝ņĪ░ņ¦üĒøä ĻĖłĒĢ®ĻĖłņØś ļČĆļÅÖĒā£ļ¦ēņØä ņĀ£Ļ▒░ĒĢ£ļŗż [3]. ĒĢĀļØ╝ņØ┤ļō£ ņŖżĒŖĖļ”¼ĒĢæņØĆ ņ░®ļ¼╝ņĀ£ļĪ£ ĒĢĀļĪ£Ļ▓É(halogen) ĒÖöĒĢ®ļ¼╝ņØä ņé¼ņÜ®ĒĢśļŖö ļ░®ļ▓Ģņ£╝ļĪ£, ĒĢĀļĪ£Ļ▓É ĒÖöĒĢ®ļ¼╝ļĪ£ļČĆĒä░ ņāØņä▒ļÉ£ ĒĢĀļĪ£Ļ▓É ņØ┤ņś©ņØ┤ ĻĖłņåŹ ņ░®ļ¼╝ņØä ĒśĢņä▒ĒĢ£ļŗż. Baghalha ļō▒[4]ņØĆ ĒĢśņØ┤ĒżņĢäņŚ╝ņåīņé░(hypochlorite)ņØä ņé░ĒÖöņĀ£, ņŚ╝ĒÖöņåīļōÉ(sodium chloride)ņØä ņ░®ļ¼╝ņĀ£ļĪ£ ņ▒äņÜ®ĒĢśņŚ¼ ņĄ£ņĀü ņĪ░Ļ▒┤ņŚÉņä£ļŖö ĻĖ░ņĪ┤ ņŗ£ņĢäļéśņØ┤ļō£ ņŖżĒŖĖļ”¼ĒĢæ ļ│┤ļŗż ļ░śņØæņåŹļÅäĻ░Ć ļ╣ĀļźĖ ņןņĀÉņØä ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļéś, Ļ│ĄņĀĢ ņżæ ņ£ĀļÅģĒĢ£ ņŚ╝ņåīĻ░ĆņŖżĻ░Ć ļ░®ņČ£ļÉśļŖö ļ¼ĖņĀ£Ļ░Ć ņ׳ņŚłļŗż [5]. Seisko ļō▒[6]ņØĆ ņ£ĀļÅģĻ░ĆņŖżĻ░Ć ļ░®ņČ£ļÉśļŖö ļ¼ĖņĀ£ļź╝ ĒĢ┤Ļ▓░ĒĢśĻĖ░ ņ£äĒĢ┤ Fe3+ņÖĆ Cu2+ ņé░ĒÖöņĀ£, ņŚ╝ĒÖöņåīļōÉņØä ņ░®ļ¼╝ņĀ£ļĪ£ ņ▒äņÜ®ĒĢśņśĆņ£╝ļéś, 95 ┬░CņŚÉņä£ ņł£ņłśĒĢ£ AuņØś ņŖżĒŖĖļ”¼ĒĢæ ņåŹļÅäĻ░Ć ĻĖ░ņĪ┤ ņŗ£ņĢäļéśņØ┤ļō£ Ļ│ĄņĀĢņŚÉ ļ╣äĒĢ┤ 1/10ļĪ£ Ļ░ÉņåīĒĢśļŖö ļ¼ĖņĀ£Ļ░Ć ņ׳ņŚłļŗż [7]. ļö░ļØ╝ņä£ ĒĢĀļØ╝ņØ┤ļō£ ņŖżĒŖĖļ”¼ĒĢæņØĆ ņ£ĀļÅģĻ░ĆņŖżļ░£ņāØĻ│╝ Ļ│ĄņĀĢņŗ£Ļ░äņØś ņ”ØĻ░ĆļĪ£ ņŗ£ņĢäļéśņØ┤ļō£ļź╝ ļīĆņ▓┤ĒĢśļŖöļŹ░ ĒĢ£Ļ│äĻ░Ć ņ׳ļŗż.
Ēŗ░ņś¼ ĒÖöĒĢ®ļ¼╝ ņŖżĒŖĖļ”¼ĒĢæņØĆ ņ░®ļ¼╝ņĀ£ļĪ£ Ēŗ░ņśżĒÖ®ņé░(thiosulfate), Ēŗ░ņśżņÜ░ļĀłņĢä(thiourea) Ļ░ÖņØĆ ĒÖöĒĢ®ļ¼╝ņØä ņ▒äņÜ®ĒĢ£ Ļ▓āņ£╝ļĪ£, Au ņØ┤ņś©Ļ│╝ Ļ░ĢĒĢ£ ņ░®ļ¼╝ņØä ĒśĢņä▒ĒĢ£ļŗż. Ēŗ░ņśżĒÖ®ņé░ņØä ņØ┤ņÜ®ĒĢ£ ļ░®ļ▓Ģņ£╝ļĪ£ Muir ļō▒[8]ņØ┤ Cu2+ ņé░ĒÖöņĀ£, Ēŗ░ņśżĒÖ®ņé░ņŚ╝ņØä ņ░®ļ¼╝ņĀ£ļĪ£ ņ▒äņÜ®ĒĢ£ Ļ│ĄņĀĢņØä ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļ®░, ņØ┤ Ļ│ĄņĀĢņØĆ ņłśņåīņØ┤ņś©ļåŹļÅä(pH) 6-10ņØś ņĪ░Ļ▒┤ņŚÉņä£ ļ░śņØæĒĢśņŚ¼ ļ╣äĻĄÉņĀü ņĢłņĀäĒĢśļŗż. ĻĘĖļ¤¼ļéś ņł£ņłśĒĢ£ AuņØś Ļ▓ĮņÜ░ ņÜ®ņČ£ņåŹļÅäĻ░Ć ĻĖ░ņĪ┤ ņŗ£ņĢäļéśņØ┤ļō£ ņŖżĒŖĖļ”¼ĒĢæņØś 1/5 ņĀĢļÅäļĪ£ ļŖÉļĀżņä£ ņŗżņĀ£ Ļ│ĄņĀĢņ£╝ļĪ£ ņĀüņÜ®ĒĢśļŖöļŹ░ ĒĢ£Ļ│äĻ░Ć ņ׳ņŚłļŗż [9].
Ēŗ░ņśżņÜ░ļĀłņĢäļź╝ ņé¼ņÜ®ĒĢśļŖö ļ░®ļ▓Ģņ£╝ļĪ£ Li ļō▒[10]ņØ┤ Au ļÅäĻĖłļÉ£ ņĀäņ×ÉņĀ£ĒÆłņŚÉņä£ Auļź╝ ņČöņČ£ĒĢśļŖöļŹ░, Fe3+ ņé░ĒÖöņĀ£, Ēŗ░ņśżņÜ░ļĀłņĢäļź╝ ņ░®ļ¼╝ņĀ£ļĪ£ ņ▒äņÜ®ĒĢ£ Ļ│ĄņĀĢņØä ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ļŗż. ņØ┤ Ļ│ĄņĀĢņØĆ ņ£ĀļÅģĻ░ĆņŖżĻ░Ć ļ░£ņāØĒĢśņ¦Ć ņĢŖņ£╝ļ®░, ņĄ£ņĀü ņĪ░Ļ▒┤ņØĖ pH 2ņŚÉņä£ļŖö ņŗ£ņĢäļéśņØ┤ļō£ ņŖżĒŖĖļ”¼ĒĢæļ│┤ļŗż ļ░śņØæņåŹļÅäĻ░Ć ļ╣©ļØ╝ņä£, ņŗ£ņĢäļéśņØ┤ļō£ ņŖżĒŖĖļ”¼ĒĢæņØä ļīĆņ▓┤ĒĢĀ ņłś ņ׳ļŖö Ļ░ĆļŖźņä▒ņØä ļ│┤ņśĆļŗż.
ĻĘĖļ¤¼ļéś Ēŗ░ņśżņÜ░ļĀłņĢäļź╝ ņé¼ņÜ®ĒĢ£ ņŖżĒŖĖļ”¼ĒĢæ Ļ│ĄņĀĢņØś Ļ▓ĮņÜ░, ĻĖłņåŹņŚÉ ĒĢ©ņ£ĀļÉ£ ņä▒ļČäņŚÉ ļö░ļØ╝ ĻĖłņåŹĒÖ®ĒÖöļ¼╝ņØ┤ ĒśĢņä▒ļÉśļŖö ļ¼ĖņĀ£Ļ░Ć ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ņ£╝ļ®░, So ļō▒[11]ņØ┤ Ag ļÅäĻĖłļÉ£ ņĀäņ×ÉņĀ£ĒÆłņØś Ēŗ░ņśżņÜ░ļĀłņĢäļź╝ ņØ┤ņÜ®ĒĢ£ ņŖżĒŖĖļ”¼ĒĢæ Ļ│ĄņĀĢņŚÉņä£ Ag ĒÖ®ĒÖöļ¼╝ņØ┤ ņāØņä▒ļÉśļŖö ļ¼ĖņĀ£ļź╝ ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļśÉĒĢ£ Lin ļō▒[12]ņØĆ Au-Ni-Cu ļÅäĻĖłņĖĄņØä Ēŗ░ņśżņÜ░ļĀłņĢäļĪ£ ņŖżĒŖĖļ”¼ĒĢæĒĢśļŖö Ļ│╝ņĀĢņŚÉņä£ Ļ▓ĆņØĆņāēņØś ĻĖłņåŹĒÖ®ĒÖöļ¼╝ņØ┤ ĒśĢņä▒ļÉśļŖö ļ¼ĖņĀ£ļź╝, Mohanty ļō▒[13]ņØĆ Ēŗ░ņśżņÜ░ļĀłņĢäļź╝ ņØ┤ņÜ®ĒĢ£ Ni ņĀäĻĖ░ļÅäĻĖłņŗżĒŚśņŚÉņä£ ņĀäĻĘ╣ļČĆļČäņŚÉ ņ╣śļ░ĆĒĢ£ NiSĻ░Ć ĒśĢņä▒ļÉśļŖö ļ¼ĖņĀ£ļź╝ ĒÖĢņØĖĒĢ£ ļ░ö ņ׳ļŗż.
ņØ┤ļ¤¼ĒĢ£ ĻĖłņåŹĒÖ®ĒÖöļ¼╝ ņāØņä▒ņØä ļ░®ņ¦ĆĒĢśĻĖ░ ņ£äĒĢ┤ ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ņ£ĀĻĖ░Ļ│äļ®┤ĒÖ£ņä▒ņĀ£ļź╝ ņ▒äņÜ®ĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż. Feng ļō▒ [14]ņØĆ ņĀĆĒÆłņ£ä ĻĖłņøÉĻ┤æ(gold ore)ņØä Ēŗ░ņśżĒÖ®ņé░ ņÜ®ņĢĪņ£╝ļĪ£ ņŖżĒŖĖļ”¼ĒĢæ ņŗ£, ņ╣┤ļ│Ąņŗ£ļ®öĒŗĖ ņģĆļŻ░ļĪ£ņśżņŖż(carboxymethyl cellulose) Ļ│äļ®┤ĒÖ£ņä▒ņĀ£ļź╝ ņ▓©Ļ░ĆĒĢśņŚ¼ ĻĖłņåŹĒÖ®ĒÖöļ¼╝ņØś ĒśĢņä▒ņØä ņ¢ĄņĀ£ĒĢĀ ņłś ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. Dutta ļō▒[15]ņØĆ Ēŗ░ņśżņÜ░ļĀłņĢäņÖĆ ĻĄ¼ļ”¼ņØ┤ņś©ņØś ļ░śņØæņŚÉņä£ SDSļź╝ ņ▒äņÜ®ĒĢśņŚ¼ ĻĖłņåŹĒÖ®ĒÖöļ¼╝ņØś ņ╣©ņĀäņØä ņ¢ĄņĀ£ĒĢśņśĆļŗż. ĻĘĖļ¤¼ļéś Ēŗ░ņśżĒÖ®ņé░ņØĆ ļ░śņØæņåŹļÅäĻ░Ć ļŖÉļ”░ ļ¼ĖņĀ£ļź╝, Ēŗ░ņśżņÜ░ļĀłņĢäņØś Ļ▓ĮņÜ░ NiņØ┤ ĒżĒĢ©ļÉ£ ĒĢ®ĻĖłņŚÉņä£ ĻĖłņåŹĒÖ®ĒÖöļ¼╝ņØ┤ ņāØņä▒ļÉśļŖö ļ¼ĖņĀ£ļź╝ ĒĢ┤Ļ▓░ĒĢśņ¦Ć ļ¬╗ Ē¢łļŗż.
ņØ┤ņÖĆ Ļ░ÖņØ┤ Ēŗ░ņśżņÜ░ļĀłņĢä ņŖżĒŖĖļ”¼ĒĢæņØĆ ņÜ░ņłśĒĢ£ ļ░śņØæņåŹļÅäļĪ£ ņØĖĒĢ┤ ĻĖ░ņĪ┤ ņŗ£ņĢäļéśņØ┤ļō£ ņŖżĒŖĖļ”¼ĒĢæņØä ļīĆņ▓┤ĒĢśļŖö ņŚ¼ļ¤¼ ļ░®ņĢłņ£╝ļĪ£ Ļ░Ćņן ņ£ĀļĀźĒĢśļŗż. ĒŖ╣Ē׳ NiĻ│ä-ļ░▒ņāē ĻĖłĒĢ®ĻĖłņŚÉ ņĀüņÜ®ļÉĀ ļĢī ĒØæņāē ļŗłņ╝łĒÖ®ĒÖöļ¼╝ņØ┤ ņāØņä▒ļÉśļŖö ļ¼ĖņĀ£ļ¦ī ĒĢ┤Ļ▓░ļÉ£ļŗżļ®┤ ņŗ£ņĢäļéśņØ┤ļō£ ņŖżĒŖĖļ”¼ĒĢæĻ│╝ Ļ░ÖņØ┤ ļģĖļ×Ćņāē, ņĀüņāē ĻĖłĒĢ®ĻĖłņØĆ ļ¼╝ļĪĀņØ┤Ļ│Ā ļ░▒ņāē ĻĖłĒĢ®ĻĖłĻ╣īņ¦Ć ļ▓öņÜ®ņĀüņ£╝ļĪ£ ņé¼ņÜ®ļÉĀ ņłś ņ׳ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö NiĻ│ä-14K ļ░▒ņāē ĻĖłĒĢ®ĻĖłņŚÉ ļīĆĒĢ£ Ēŗ░ņśżņÜ░ļĀłņĢä ņŖżĒŖĖļ”¼ĒĢæņØś ņĀüņÜ® Ļ░ĆļŖźņä▒ņØä ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤, Ļ│äļ®┤ĒÖ£ņä▒ņĀ£ņØĖ SDSņØś ĒĢ©ļ¤ēņØä ļŗ¼ļ”¼ĒĢśļ®░ ļŗłņ╝łĒÖ®ĒÖöļ¼╝ ņāØņä▒ ņŚåņØ┤ ņŖżĒŖĖļ”¼ĒĢæ Ļ░ĆļŖźĒĢ£ ņĪ░Ļ▒┤ņØä ĒÖĢņØĖĒĢśņśĆļŗż.
2. ņŗżĒŚśļ░®ļ▓Ģ
ņäØĻ│Āļ¬░ļō£ļź╝ ņØ┤ņÜ®ĒĢ£ ņØĖļ▓ĀņŖżĒŖĖļ©╝ĒŖĖ ņŻ╝ņĪ░ļ▓Ģņ£╝ļĪ£ ņĀ£ņ×æļÉ£ Ļ░ĆļĪ£, ņäĖļĪ£, ļåÆņØ┤Ļ░Ć Ļ░üĻ░ü 5 mm, 5 mm, 1 mmņØĖ ņןļ░®ĒśĢ NiĻ│ä-14 K ļ░▒ņāē ĻĖłĒĢ®ĻĖłņØä ņĀ£ņ×æĒĢśņśĆļŗż. ņØ┤ļĢī ĻĖłĒĢ®ĻĖłņØś ņĪ░ņä▒ņØĆ Cu 29.05, Zn 7.05, Ni 5.40, Au 58.50 wt%Ļ░Ć ļÉśļÅäļĪØ ņżĆļ╣äĒĢśņŚ¼, NiņØ┤ ļ░▒ņāē ĻĖłĒĢ®ĻĖłņØś ņŻ╝ņÜöļ░£ņāēņøÉņåīĻ░Ć ļÉśļÅäļĪØ ĒĢśņśĆļŗż.
Ēæ£ 1ņŚÉļŖö SDS ĒĢ©ļ¤ēņØä ļŗ¼ļ”¼ĒĢśņŚ¼ ņĀ£ņ×æĒĢ£ ņŖżĒŖĖļ”¼ĒĢæ ņÜ®ņĢĪņØś ņĪ░ņä▒ņØä ļéśĒāĆļé┤ņŚłņ£╝ļ®░, pHļŖö ĒÖ®ņé░ņØä ņØ┤ņÜ®ĒĢśņŚ¼ 2ļĪ£ ņĪ░ņĀłĒĢśņśĆļŗż. ņżĆļ╣äļÉ£ ņÜ®ņĢĪ 20 mlņŚÉ 14 K ļ░▒ņāē ĻĖłĒĢ®ĻĖłņØä ņ╣©ņ¦ĆĒĢśĻ│Ā 50 ┬░CņŚÉņä£ 5 ļČä ņ┤łņØīĒīī ĻĄÉļ░ś Ēøä 28% Ļ│╝ņé░ĒÖöņłśņåī ņłśņÜ®ņĢĪ 3 mlļź╝ ņ▓©Ļ░ĆĒĢśĻ│Ā 1 ļČäĻ░ä ņČöĻ░ĆļĪ£ ĻĄÉļ░śĒĢśņśĆļŗż.
ņŖżĒŖĖļ”¼ĒĢæ ņĀäĒøä ņ£ĪņĢł ļ│ĆĒÖöļŖö Ļ┤æĒĢÖĒśäļ»ĖĻ▓Į(815000, GIA Instrument Co.)ņØä ņØ┤ņÜ®ĒĢśņśĆļŗż. ļČĆļÅÖĒā£ļ¦ēņØś ļ│ĆĒÖöļŖö ļØ╝ļ¦īļČäĻ┤æĻĖ░(UniRaman, Unithink)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, ņØ┤ļĢī Ļ┤æņøÉņØĆ 531 nmņØä ņ▒äņÜ®ĒĢśĻ│Ā, 30 ņ┤ł ļÅÖņĢł ļģĖĻ┤æĒĢśņŚ¼ 10 ĒÜī ļ░śļ│Ą ņĖĪņĀĢĒĢśņśĆļŗż.
SDSĒĢ©ļ¤ēņŚÉ ļö░ļźĖ ņŖżĒŖĖļ”¼ĒĢæ Ēøä ĒĢ®ĻĖłņØś ļ¼┤Ļ▓īļ│ĆĒÖöļŖö ņĀĢļ░ĆņĀĆņÜĖ(AS60/220/C/2, Radwag)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ 1.0 ├Ś 10-5 gĻ╣īņ¦ĆņØś ļ¼┤Ļ▓ī ļ│ĆĒÖöļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ļ¼┤Ļ▓īĻ░Éņåīņ£©ņØĆ ņŖżĒŖĖļ”¼ĒĢæ ņĀäĒøä ĒĢ®ĻĖłņØś ļ¼┤Ļ▓īļ│ĆĒÖöļź╝ ļ░▒ļČäņ£©ļĪ£ Ļ│äņé░ĒĢśņśĆļŗż.
ņŖżĒŖĖļ”¼ĒĢæ ņĀäĒøä ļ»ĖņäĖĻĄ¼ņĪ░ ļ│ĆĒÖöņÖĆ ņøÉņåī ņĪ░ņä▒ņØĆ ņŻ╝ņé¼ĒśĢņĀäņ×É Ēśäļ»ĖĻ▓Į(FE-SEM, S-4300, Hitachi)Ļ│╝ ņŚÉļäłņ¦ĆļČäņé░XņäĀļČäĻ┤æĻĖ░(EDS, JSM-6010PLUS/LA, Jeol)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļČäņäØĒĢśņśĆļŗż.
SDSĒĢ©ļ¤ēņŚÉ ļö░ļźĖ ņĀäĻĖ░ĒÖöĒĢÖņĀü ĒŖ╣ņä▒ņØĆ ņāüņś©ņŚÉņä£ 3ĻĘ╣ ņĀäĻĖ░ĒÖöĒĢÖņģĆ(Digi-Ivy, Austin TX)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņäĀĒśĢņŻ╝ņé¼ņĀäņĢĢļ▓Ģ(liner sweep voltammetry, LSV)ņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż. ņØ┤ļĢī Ag/AgCl ņĀäĻĘ╣, ļ░▒ĻĖłņÖĆņØ┤ņ¢┤, 14 K ļ░▒ņāē ĻĖłĒĢ®ĻĖł ņŗ£ĒÄĖņØä Ļ░üĻ░ü ĻĖ░ņżĆņĀäĻĘ╣, ņāüļīĆņĀäĻĘ╣, ņ×æņŚģņĀäĻĘ╣ņ£╝ļĪ£ ņé¼ņÜ®Ē¢łņ£╝ļ®░, ņĀäĒĢ┤ņ¦łņØĆ Ēæ£ 1ņØś ņĪ░ņä▒Ļ│╝ ļÅÖņØ╝ĒĢśĻ▓ī ņżĆļ╣äĒĢśņśĆļŗż. ņżĆļ╣äļÉ£ ņŗ£ĒÄĖņØś ņ×æņŚģ ņĀäĻĘ╣ņØĆ -0.2 VļČĆĒä░ +0.8 V Ļ╣īņ¦Ć ņĀäņ£ä(potential)ļź╝ 1 mV/sļĪ£ ņåŹļÅäļĪ£ ņØĖĻ░Ćņŗ£Ēéżļ®┤ņä£ ņé░ĒÖöņĀäļźśļ░ĆļÅäļź╝ ņĖĪņĀĢĒĢśņśĆļŗż.
3. Ļ▓░Ļ│╝ ļ░Å Ļ│Āņ░░
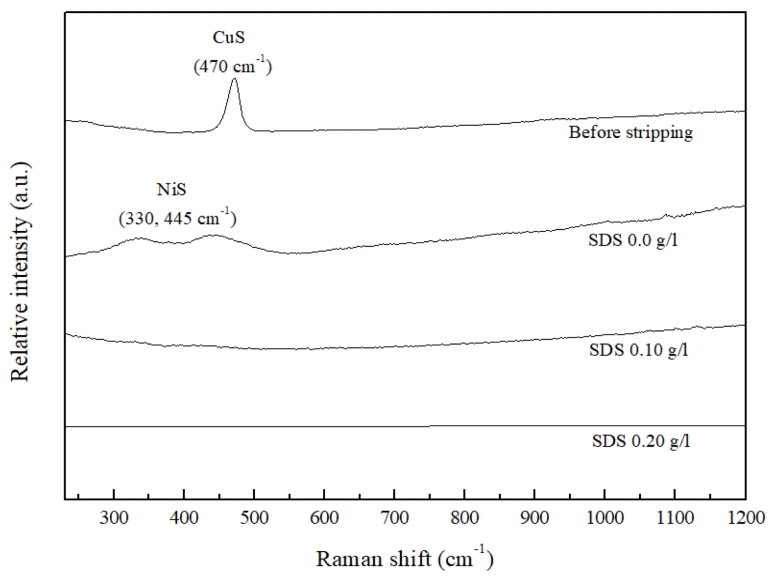
ĻĘĖļ”╝ 1ņØĆ ņŖżĒŖĖļ”¼ĒĢæ ņĀäĻ│╝ ņŖżĒŖĖļ”¼ĒĢæ Ēøä SDS ĒĢ©ļ¤ēņŚÉ ļö░ļźĖ ņŗ£ĒÄĖņØś ņ£ĪņĢł ļČäņäØ ņØ┤ļ»Ėņ¦ĆņØ┤ļŗż. ĻĘĖļ”╝ 1 (a)ļŖö ņŻ╝ņĪ░ ņ¦üĒøä ņŗ£ĒÄĖņØś ņØ┤ļ»Ėņ¦ĆļĪ£, Ļ┤æĒāØņØ┤ ņŚåļŖö ņ¢┤ļæÉņÜ┤ ĒÜīņāē Ēæ£ļ®┤ņØä ĒÖĢņØĖĒĢśņśĆļŗż. ĻĘĖļ”╝ 1 (b)ļŖö SDSĻ░Ć ņ▓©Ļ░ĆļÉśņ¦Ć ņĢŖņØĆ ņŖżĒŖĖļ”¼ĒĢæ ņÜ®ņĢĪņ£╝ļĪ£ ņ▓śļ”¼ĒĢ£ ņŗ£ĒÄĖ ņØ┤ļ»Ėņ¦ĆņØ┤ļ®░, Ēæ£ļ®┤ņŚÉ Ļ▓ĆņØĆņāē ļ¦ēņØ┤ ĒśĢņä▒ļÉśņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ ĒśäņāüņØĆ Mohanty ļō▒[13]ņØ┤ ļ│┤Ļ│ĀĒĢ£ Ēŗ░ņśżņÜ░ļĀłņĢäņÖĆ NiņØ┤ ļ░śņØæĒĢśņŚ¼ ņ╣śļ░ĆĒĢ£ Ļ▓ĆņØĆ Ēö╝ļ¦ēņØä ĒśĢņä▒ĒĢ£ļŗżļŖö Ļ▓░Ļ│╝ņÖĆ ņØ╝ņ╣śĒĢśņśĆļŗż.
ĻĘĖļ”╝ 1 (c), (d), (e), (f)ņŚÉļŖö Ļ░üĻ░ü SDSĻ░Ć 0.05, 0.10, 0.15, 0.20 g/L ņ▓©Ļ░ĆļÉ£ ņÜ®ņĢĪņ£╝ļĪ£ ņŖżĒŖĖļ”¼ĒĢæ ĒĢ£ Ļ▓░Ļ│╝ļź╝ ļéśĒāĆļé┤ņŚłļŗż. ĻĘĖļ”╝ 1 (c)ņŚÉ ļéśĒāĆļéĖ SDS 0.05 g/L ņ▓©Ļ░ĆĒĢ£ Ļ▓ĮņÜ░ļŖö Ēæ£ļ®┤ņØ┤ ļŗżņåī ņ¢┤ļæÉņøĀņ£╝ļéś, SDS ĒĢ©ļ¤ēņØ┤ (d)ņÖĆ Ļ░ÖņØ┤ 0.10 g/LļĪ£ ņ”ØĻ░ĆĒĢśļ®┤ ļ░▒ņāēĻ░ÉĻ│╝ Ļ┤æĒāØĻ░ÉņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā, SDSĻ░Ć 0.15 g/L ņØ┤ņāü ņ▓©Ļ░ĆļÉśļŖö Ļ▓ĮņÜ░ (e), (f)ņÖĆ Ļ░ÖņØ┤ Ēæ£ļ®┤ ņĀäņ▓┤Ļ░Ć Ļ┤æĒāØņØ┤ ņ׳ļŖö ņØĆļ░▒ņāēņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. ņ”ē, Ēŗ░ņśżņÜ░ļĀłņĢä ņŖżĒŖĖļ”¼ĒĢæ Ļ│ĄņĀĢņŚÉ SDS ņ▓©Ļ░Ćļ¤ēņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ Ļ▓ĆņØĆ ļČĆņé░ļ¼╝ņØś ĒśĢņä▒ņØ┤ ņ¢ĄņĀ£ļÉśņŚłļŗż.
ĻĘĖļ”╝ 2ļŖö ņŻ╝ņĪ░ ņ¦üĒøäņÖĆ ņŖżĒŖĖļ”¼ĒĢæ Ēøä 14 K ļ░▒ņāē ĻĖłĒĢ®ĻĖł ņŗ£ĒÄĖņØś ļØ╝ļ¦ī ļČäņäØĻ▓░Ļ│╝ņØ┤ļŗż. ņāüļŗ©ļČĆĒä░ ņŖżĒŖĖļ”¼ĒĢæ ņĀä, SDSĻ░Ć ņ▓©Ļ░ĆļÉśņ¦Ć ņĢŖņØĆ ņÜ®ņĢĪ, ĻĘĖļ”¼Ļ│Ā SDSĻ░Ć 0.10, 0.20 g/L ņ▓©Ļ░ĆļÉ£ ņÜ®ņĢĪņ£╝ļĪ£ ņŖżĒŖĖļ”¼ĒĢæ ĒĢ£ ņŗ£ĒÄĖņØś ļØ╝ļ¦ī Ļ▓░Ļ│╝ļź╝ ļéśĒāĆļé┤ņŚłļŗż.
ņŻ╝ņĪ░ņ¦üĒøäņŚÉļŖö Ļ░ĢĒĢ£ CuS Ēö╝Ēü¼Ļ░Ć ĒÖĢņØĖļÉśņŚłņ£╝ļ®░, ņØ┤ļŖö Ingo ļō▒[16]ņØ┤ ļ│┤Ļ│ĀĒĢ£ ļ░öņÖĆ Ļ░ÖņØ┤ ĒÖśņøÉĒżĒģÉņģ£(reduction potential)ņØ┤ ļé«ņØĆ CuĻ░Ć ņŻ╝ņĪ░Ļ│╝ņĀĢ ņżæ ņé░ĒÖöļÉśļ®┤ņä£ Ēæ£ļ®┤ļČĆņŚÉ ļČĆļÅÖĒā£ļ¦ēņØä ĒśĢņä▒ĒĢ£ļŗżļŖö ļ│┤Ļ│ĀņÖĆ ņØ╝ņ╣śĒĢśņśĆļŗż. SDSĻ░Ć ņ▓©Ļ░ĆļÉśņ¦Ć ņĢŖņØĆ ņŖżĒŖĖļ”¼ĒĢæ ņÜ®ņĢĪņ£╝ļĪ£ ņ▓śļ”¼ĒĢ£ ņŗ£ĒÄĖņØś Ļ▓ĮņÜ░, CuS Ēö╝Ēü¼ļŖö ĒÖĢņØĖļÉśņ¦Ć ņĢŖņĢśĻ│Ā, NiS Ēö╝Ēü¼ļ¦ī ĒÖĢņØĖļÉśņŚłļŗż. ņ”ē, ņŖżĒŖĖļ”¼ĒĢæņØä ĒåĄĒĢ┤ ņŻ╝ņĪ░ņ¦üĒøäņØś CuS ļČĆļÅÖĒā£ļ¦ēņØĆ ņĀ£Ļ▒░ļÉśņŚłņ¦Ćļ¦ī, ņāłļĪ£ņÜ┤ NiS ļČĆņé░ļ¼╝ļ¦ēņØ┤ ņāØņä▒ļÉśņŚłļŗż. ņØ┤ļŖö ņĢ×ņä£ ĻĘĖļ”╝ 1 (b)ņŚÉņä£ ĒÖĢņØĖĒĢ£ Ļ▓ĆņØĆņāē ļ¦ēņØ┤ NiSļØ╝ļŖö Ļ▓āņØä ņØśļ»ĖĒĢśļ®░, ņØ┤ļ¤¼ĒĢ£ ĒśäņāüņØĆ Ēŗ░ņśżņÜ░ļĀłņĢäņØś ņ×ÉĻĖ░ļČäĒĢ┤ļĪ£ ņāØņä▒ļÉ£ ĒÖ®ĒÖöļ¼╝ņØ┤ ĻĖłĒĢ®ĻĖł Ēæ£ļ®┤ņŚÉ ņÜ®ņČ£ļÉ£ Ni ņØ┤ņś©Ļ│╝ ļ░śņØæĒĢśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż [17].
SDS 0.10, 0.20 g/L ņ▓©Ļ░ĆļÉ£ ņÜ®ņĢĪņ£╝ļĪ£ ņŖżĒŖĖļ”¼ĒĢæļÉ£ ņŗ£ĒÄĖņŚÉļŖö CuS, NiS ļ¬©ļæÉ ļéśĒāĆļéśņ¦Ć ņĢŖņĢśļŗż. ņØ┤ļŖö SDSņØś ņ░ĖĻ░ĆĻ░Ć CuS ļČĆļÅÖĒā£ļ¦ē ņĀ£Ļ▒░ņŚÉļŖö ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖņ£╝ļ®░, NiS Ēö╝ļ¦ē ĒśĢņä▒ņØä ņ¢ĄņĀ£ĒĢśļŖö Ļ▓āņØä ņØśļ»ĖĒĢ£ļŗż.
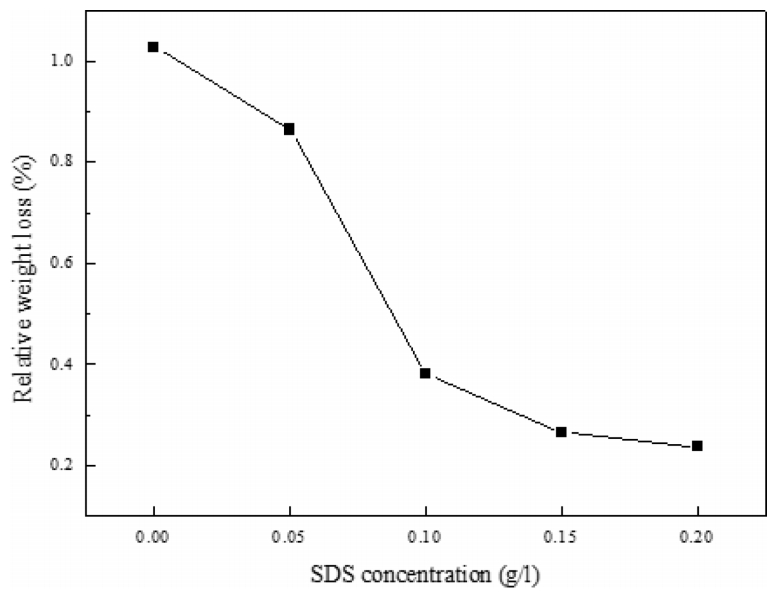
ĻĘĖļ”╝ 3ņŚÉļŖö SDS ĒĢ©ļ¤ēņŚÉ ļö░ļźĖ 14 K ļ░▒ņāē ĻĖłĒĢ®ĻĖł ņŗ£ļŻīņØś ļ¼┤Ļ▓īĻ░Éņåīņ£©ņØä ļéśĒāĆļé┤ņŚłļŗż. SDSļź╝ ņ▓©Ļ░ĆĒĢśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ ļ¼┤Ļ▓īĻ░Éņåīņ£©ņØĆ 1.1%ļĪ£ ļéśĒāĆļé¼ņ£╝ļéś, SDS ĒĢ©ļ¤ēņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ļ¼┤Ļ▓īĻ░Éņåīņ£©ņØ┤ ņ×æņĢäņ¦ĆļŗżĻ░Ć SDS 0.15 g/L ņØ┤Ēøä ņĢĮ 0.2%ļĪ£ ņłśļĀ┤ĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļŖö ņØīņØ┤ņś©ņä▒ Ļ│äļ®┤ĒÖ£ņä▒ņĀ£ņØĖ SDSĻ░Ć ĒĢ®ĻĖłņØś Ēæ£ļ®┤ņŚÉ ĒØĪņ░®ļÉśņ¢┤ ņŖżĒŖĖļ”¼ĒĢæņŚÉ ņØśĒĢ£ ļ░▒ņāē ĻĖłĒĢ®ĻĖłĻ│╝ ņé░ĒÖöņĀ£Ļ░ä ļĀłļÅģņŖż ļ░śņØæņØä ņ░©ļŗ©ĒĢśĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ĒīÉļŗ©ĒĢśņśĆņ£╝ļ®░, ņØ┤ļŖö Soares ļō▒[18]ņØ┤ ļ│┤Ļ│ĀĒĢ£ ļ░öņÖĆ ņØ╝ņ╣śĒĢśņśĆļŗż.
ļö░ļØ╝ņä£ NiĻ│ä-14 K ļ░▒ņāē ĻĖłĒĢ®ĻĖłņØś ņŖżĒŖĖļ”¼ĒĢæ ņŗ£ 0.15 g/L ņØ┤ņāü ņ▓©Ļ░ĆĒĢśļŖö Ļ▓āņØ┤ ļČĆļÅÖĒā£ļ¦ēņØś ņĀ£Ļ▒░ņÖĆ ļ¼┤Ļ▓īĻ░Éņåīņ£© ļ®┤ņŚÉņä£ ļ░öļ×īņ¦üĒĢśņśĆļŗż.
ļśÉĒĢ£, ņŗżņĀ£ ņןņŗĀĻĄ¼ ņĀ£ĒÆłņØś ņāØņé░Ļ│╝ņĀĢņŚÉņä£ ņŖżĒŖĖļ”¼ĒĢæņ£╝ļĪ£ ņØĖĒĢ£ ĻĖłĒĢ®ĻĖłņØś ļ¼┤Ļ▓īĻ░ÉņåīĻ░Ć ņ”ØĻ░ĆĒĢśĻ▓ī ļÉśļ®┤ ņÜ®ņČ£ļÉśļŖö ĻĖłņØś ņ¢æļÅä ņ”ØĻ░ĆļÉśņ¢┤ Ļ▓ĮņĀ£ņĀüņ£╝ļĪ£ ļČłļ”¼ĒĢśņ¦Ćļ¦ī, SDSĻ░Ć ņ▓©Ļ░ĆļÉ£ ņŖżĒŖĖļ”¼ĒĢæ Ļ│ĄņĀĢņŚÉņä£ļŖö ņżæļ¤ē ņåÉņŗżņØä 1/5ļĪ£ ņżäņØ╝ ņłś ņ׳ņ¢┤ Ļ▓ĮņĀ£ņĀüņ£╝ļĪ£ ņ£Āļ”¼ĒĢ£ Ļ│ĄņĀĢņ×äņØä ĒÖĢņØĖĒĢśņśĆļŗż [19].
ĻĘĖļ”╝ 4ņŚÉļŖö ņŻ╝ņĪ░ņ¦üĒøäņÖĆ ņŖżĒŖĖļ”¼ĒĢæ ĒøäņØś 14 K ļ░▒ņāē ĻĖłĒĢ®ĻĖł ņŗ£ĒÄĖņØś ļ»ĖņäĖĻĄ¼ņĪ░ļź╝ ļéśĒāĆļé┤ņŚłļŗż. ĻĘĖļ”╝ 4 (a)ļŖö ņŻ╝ņĪ░ņ¦üĒøä ņŗ£ĒÄĖ Ēæ£ļ®┤ņØś SEM ņØ┤ļ»Ėņ¦ĆļĪ£, P1ņ£╝ļĪ£ Ēæ£ņŗ£ĒĢ£ ļ░ØņØĆ ļČĆļČäĻ│╝ P2ļĪ£ Ēæ£ņŗ£ĒĢ£ ņ¢┤ļæÉņÜ┤ ļČĆļČäņØ┤ ņĪ┤ņ×¼ĒĢśļŖö ļ»ĖņäĖĻĄ¼ņĪ░ļź╝ ĒÖĢņØĖĒĢśņśĆļŗż. ņØ┤ļŖö ĻĘĖļ”╝ 2ņŚÉņä£ ĒÖĢņØĖĒĢ£ ņāüļīĆņĀüņ£╝ļĪ£ ņĀäĻĖ░ ņĀäļÅäļÅäĻ░Ć ļé«ņØĆ CuSļĪ£ ņØĖĒĢ┤ ļéśĒāĆļé£ ļ»ĖņäĖĻĄ¼ņĪ░ņØ┤ļŗż. ĻĘĖļ”╝ 4 (b)ņŚÉļŖö SDSĻ░Ć ņ▓©Ļ░ĆļÉśņ¦Ć ņĢŖņØĆ ņÜ®ņĢĪņ£╝ļĪ£ ņŖżĒŖĖļ”¼ĒĢæĒĢ£ ņŗ£ĒÄĖņØś SEM ņØ┤ļ»Ėņ¦Ćļź╝ ļéśĒāĆļé┤ņŚłļŗż. ņŻ╝ņĪ░ņ¦üĒøä ņŗ£ĒÄĖņŚÉ ļ╣äĒĢ┤ ĒÅēĒāäĒĢ┤ņ¦ä Ēæ£ļ®┤ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņ£╝ļ®░, P3ļĪ£ Ēæ£ņŗ£ĒĢ£ ņĢäņØ╝ļ×£ļō£ņāü(island phase)Ļ│╝ P4ļĪ£ Ēæ£ņŗ£ĒĢ£ ņāüļīĆņĀüņ£╝ļĪ£ ņ¢┤ļæÉņÜ┤ ļČĆļČäņØ┤ ņ׳ņŚłļŗż. P3ņÖĆ Ļ░ÖņØĆ ņĢäņØ╝ļ×£ļō£ ļČĆļČäņØĆ ņŖżĒŖĖļ”¼ĒĢæ Ļ│╝ņĀĢņŚÉņä£ ĒĢ®ĻĖłņØś ņāüņŚÉ ļö░ļØ╝ ņŚÉņ╣Ł ņĀĢļÅäĻ░Ć ņāüņØ┤ĒĢśņŚ¼ ļéśĒāĆļé£ Ļ▓░Ļ│╝ņśĆņ£╝ļ®░, P4ņÖĆ Ļ░ÖņØĆ ņāüļīĆņĀüņ£╝ļĪ£ ņ¢┤ļæÉņÜ┤ ļČĆļČäņØĆ ņĢ×ņä£ ĻĘĖļ”╝ 2ņŚÉņä£ ĒÖĢņØĖĒĢ£ ļ░öņÖĆ Ļ░ÖņØ┤ ņŖżĒŖĖļ”¼ĒĢæ Ļ│╝ņĀĢņŚÉņä£ ĒśĢņä▒ļÉ£ NiS ļČĆļÅÖĒā£ļ¦ē ļĢīļ¼ĖņŚÉ ļéśĒāĆļé£ Ļ▓āņØ┤ļŗż. ņØ┤ļ¤¼ĒĢ£ ļČĆļÅÖĒā£ļ¦ēņØś ĒśĢņä▒ņØĆ ĻĘĖļ”╝ 1ņŚÉņä£ ĒÖĢņØĖĒĢ£ Ļ▓ĆņØĆņāē ļ¼╝ņ¦łņØś ĒśĢņä▒Ļ│╝ļÅä ņØ╝ņ╣śĒĢśļŖö Ļ▓░Ļ│╝ņśĆļŗż. ĻĘĖļ”╝ 4 (c)ļŖö SDS 0.1 g/L ņ▓©Ļ░ĆĒĢ£ ņÜ®ņĢĪņ£╝ļĪ£ ņŖżĒŖĖļ”¼ĒĢæĒĢ£ ņŗ£ĒÄĖņØś SEM ņØ┤ļ»Ėņ¦ĆņØ┤ļ®░, P5ļĪ£ Ēæ£ņŗ£ĒĢ£ ĒÅēĒāäļČĆņÖĆ P6ņ£╝ļĪ£ Ēæ£ņŗ£ĒĢ£ ņŚÉņ╣ŁļČĆĻ░Ć ņĪ┤ņ×¼ĒĢśņśĆĻ│Ā, SDSĻ░Ć ņ▓©Ļ░ĆļÉ©ņŚÉ ļö░ļØ╝ ņŖżĒŖĖļ”¼ĒĢæ Ļ│╝ņĀĢņŚÉņä£ Ēæ£ļ®┤ ņŚÉņ╣ŁņŚÉļÅä ņśüĒ¢źņØä ļ»Ėņ│É ĻĘĀņØ╝ĒĢ£ ņāüņØä Ļ░¢ļŖö ļ»ĖņäĖ ĻĄ¼ņĪ░ļź╝ ļ│┤ņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ SDSņØś ņ▓©Ļ░ĆņŚÉ ļö░ļźĖ ņŚÉņ╣ŁņåŹļÅäļŖö ĻĘĖļ”╝ 3ņŚÉņä£ ĒÖĢņØĖĒĢ£ ļ¼┤Ļ▓īĻ░Éņåīņ£©ņØä ĒåĄĒĢ┤ ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ĻĘĖļ”╝ 4 (d)ļŖö SDS 0.2 g/L ņ▓©Ļ░ĆĒĢ£ ņÜ®ņĢĪņ£╝ļĪ£ ņŖżĒŖĖļ”¼ĒĢæĒĢ£ ņŗ£ĒÄĖņØś SEM ņØ┤ļ»Ėņ¦ĆņØ┤ļ®░, P7ļĪ£ Ēæ£ņŗ£ĒĢ£ ļ░öņÖĆ Ļ░ÖņØ┤ ĒÅēĒāäļČĆņÖĆ ņŚÉ ņ╣ŁļČĆ ĻĄ¼ļ│äņØ┤ ņŚåņØ┤ ļ¬©ļæÉ ĒÅēĒāäĒĢ£ Ēæ£ļ®┤ņØä ļ│┤ņśĆļŗż. ņØ┤ļŖö SDSņØś ņ▓©Ļ░ĆļĪ£ ņØĖĒĢ┤ Ļ│╝ļÅäĒĢ£ ņŚÉņ╣ŁņØ┤ ņ¢ĄņĀ£ļÉśņ¢┤ ļéśĒāĆļé£ Ļ▓āņØ┤ļŗż.
ļö░ļØ╝ņä£ SDS ņ▓©Ļ░Ćļ¤ēņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ Ēæ£ļ®┤ņØś Ļ│╝ļÅäĒĢ£ ņŚÉņ╣ŁņØä ņ¢ĄņĀ£ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ĻĖłĒĢ®ĻĖł ņŗ£ļŻīņØś ļ¼┤Ļ▓īĻ░Éņåīņ£©ņØĆ Ļ░ÉņåīĒĢśņśĆļŗż. Ļ▓░ĻĄŁ SDSĻ░Ć 0.15 g/L ņØ┤ņāüņ£╝ļĪ£ ņ▓©Ļ░ĆļÉ£ ņĪ░Ļ▒┤ņŚÉņä£ Ļ│╝ļÅäĒĢ£ Ēæ£ļ®┤ņŚÉņ╣Ł ņŚåņØ┤ ļ¼┤Ļ▓īĻ░Éņåīņ£©ņØ┤ ļé«ņ£╝ļ®┤ņä£ļÅä, Ļ┤æĒāØņØ┤ ņ׳ļŖö Ēæ£ļ®┤ņ▓śļ”¼Ļ░Ć Ļ░ĆļŖźĒĢśņśĆļŗż.
Ēæ£ 2ņŚÉļŖö ĻĘĖļ”╝ 4ņŚÉ Ēæ£ņŗ£ļÉ£ P1~P7 ļČĆļČäņØś Au, Cu, Ni, Zn ļ░Å S ņøÉņåīņØś EDS ļČäņäØĻ▓░Ļ│╝ļź╝ ļéśĒāĆļé┤ņŚłļŗż. ņŻ╝ņĪ░ņ¦üĒøä ņŗ£ĒÄĖņŚÉņä£ņØś ļ¬ģņĢöņ░©ņØ┤Ļ░Ć ļ│┤ņśĆļŹś P1Ļ│╝ P2ņŚÉņä£, P1ņØś ņøÉņåīĒĢ©ļ¤ēņØĆ 57.02 wt% Au, 31.75 wt% Cu, 4.38 wt% Ni, 6.72 wt% Zn, 0.13 wt% SņØ┤ļ®░, P2ņØś ņøÉņåīļŖö 4.64 wt% Au, 71.41 wt% Cu, 7.93 wt% Ni, 15.88 wt% Zn, 0.14 wt% SņØ┤ņŚłļŗż. ņØ┤ļĢī P1Ļ│╝ P2ņŚÉņä£ Ļ▓ĆņČ£ļÉ£ SļŖö ĻĘĖļ”╝ 2 ļØ╝ļ¦īļČäņäØ Ļ▓░Ļ│╝ņŚÉņä£ ĒÖĢņØĖĒĢ£ ņŻ╝ņĪ░Ļ│╝ņĀĢņŚÉņä£ ĒśĢņä▒ļÉ£ CuS ļČĆļÅÖĒā£ļ¦ē ļĢīļ¼Ėņ£╝ļĪ£, P1Ļ│╝ P2ņØś ļ¬ģņĢöņ░©ļŖö CuS ļČĆļÅÖĒā£ļ¦ēņØś ļæÉĻ╗ś ņ░©ņØ┤ļĪ£ ļéśĒāĆļé£ Ēśäņāüņ£╝ļĪ£ ĒīÉļŗ©ĒĢśņśĆļŗż.
SDSņØś ņ▓©Ļ░ĆĻ░Ć ņŚåļŖö P3ņÖĆ P4ļŖö Ļ░üĻ░ü 99.89 wt% AuņÖĆ 0.11 wt% SņÖĆ 50.96 wt% Au, 35.26 wt% Cu, 6.04 wt% Ni, 7.32 wt% Zn, 0.42 wt% SĻ░Ć Ļ▓ĆņČ£ļÉśņŚłļŗż. P3ļŖö ĒĢ®ĻĖł Ļ│╝ņĀĢņŚÉņä£ ļé©ņØĆ Au-richņāüņ£╝ļĪ£ ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, ņØ┤ļ¤¼ĒĢ£ ņāüņØś ņĪ┤ņ×¼ļŖö Ēæ£ļ®┤ņØś ļČłĻĘĀņØ╝ĒĢ£ ņŚÉņ╣Łņ£╝ļĪ£ ļéśĒāĆļé£ ĒśäņāüņØ┤ļŗż. ļśÉĒĢ£ P4ļŖö SĻ░Ć ņāüļīĆņĀüņ£╝ļĪ£ ļåÆĻ▓ī Ļ▓ĆņČ£ļÉśņ¢┤ ņØ┤ļŖö ņĢ×ņä£ ĻĘĖļ”╝ 2ņŚÉņä£ ĒÖĢņØĖĒĢ£ NiSņŚÉ ņØśĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ĒĢśņśĆļŗż.
ĒĢ£ĒÄĖ, SDS 0.1 g/LņÖĆ 0.2 g/L ņ▓©Ļ░ĆĒĢśļŖö Ļ▓ĮņÜ░, P5, P6 ĻĘĖļ”¼Ļ│Ā P7ņ£╝ļĪ£ Ēæ£ņŗ£ĒĢ£ ļČĆļČäņØś Ļ▓░Ļ│╝ņŚÉņä£ ĒÖĢņØĖĒĢ£ ļ░öņÖĆ Ļ░ÖņØ┤, EDS Ļ▓░Ļ│╝ņŚÉņä£ SĻ░Ć Ļ▓ĆņČ£ļÉśņ¦Ć ņĢŖņĢśņ£╝ļ®░, ļ¬®Ēæ£ĒĢ£ ņŻ╝ņĪ░ ņĪ░ņä▒Ļ│╝ ņ£Āņé¼ĒĢ£ Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż. ļö░ļØ╝ņä£ SDSļź╝ ņ▓©Ļ░ĆĒĢ£ ņŖżĒŖĖļ”¼ĒĢæ Ļ│ĄņĀĢņØś Ļ▓ĮņÜ░ SĻ░Ć Ļ▓ĆņČ£ļÉśņ¦Ć ņĢŖņĢä NiS ĒśĢņä▒ņØ┤ ņŚåļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, ņØ┤ļŖö SDSĻ░Ć ņ▓©Ļ░ĆļÉ£ ņŖżĒŖĖļ”¼ĒĢæņØä ĒåĄĒĢ┤ ĻĖ░ņĪ┤ņŚÉ ņĢīļĀżņ¦ä ĻĖłņåŹĒÖ®ĒÖöļ¼╝ņØś ņāØņä▒ ņŚåņØ┤ ņŻ╝ņĪ░ņ¦üĒøäņØś ļČĆļÅÖĒā£ļ¦ēņØä ņä▒Ļ│ĄņĀüņ£╝ļĪ£ ņĀ£Ļ▒░ĒĢĀ ņłś ņ׳ņØīņØä ņØśļ»ĖĒĢ£ļŗż.
ĻĘĖļ”╝ 5ņØĆ SDS ĒĢ©ļ¤ēņŚÉ ļö░ļźĖ LSV ļČäņäØ Ļ▓░Ļ│╝ņØ┤ļŗż. ĻĘĖļלĒöäņŚÉ Ēæ£ņŗ£ĒĢ£ ļ░öņÖĆ Ļ░ÖņØ┤ SDS ņ▓©Ļ░Ćļ¤ēņØ┤ ņ”ØĻ░ĆĒĢ©ņŚÉ ļö░ļØ╝ ņé░ĒÖöņĀäļźśļ░ĆļÅäņØś Ēü¼ĻĖ░Ļ░Ć ņĀÉņ░© Ļ░ÉņåīĒĢśļŖö ĒśäņāüņØä ĒÖĢņØĖĒĢśņśĆļŗż.
SDSļź╝ ņ▓©Ļ░ĆĒĢśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ 0.42 VļŖö Ēŗ░ņśżņÜ░ļĀłņĢäĻ░Ć formamidine disulfide(FD)ļĪ£ ņé░ĒÖöļÉśļŖö Ļ▓āņØä ļéśĒāĆļéĖļŗż. ņØ┤ļŖö ņĢäļל ņŗØ (1)-(3)ņ£╝ļĪ£ ļéśĒāĆļéĖ Ēŗ░ņśżņÜ░ļĀłņĢäņØś ņŚ░ņåŹļ░śņØæņŚÉ ņØśĒĢ┤ ĻĖłņØ┤ ņÜ®ņČ£ļÉśĻ│Ā ļÅÖņŗ£ņŚÉ ĒÖ®ĒÖöļ¼╝ņØ┤ ĒśĢņä▒ļÉśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż [13,20]. ņØ┤ļĢī ņŗØ (1)ņØĆ Ēŗ░ņśżņÜ░ļĀłņĢäĻ░Ć FDļĪ£ ņé░ĒÖöļÉśļŖö ļ░śņØæ, ņŗØ (2)ļŖö FDĻ░Ć ņé░ĒÖöņĀ£ļĪ£ ņ×æņÜ®ĒĢ┤ ĻĖłņØä ņÜ®ņČ£ņŗ£ĒéżļŖö ļ░śņØæ, ņŗØ (3)ņØĆ FDĻ░Ć ĒÖ®ĒÖöļ¼╝ļĪ£ ļČäĒĢ┤ļÉśļŖö ļ░śņØæņØä ņØśļ»ĖĒĢ£ļŗż. ņØ┤ļĢī ņāØņä▒ļÉ£ ĒÖ®ĒÖöļ¼╝ņØĆ ļ░▒ņāēĻĖł ņŗ£ļŻīņØś NiĻ│╝ ļ░śņØæĒĢśņŚ¼ NiSļź╝ ĒśĢņä▒ĒĢśļ®░, ņØ╝ļŗ© ĒśĢņä▒ļÉ£ ņ╣śļ░ĆĒĢ£ NiSļŖö ņĀ£Ļ▒░Ļ░Ć ņ¢┤ļĀżņÜ┤ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż [12].
ĻĘĖļ¤¼ļéś SDSĻ░Ć ņ▓©Ļ░ĆļÉśļ®┤ ņŗØ (1) FD ĒśĢņä▒ļ░śņØæņØ┤ ņ¢ĄņĀ£ļÉśļ®░, ņØ┤ņŚÉ ļö░ļØ╝ ĒøäņåŹ ņŗØ (2)ņØś ĻĖł ņÜ®ņČ£ļ░śņØæļÅä ļŖÉļĀżņĀĖ ļ¼┤Ļ▓ī Ļ░Éņåīņ£©ņØ┤ ņżäņ¢┤ļō£ļŖö Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ĒĢśņśĆļŗż. ņŗØ (3) FDņØś ņ×ÉĻĖ░ ļČäĒĢ┤ ļ░śņØæļÅä ļŖÉļĀżņĀĖ ĒÖ®ĒÖöļ¼╝ņØś ĒśĢņä▒ņØ┤ ņ¢ĄņĀ£ļÉśļ®░, ņØ┤ļŖö NiS ĒśĢņä▒ņØ┤ ņŚåļŖö Ļ▒┤ņĀäĒĢ£ ņŖżĒŖĖļ”¼ĒĢæņØ┤ Ļ░ĆļŖźĒĢ©ņØä ņØśļ»ĖĒĢśņśĆļŗż.
4. Ļ▓░ ļĪĀ
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņØĖļ▓ĀņŖżĒŖĖļ©╝ĒŖĖ ņŻ╝ņĪ░ļÉ£ NiĻ│ä-14 K ļ░▒ņāē ĻĖł ĒĢ®ĻĖłņŚÉ ļīĆĒĢ£ Ēŗ░ņśżņÜ░ļĀłņĢä ņŖżĒŖĖļ”¼ĒĢæ Ļ│ĄņĀĢņØä ņ£äĒĢ┤, SDS Ļ│äļ®┤ĒÖ£ņä▒ņĀ£, Ēŗ░ņśżņÜ░ļĀłņĢä ņ░®ļ¼╝ņĀ£, ĒÖ®ĒÖöņ▓Ā ņé░ĒÖöņĀ£ļĪ£ ĻĄ¼ņä▒ļÉ£ ņŖżĒŖĖļ”¼ĒĢæ ņÜ®ņĢĪņØä ņĀ£ņĢłĒĢśņśĆļŗż. SDSļź╝ ņ▓©Ļ░ĆĒĢśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ ņŻ╝ņĪ░ ļČĆļÅÖĒā£ļ¦ēņØĆ ņĀ£Ļ▒░ļÉśņ¦Ćļ¦ī ļČĆņé░ļ¼╝ļĪ£ Ēæ£ļ®┤ ņĀäņ▓┤ņŚÉ ņ╣śļ░ĆĒĢ£ NiSĻ░Ć ĒśĢņä▒ļÉśļŖö ļ¼ĖņĀ£Ļ░Ć ņ׳ņŚłļŗż. SDSļź╝ ņ▓©Ļ░ĆĒĢśļ®┤, ņŻ╝ņĪ░ ļČĆļÅÖĒā£ļ¦ēņØä ņĀ£Ļ▒░ĒĢĀ ņłś ņ׳ņŚłĻ│Ā, Ēŗ░ņśżņÜ░ļĀłņĢäņØś ņ×ÉĻĖ░ļČäĒĢ┤ļĪ£ ņØĖĒĢ£ ĻĖł ņÜ®ņČ£Ļ│╝ ĒÖ®ĒÖöļ¼╝ ĒśĢņä▒ņØ┤ ņ¢ĄņĀ£ļÉśņ¢┤, ņŖżĒŖĖļ”¼ĒĢæņŚÉ ļö░ļźĖ ļ¼┤Ļ▓ī Ļ░Éņåīņ£©ļÅä ņĀĆĒĢśņŗ£ĒéżĻ│Ā, NiSņØś ņāØņä▒ļÅä ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņ¢ĄņĀ£ĒĢśņśĆļŗż. ļö░ļØ╝ņä£ ņĀ£ņĢłļÉ£ Ēŗ░ņśżņÜ░ļĀłņĢä ņŖżĒŖĖļ”¼ĒĢæņØĆ SDS 0.15 g/LņØ┤ ņāüņØś ņ▓©Ļ░ĆņŚÉņä£ NiĻ│ä-14 K ļ░▒ņāē ĻĖłĒĢ®ĻĖł ņŖżĒŖĖļ”¼ĒĢæ Ļ│ĄņĀĢņŚÉ ņĀüņÜ® Ļ░ĆļŖźņä▒ņØä ĒÖĢņØĖĒĢśņśĆļŗż.