1. 서 론
원자로 구조 재료는 원자로 가동 온도에서 사용하면 시간에 따른 물성의 변화가 나타나는데 이런 현상을 포괄적으로 aging이라고 한다 [1]. 재료에 따라서 aging 현상은 결정 입계를 따른 파괴로 나타나기도 하며 강도나 인성의 변화를 수반한다 [2, 3]. 따라서 현재까지 aging 현상에 대한 연구는 aging 처리에 따른 강도나 인성의 변화를 확인하는 게 일반적이었다. 이런 변화의 원인은 충분히 이해되지 못하여 구조물 설계 과정에서는 aging 현상이 초래하는 영향을 적절히 반영할 수 없었다.
최근 발표된 연구 결과에 따르면 aging 현상을 초래하는 원인 중의 하나는 재료 내에 남아 있는 잉여 엔트로피의 감소 때문이라는 것이다 [1]. 모든 재료는 원자(atom)로 구성되어 있으며, 이 원자들의 배열 상태에 따라 재료의 엔트로피는 달라진다. 예를 들면 용체화(solution anneal, SA) 처리된 재료는 대부분 수냉 (water quenching, WQ) 처리 되는데, SA 처리 온도에서 유입된 엔트로피가 WQ 처리 과정에서 잔류된 상태로 냉각된다. 따라서 모든 재료는 변형, 용접, 급냉 처리 등의 열적 기계적 공정으로 제조되면서 엔트로피가 증가하고, 이런 재료는 원자 확산이 가능한 가동 환경에 노출되면 엔트로피가 감소하면서 aging 효과가 나타난다.
엔트로피는 열(thermal)과 원자 배열(configuration)의 두가지 형태로 존재한다 [4]. 원자 배열 엔트로피는 합금에서 특정 원자 주위에 이종 원자가 불규칙하게 혼합되는 원자배열을 가질 때 높다. 이런 원자 배열이 3차원적인 규칙성을 갖지 않고 그 크기가 2 nm 정도로 작으면 초격자를 형성하지 않으므로 단범위 규칙 (short range order, SRO)반응이라고 불린다 [5-15]. 원자 배열 엔트로피는 원자가 배열되어 있는 상태에 따라 달라지므로 합금뿐만 아니라 순 금속에서도 존재한다. 이것은 원자가 완전한 구가 아니라는 점을 고려하면 이해할 수 있다. 원자로 구조 재료는 가동 환경에서 노출되면 원자 배열 변화와 함께 엔트로피가 감소되면서 SRO 반응이 일어난다 [16-18].
최근 알려진 바에 따르면 SRO 현상은 원자 간의 거리가 가까워지게 만들어 격자 거리를 축소시키고 재료 전체는 압축 응력을 받게 되며 그 결과 구조물의 길이는 수축된다 [1,10-15]. 금속 재료의 결정은 이방성(anisotropy)을 가지고 있어서 격자 수축이 발생하면, 결정 입계는 인장응력 상태에 놓인다. 즉, SRO 현상은 가동 환경에서 엔트로피가 감소하면서 일어나므로 구조물 내부에서 스스로 추가적인 응력을 발생시킨다.
현재 전 세계에서 가동 중인 상업용 원자로는 경수로와 중수로의 두 가지가 있다. 경수로는 하나의 압력 용기에서 핵분열을 일으키고 이때 방출되는 열을 물(H2O)로 이동시켜 전기를 생산한다. 반면, 중수로는 380개의 압력관에 핵연료를 각각 담아서 핵분열을 일으키고 이 압력관을 따라 냉각재인 중수(D2O)가 흘러 열을 증기발생기로 이동하도록 설계되어 있다 [18,19]. 중수로 압력관은 수평으로 놓여있으며 길이가 6m이다. 따라서 압력관은 자체 중량, 핵연료, 냉각수 등을 담고 있으므로 어느 정도 처지게 된다.이 경우에도 압력관이 캘란드리아(calandria) 관에 접촉되지 않도록 압력관의 외부에는 X-750 합금으로 제작된 garter spring 4개를 일정한 간격으로 설치해 놓았다. 이런 목적을 달성하기 위하여 garter spring은 원자로 가동 기간 동안 건전성이 유지되어야 한다.
그러나 최근 캐나다의 연구 결과에 따르면 가동 환경에 노출되어 있던 garter spring을 인출하여 검사한 결과 입계(intergranular, IG) 파괴가 일어나는 것으로 확인되었다 [20,21]. 이 연구자들은 입계 파괴가 일어난 X-750 garter spring에 대한 미세조직 분석으로 입계에서 형성된 He bubble을 확인하고, 이 He bubble의 형성이 입계 파괴의 원인이라고 해석하였다. 이 해석은 동위원소 변환에 의해 He 원자가 형성되고 이것들이 bubble을 만든다는 것이지만, 이 해석의 한계는 He bubble의 내부 압력이 결정 입계를 벌릴 수 있는 정도로 큰 지는 의문이다. 즉, He이 형성되면 He이 뭉쳐져 bubble을 만들고 이것이 커지면서 입계를 벌리는 것인지, 아니면 다른 이유로 void가 먼저 생기고 핵변환으로 생기는 He이 이곳에 모이는 것인지 구분하지 못한다.
중수로에서 인출된 X-750 garter spring에서 나타나는 IG 형태의 파괴는 aging 현상의 결과로 추론된다. 위에서 설명한 바와 같이 SRO 현상이 일어나면 재료 내에서 엔트로피가 감소하면서 원자 간의 거리가 좁혀지고, 이 과정에서 빈 공간(void)이 형성될 수 있다. 따라서 SRO 현상만으로도 입계나 입내에 void가 형성되고 여기에 핵변환 물질 He이 모여서 He bubble이 될 수 있다는 것이다.
연구 경험에 따르면 SRO 반응을 확인하는 가장 유용한 방법은 시차 열분석 (differential scanning calorimeter, DSC) 방법이다 [5,6]. 따라서 본 연구에서는 DSC를 이용하여 X-750 합금의 SRO 반응의 존재를 확인하고, 그 반응에 대한 활성화 에너지를 결정하여 어떤 종류의 SRO 반응인지 추론하며, 규칙화 처리가 격자 변화에 미치는 효과를 확인했다. 이에 더하여 SRO 반응에 따른 격자 수축이 재료의 내부에 void를 만들어 He bubble 형성 위치를 제공할 수 있는 지에 대해 논의하였다.
2. 실 험
실험에 사용한 X-750 재료의 화학 조성은 표 1에 보였다. 직경 30 mm 정도의 봉을 1,100 °C에서 1시간 유지한 후 두께 8 mm 정도의 판재로 열간 압연(hot roll, HR)하였다. 이 재료는 1,100 °C에서 1시간 유지된 후 수냉(water quenching, WQ) 및 노냉(furnace cooling, FC) 처리되었다. 냉간 가공 시편은 HR 이후 WQ 상태의 판재를 20% 냉간 압연(cold rolled, CR)한 것이다. 규칙화 처리의 효과를 확인하기 위하여 475 °C에서 WQ 및 CR 시편을 각각 2,160시간 유지하여, WQ+O 및 CR+O 시편을 준비하였다.
X-750에서의 SRO 반응을 확인하기 위하여 WQ, CR, WQ+O, CR+O 시편에 대하여 DSC 분석을 실시하였다. 온도에 따른 비열 분석은 10 K/min의 가열 속도를 사용하였다. 엔트로피 감소에 의한 발열 반응의 peak을 확인하고 규칙화 반응에 대한 활성화 에너지를 구하기 위하여 DSC의 가열 속도를 5, 10, 20, 40 K/min으로 변화시켰다 [6,15,16,22]. 규칙화 처리된 시편은 발열 반응이 나타나지 않고 흡열 반응이 나타나므로 가열 속도를 변화시켜서 흡열 반응에 대한 활성화 에너지를 구하였다.
가열 속도와 반응의 peak 온도 사이의 관계는 식 (1)과 같다.
여기서 T1 및 T2는 열분석 중 시험편의 가열 속도가 각각 α1 및 α2 일 때의 발열 반응의 온도이다.
규칙화 처리에 의한 격자 변화를 관찰하기 위하여 WQ, FC, CR 시편을 6개 이상 준비하였다. 이들 3 종류의 X-750 시편은 475 °C에서 0, 4, 24, 100, 500, 2,160시간 동안 규칙화 처리하였다. XRD를 이용하여 이들 시편에 대한 격자의 변화를 측정하였다. XRD 분석용 시편은 기계적으로 연마한 후 10% perchloric acid + ethanol 용액으로 전해 연마하여 변형 층을 충분히 제거하였다. XRD 분석에는 CuKa X-ray를 사용하였다. 각 조건의 시편에 대한 XRD 분석 결과를 사용하여 규칙화 처리를 하지 않은 WQ, FC, CR 시편의 격자 길이를 각각 d0로 정하고 규칙화 처리 시간에 따른 XRD 결과를 사용하여 격자 변화는(di-d0)/d0의 관계를 이용해 계산하였다.
3. 결 과
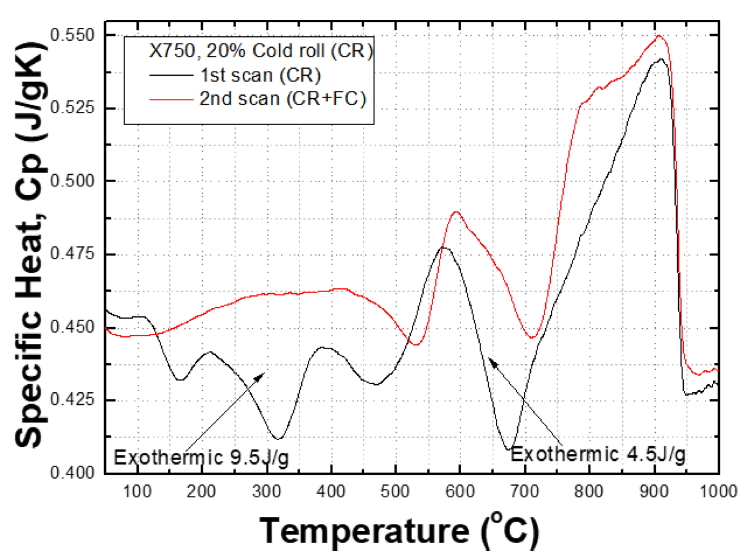
그림 1은 WQ 시편을 1,100 °C까지 10 K/min 속도로 DSC 분석한 비열을 나타낸 것이다. 검은 선은 WQ 시편을 분석한 것이고, 붉은 선은 WQ 시편을 1,100 °C까지 DSC 분석 후 냉각된 시편을 다시 DSC 분석한 결과이다. DSC 분석 장비의 특성상 1차 가열 실험했다가 냉각하면 DSC 장비의 냉각 속도에 따라 냉각되므로 FC 처리된 것이라고 할 수 있다. FC 처리는 서서히 냉각되어 평형에 가까운 상태이다. 그러므로 FC 시편의 결과를 WQ 상태와 비교하면 WQ 처리 시편의 특성을 잘 파악할 수 있다. 따라서 FC 곡선보다 낮게 나타나는 부분은 비열이 작은 것이고, 이것은 WQ 시편이 분석 과정에서 발열하기 때문이다.
WQ X-750 시편은 530-630 °C, 630-740 °C, 740-920 °C의 3 부분에서 FC 시편보다 낮은 값을 보인다. 즉, WQ 시편은 약 580 °C와 690 °C 부근에서 두 개의 발열 반응을 보이고, 740-920 °C 부분에서도 낮게 나타난다. 530-740 °C 사이에서 WQ와 FC 두 곡선 사이의 발열 양은 13 J/g으로 나타났다. 이것은 WQ 시편에 남아 있는 엔트로피가 DSC 분석 과정에서 방출된 열이다. WQ 시편에서 방출되는 열을 엔트로피라고 부르는 것은 원자의 배열이 바뀌는 과정에서 드나드는 열이기 때문이다. 이것은 응고나 용해 과정의 응고열이나 용해열과 유사하다. 이와 같이 상 변태 과정에서 드나드는 열은 본질적으로 엔트로피이고, 엔트로피는 열량을 온도로 나눈 것(S=Q/T)이므로 단위는 열량과 다르다.
WQ 시편은 1100 °C까지 가열하고 1시간 유지한 후 WQ 처리한 것이다. 모든 물질은 가열하면 비열이 증가하면서 엔탈피(enthalpy)가 증가할 뿐만 아니라 엔트로피도 증가한다. 1100 °C에서 WQ 처리되면 냉각되면서 빠져 나갈 수 있는 열은 빠져 나가고 시편은 냉각된다. 반면, 고온에서 원자 배열이 흐트러져 급속 냉각 과정에서 빠져 나갈 수 없는 열은 엔트로피 상태로 재료에 남는다. 이것은 주로 불규칙화 반응에 의한 원자 배열의 흐트러짐에 의한 것이다. 이렇게 급냉한 시편에서 방출되지 못하고 남아 있는 엔트로피는 DSC 분석 중 원자 확산이 일어나면 밖으로 방출되기 때문에 발열 반응으로 관찰되는 것이다.
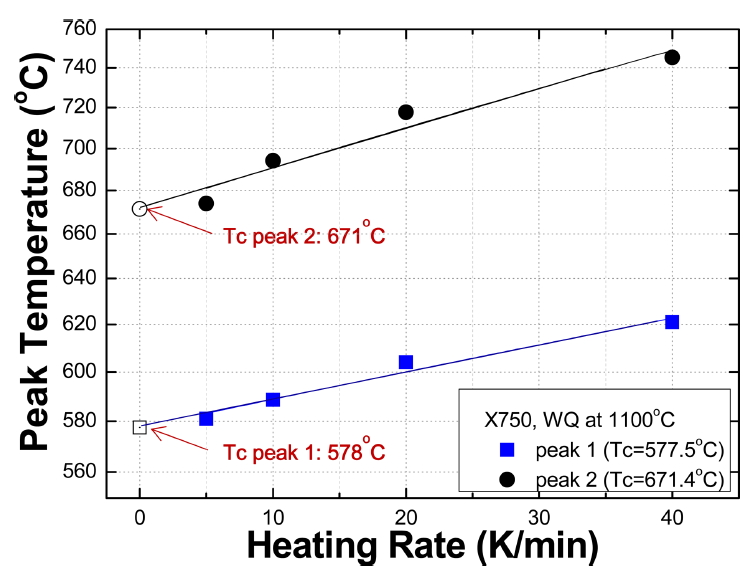
그림 2는 X-750 WQ 시편을 5, 10, 20, 40 K/min으로 가열할 때 발열 반응의 온도가 가열 속도의 증가에 따라 증가하는 것을 도시한 것이다. 그림 1에서 580 °C 부근에서 나타난 발열 반응은 peak 1이라고 한다. 이 반응은 그림 2의 파란색으로 나타낸 것처럼 가열 속도를 변화시켜 40 K/min일 때 620 °C에서 관찰된다. 이렇게 가열 속도를 변화시키면 특정 반응의 온도가 증가하는 관계를 이용하여 가열 속도가 0 K/min 일 때의 반응 온도를 구하면 이 반응에 대한 임계 온도(critical temperature, Tc)이다. 즉, Tc는 가열 속도에 따른 반응의 온도를 도시하여 가열 속도가 무한히 느린 0 K/min인 점을 구하는 것이다. WQ X-750 재료의 peak 1 및 2의 Tc는 각각 578 °C 및 671 °C이다.
DSC 분석 장비는 가열 속도를 일정하게 조절할 수 있도록 제작되어 있으므로 DSC 분석 시편을 원하는 가열 속도로 시편을 가열할 수 있다. 어떤 반응이 일어나는 온도는 가열 속도가 빨라지면 그 반응이 더 높은 온도에서 일어나는 것처럼 관찰된다. 이 변화의 정도는 그 반응의 Q에 따라 달라지는데, 이 원리를 이용하여 SRO 반응에 대한 Q를 구할 수 있다.
그림 3은 가열 속도에 따른 peak 온도의 관계를 이용하여 WQ X-750 재료의 발열 반응 peak 1 및 2에 대한 Q를 나타낸 것이다. Peak 1 및 2에 대한 Q는 각각 303 및 217 kJ/mol로 나타났다. 표 2 및 3은 Kissinger 방법을 이용하여 WQ X-750 재료의 peak 1 및 peak 2 발열 반응에 대한 Q를 구한 과정을 상세히 나타낸 것이다.
X-750은 합금이므로 SRO 반응의 Q에 부합하는 본질을 정확히 결정하는 것은 어렵다. 다만, X-750이 Ni-base 합금이라는 것을 감안하면 제2원소인 크롬(Cr)과 제3원소인 철(Fe)의 확산과 관련지어 볼 수 있다. 자기 확산에 대한 Q는 크롬은 309 kJ/mol, 철은 240 kJ/mol이라는 것[23]을 고려하면 peak 1은 Cr의 확산, peak 2는 Fe의 확산과 관련된 것으로 보인다. Ni-Cr 이원 상태도를 보면 Tc가 590 °C인 Ni2Cr 규칙 반응이 존재한다 [24]. 이 온도는 Ni:Cr의 비율이 2:1인 경우에 규칙화가 일어나는 온도이다. X-750은 Ni:Cr의 비율이 대략 5:1 정도로 Tc는 590 °C보다 낮아질 것이다. 따라서 Peak 1은 Q가 Cr의 자기 확산에 대한 Q보다 약간 낮지만 X-750에서 제2원소인 Cr이 Ni2Cr SRO를 형성하는 반응으로 보인다.
X-750의 제 2 및 제 3 원소인 Cr-Fe 이원 상태도를 보면 sigma (σ, CrFe) 상이 821 °C 이하에서 형성된다 [24]. Sigma 상의 Cr:Fe 비율은 1:1 이지만 X-750에서 Cr:Fe 비는 약 2:1 정도이다. 따라서 평형 온도보다 낮은 온도에서 SRO 반응을 일으킬 수 있다. 따라서 Tc=671 °C인 peak 2는 CrFe SRO 형성 반응에 의한 것으로 판단된다. 그림 1에서 720-920 °C 사이에서 발열 반응은 X-750의 제4원소인 Ti과 관련되어 Ni-Ti 사이에서 형성되는 SRO 반응에 의한 것으로 추정된다 [24].
그림 4는 20% 냉간 압연한 CR 시편의 온도에 따른 비열을 나타낸 것이다. 검은 선은 20% 냉간 압연 시편에 대한 1차 DSC 결과이다. 반면, 붉은 선은 DSC 분석 후 다시 DSC 분석한 것이다. 검은 선은 130-520 °C에서 붉은 선보다 낮고, 570-920 °C 사이에서 붉은 선보다 낮다. 570-920 °C에서 나타나는 발열 반응은 WQ 시편에서 일어나는 SRO 반응과 유사한 것으로 보인다. 위에서 설명한 바와 같이 비열이 낮아지는 것은 SRO 반응이 일어나면서 발열 반응이 일어나는 것이다.
CR 시편에서 나타나는 발열 반응은 상세히 살펴보면 170, 320, 460 °C에서 3개의 peak으로 구성되어 있다. X-750의 합금 원소는 이론적으로는 완전히 섞이지만, 부분적으로는 서로 선호하는 원소들이 결합을 하게 된다. Ni-Cr 합금은 590 °C에서 Ni2Cr 규칙상을 만들고, Ni-Fe 합금은 220 °C에서 NiFe3, 350 °C에서 NiFe, 500 °C에서 Ni3Fe 규칙상을 만든다 [25]. 이렇게 Ni, Cr, Fe 원자들은 확산이 가능한 온도에서 서로 결합하여 분자 규모의 규칙화가 일어나고, 이 과정에서 발열 반응이 나타나는 것이다.
그림 4의 CR 시편은 130-520 °C에서 3개의 발열 반응을 보이는 점은 WQ 시편과 다르다. 우선 중요한 차이는 CR 처리가 SRO 반응을 130 °C 부근까지 낮춘다는 것이다. WQ 시편은 530 °C 정도에 발열이 시작되는데, CR 재료는 130 °C부근에서 발열 반응이 시작된다. CR 재료는 SA 재료보다 약 400 °C 낮은 온도에서 SRO 반응을 일으키므로 CR 재료는 SA 재료보다 더 쉽게 SRO 반응을 일으킨다는 것을 알 수 있다. 이 결과는 CR 재료가 SA 재료보다 더 낮은 온도에서 손상에 취약한 이유를 설명해주는 단서가 될 수 있다. 연구자들은 경험적으로 CR 재료는 SA 처리된 재료에 비하여 낮은 손상 저항성을 가지기 때문에 가속 효과를 얻기 위해 CR 재료를 사용해 왔다. 냉간 가공의 가속 효과가 SRO 반응의 속도 증가 때문일 수 있다. X-750 재료에서 나타나는 CR 효과는 Alloy 600 (Ni-16Cr-9Fe) 합금에서도 확인된 바 있다 [6].
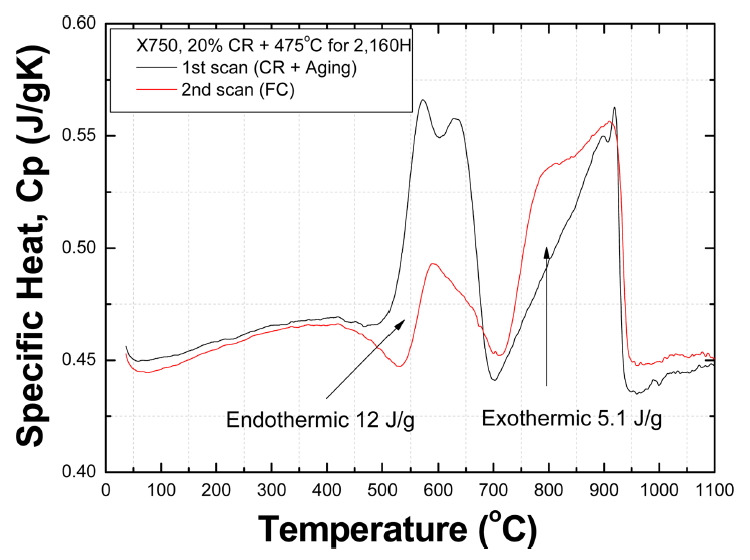
그림 5는 WQ X-750을 475 °C에서 2,160 시간 규칙화 처리한 시편(WQ+O)의 온도에 따른 비열을 나타낸 것이다. 검은 색은 WQ+O 시편, 붉은 색은 WQ+O 시편을 2차 DSC 분석한 것이다. WQ+O 시편은 약 500-700 °C 사이에서 큰 흡열 반응을 나타낸다. 반면, 750-920 °C에서는 발열 반응이 나타난다. 이 온도 구간에서 발열 반응이 나타나는 이유는 475 °C 규칙화 처리하여도 750-920 °C에서 SRO 반응을 일으키는 Ni-Ti 관련한 SRO 반응은 일어나지 않는다는 의미이다.
WQ+O 시편이 흡열 반응을 보이는 이유는 475 °C에서 2,160 시간 규칙화 처리하는 과정에서 규칙화되어 형성된 SRO가 500-700 °C에서 불규칙화 되면서 엔트로피가 증가하기 때문이다. 반면 붉은 색으로 표시된 2차 분석 결과는 500-700 °C에서 흡열 반응을 보이지 않는다. 이것은 WQ+O 시편이 1,100 °C까지 가열되면서 SRO는 충분히 분해되고, FC 과정에서 Ni2Cr이나 CrFe SRO 반응이 일어나지 않았기 때문이다. 검은 선과 붉은 선 사이의 면적 차이는 엔트로피가 증가하는 과정에서 WQ+O 시편이 흡수하게 된 열량으로 10 J/g 정도이다.
WQ+O 시편에서 나타나는 2개의 흡열 peak에 대한 Tc를 구한 결과 peak 1 및 2는 각각 553 °C 및 595 °C로 나타났다. 흡열 peak 1(553 °C)는 그림 1의 발열 peak 1(578 °C) 보다 약 25 °C 낮고, 흡열 peak 2(595 °C)는 발열 peak 2(671 °C)보다 76 °C 정도 낮다. WQ+O 시편의 peak 1 및 2에 대한 Q는 각각 202 kJ/mol 및 247 kJ/mol로 나타났다. 이 값들은 표 4에 정리되어 있다.
그림 6은 20% 냉간 가공된 재료를 475 °C에서 2,160 시간 aging 처리한 CR+O 재료의 DSC 결과를 나타낸 것이다. 검은 선은 CR+O 시편의 결과이고, 붉은 선은 같은 시편을 2번째 DSC 분석한 결과를 도시한 것이다. 이것은 그림 5에 보인 WQ+O 시편의 결과와 매우 흡사하다. 다만, CR+O 시편은 450-680 °C에서 흡열 반응이 나타나며 WQ+O 시편보다 더 크다.
CR+O 시편의 peak 1 및 peak 2의 Tc는 554 °C 및 621 °C로 나타났다. Tc를 기준으로 볼 때, Peak 1은 Ni2Cr의 불규칙화와 관련되어 있고, peak 2는 FeCr의 불규칙화와 관련되어 보인다. X-750에서 합금 원소로 들어있는 Cr과 Fe의 함량은 Ni-Cr 및 FeCr에서 규칙상의 원자 당량이 맞지 않으므로 상태도에서 나타나는 평형 온도보다는 약간 낮을 것이다.
WQ+O 시편의 Peak 1(Tc=553 °C)은 CR+O 시편의 peak 1(Tc=554 °C)와 매우 유사하지만, WQ+O 시편의 peak 2(595 °C)는 CR+O 시편의 peak 2(621 °C)보다 약 26 °C 정도 낮다. Peak 1은 WQ+O과 CR+O 시편이 같은 SRO 성분의 불규칙화에 의한 것이라는 의미이다. Peak 2의 불규칙화 온도가 26 °C 정도 높게 나타난 것은 CR 시편의 규칙화 온도는 130 °C 정도에서 시작되기 때문에 DSC 분석 과정에서 규칙화가 진행되는 시간이 길어서 SRO 상이 더 많이 형성되었기 때문으로 보인다. 이것은 그림 5 및 6에 보인 흡열 반응의 Cp가 CR+O 시편에서 더 높은 것으로부터 확인할 수 있다.
Tc는 그 온도 이상에서는 불규칙화가 일어나고 그 온도 이하에서는 규칙화가 일어나는 온도이다. CR+O 시편에서 Tc가 낮아지는 이유 중 하나는 냉간 가공에 의하여 재료 내에 유입된 엔트로피가 증가하여 규칙화에 대한 구동력을 추가적으로 제공하여 규칙화가 촉진되기 때문이다. 다른 하나는 1,100 °C에서 고용된 탄소가 WQ 처리의 경우 거의 다 격자에 고용된 상태로 남게 되는데, 이렇게 고용 탄소가 많아지면 원자의 확산을 어렵게 만들어서 규칙화가 어려워지게 되고 이런 이유로 Tc는 높아지게 된다. 그러나 CR+O 시편은 규칙화 처리 과정에서 SRO에 대한 구동력도 크지만 탄화물 석출에 용이한 내부 결함을 가지고 있어서 고용 탄소가 탄화물로 석출하기 용이하다. 따라서 격자 내에 남아 있는 고용 탄소가 줄어들어 낮은 온도에서 확산이 쉬워지기 때문에 Tc가 낮아지는 것으로 보인다.
Peak 1 및 2에 대한 Q는 각각 239 kJ/mol 및 245 kJ/mol로 나타났다. 이것은 자기 확산의 Q를 기준으로 볼 때 Fe의 확산과 관련되어 있는 것으로 추측된다. CR+O 시편에 대한 Q 및 Tc는 표 4에 정리되어 있다.
4. 논 의
열역학 제2법칙은 ΔS = ΔH/T (또는 ΔQ/T)로 표현된다. 이것은 열은 높은 온도에서 낮은 온도로 이동하고, 전체 계의 엔트로피가 증가하는 방향으로 반응이 일어난다는 의미이다. 본 연구에서 사용한 WQ X-750 시편이 방출하는 열은 주위로 전달되어 흩어진다. SRO 반응으로 엔트로피에 감소(-ΔS)에 의한 발열(-ΔH)은 높은 온도 THigh에서 TCold로 방출되므로 -ΔH/TH (=-ΔSHigh) < -ΔH/Tc (=-ΔSCold)의 관계가 성립한다. 즉, X-750에서 관찰되는 계의 엔트로피 감소는 열역학 제2법칙에 위배되지 않는다. 따라서 우리가 관찰하는 특정한 계에서의 엔트로피 증가나 감소에 대하여 해석하는 것이 중요하다.
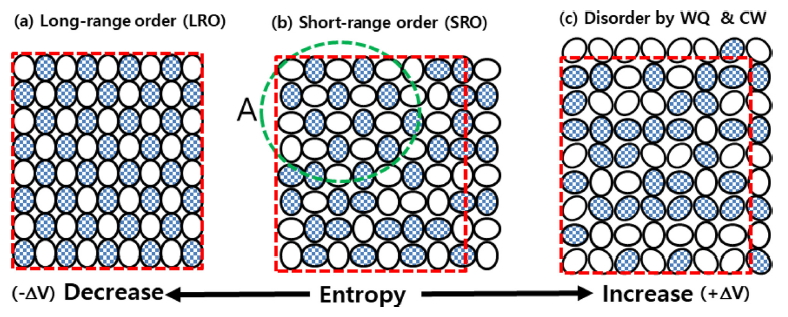
그림 7은 SRO 현상을 쉽게 설명하기 위하여 원자 배열을 2차원으로 나타낸 도표이다. 이 도표에서 가장 중요한 것은 원자가 원으로 표시되지 않고 타원으로 표시되었다는 것이다. 원자는 구라고 가정되는 경우가 많지만 실제는 구가 아니다. 여러 교과서에서 원자를 구라고 가정해 온 이유는 논의의 편의성을 위한 것이라는 점을 유의해야 한다. 물론 원자는 타원체도 아니지만 여기서는 타원체라고 가정한다. 여기서 원자를 구가 아니라 타원체라고 강조하는 이유는 원자 배열의 조합이 원자의 장축 방향에 따라 크게 증가하는 것을 설명 할 수 있기 때문이다.
그림 7에는 무늬가 표시된 원자(A)와 무늬가 들어 있지 않은 원자(B)가 1:1로 섞여 있다. 이 도표는 (가) 원자 A와 B가 섞이는 것과 관련한 이종 원자 사이의 엔트로피와 (나) 원자가 다른 원자를 만날 때 타원의 장축이나 단축 방향이 만나는 방위가 달라지는 것에 기인한 엔트로피를 설명하기 위한 것이다.
그림 7 (a)는 완전히 규칙화가 일어난 장 범위 규칙(long range order, LRO) 상태, (b)는 중간 정도의 규칙화가 일어난 단 범위 규칙 (SRO) 상태, (c)는 높은 불규칙(disorder) 상태를 나타낸 것이다. 도표 하단에 표시되어 있지만 원자의 배열 상태가 오른쪽으로 이동하면 엔트로피가 증가하고, 반대로 왼쪽으로 이동하면 엔트로피가 감소한다.
그림 7에는 붉은 파선의 동일한 크기의 상자가 표시되어 있다. 직관적으로 알 수 있듯이 (a) 상태에서 (b) 상태로 가거나, (b) 상태에서 (c) 상태로 가면 붉은 상자 밖으로 나가는 면적이 증가하는 것을 알 수 있다. 즉, 오른쪽 방향으로 가면 불규칙화 되면서 부피가 늘어나는 반면, 왼쪽으로 가면 규칙화가 일어나게 되며 부피가 줄어든다.
엔트로피는 무질서하면 증가하는 것이다. 그림 7 (a)는 A와 B 원자가 1:1로 LRO를 이루고 있어 가장 규칙화 되어 있어 A와 B 원자의 혼합 엔트로피는 높지만 원자 방향에 의한 전체적인 엔트로피는 낮다. (b)는 (a) 상태가 흐트러져서 배열 엔트로피는 증가한 상태이다. (b)에는 A라고 표시된 초록색의 파선이 그려져 있다. 이 부분의 원자 혼합 상태는 (a)의 같은 위치와 거의 같다. 그러나 원자의 장축 방향 배열이 달라져 있어서 엔트로피가 더 높다. 그림 7 (b)는 타원의 장축이 수평이나 수직으로만 놓여 있는 반면, (c)는 원자 A와 B가 45° 회전되어 있다는 것에 유의해야 한다. A와 B 원자의 배열이 같아도 타원의 장축의 방향이 다르면 더 무질서하고 엔트로피가 증가한다. 즉 (a) → (b) → (c)는 방향으로 가면 불규칙화 되고 엔트로피가 증가한다. 엔트로피는 A와 B 원자의 혼합 상태에 따라서 만 결정되는 것이 아니라는 점을 유의할 필요가 있다.
그림 7에서 설명하려고 하는 것은 규칙화라는 개념에 대한 것이다. 이 도표에서 오른 쪽으로 이동하는 것은 불규칙화(disordering), 왼쪽으로 이동하는 것은 규칙화(ordering)이다. 다르게 표현하면 규칙화는 상대적인 개념이라고 할 수 있으며, 변화되기 이전보다 엔트로피가 높은 상태로 가는 것을 불규칙화라고 하고 반대로 엔트로피가 낮은 상태로 가는 것은 규칙화라고 한다.
열역학에서 엔탈피 차이는 ∆G = ∆E + P∆V − T∆S로 표시되지만, 고체에서 PΔV는 무시할 만큼 작으므로 무시하고 ΔH = ΔE 라고 배웠다. 본 연구에서 WQ 시편이나 CR 시편에서 나타나는 발열(Q)은 엔트로피 감소에 의한 것이다. 따라서 엔탈피(H)나 내부 에너지(E)의 변화가 없다면 Q = TΔS = PΔV가 된다. 따라서 WQ 처리나 냉간 가공에서 엔트로피가 유입되면 격자는 팽창하고, 엔트로피가 감소하면 격자가 수축한다. 지금까지 교과서는 엔트로피 감소가 격자 수축을 유발하는 효과를 아예 다루지 않았었기 때문에 이것을 이해하지 못 하였다.
본 논문의 첫 단계는 X-750 재료에서 SRO 현상이 존재하는 지에 대해 확인하는 것이다. 위에서 확인한 바와 같이 DSC 분석을 통해서 X-750은 SRO 반응을 일어나는 것을 확인하였다. SRO 반응이 격자 수축을 유발하는 것은 많이 보고되어 있다 [5,9-17]. 다양한 Ni-base 합금의 단범위 규칙화 반응의 효과를 연구한 Marucco 등에 따르면 SRO 반응은 격자 변화에 따른 길이 변화, 전기적 및 열적 성질 변화, planar 전위의 형성에 의한 기계적 성질의 변화, 격자 수축 및 음의 크리프 등을 일으킨다고 보고되어 있다. 그러나 중요한 것은 SRO 반응은 X-750 재료에 국한되지 않고 엔트로피가 남아 있는 모든 재료에서는 일어나는 현상이라는 것이다.
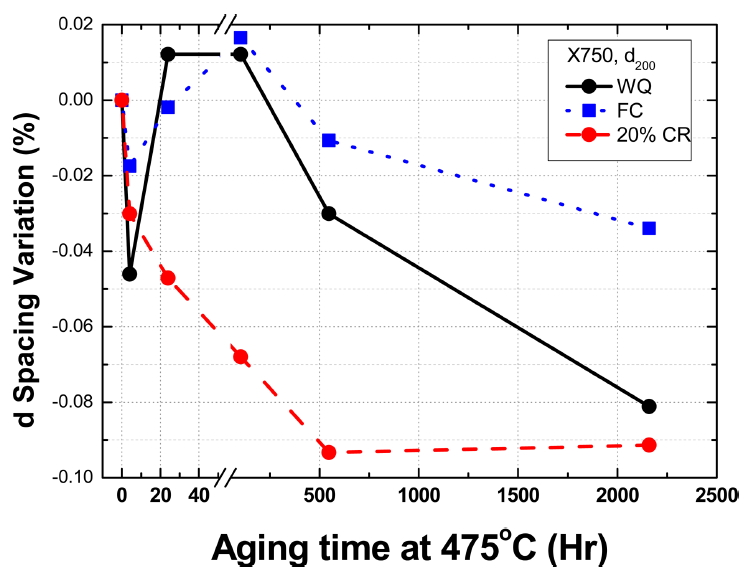
본 논문의 목표는 X-750 합금에서 규칙 반응의 존재와 그에 따른 격자 수축을 확인하는 것이다. 그림 8은 CuKa X-ray를 이용하여 WQ, FC, CR 처리 후 475 °C 규칙화 시간에 따른 (200) 면간 거리의 변화를 함께 비교하여 나타낸 것이다. 규칙화 처리 초기에는 격자의 크기가 증가하는 경우도 있으나 규칙화 시간의 증가에 따라 점진적으로(200) 면의 거리가 줄어든다. FC, WQ, CR 시편은 475 °C에서 2,160시간 동안 규칙화 처리하면 각각 0.03, 0.08, 0.09% 정도 수축한다. 고온에서 WQ 처리하거나 냉간 가공하면 엔트로피가 증가하고 격자는 팽창한다. 이 재료를 규칙화 처리하면 엔트로피가 감소하면서 격자 수축이 일어난다. FC, WQ, CR 시편에서 격자 수축이 점차 커지는 것은 규칙화 처리 과정에서 방출되는 엔트로피의 양이 커지기 때문이다.
DSC 분석을 통해서 X-750은 SRO 반응을 일어나는 것을 확인하였으며, XRD 분석으로 격자 수축을 일어나는 것을 확인하였다. 그러면 SRO 반응에 의한 격자 수축은 입내나 입계에 공동(void)을 형성할 수 있는지 생각해 보자. 규칙화 되면서 0.1% 정도의 수축은 1,000개의 원자 거리에서 1개의 원자만큼 줄어드는 양이다. 약 10 μm의 길이는 약 30,000개 정도의 원자가 놓인 거리이고 여기서 0.1%라면 약 30개의 원자 자리가 비게 된다. 이 정도의 수축은 약 100A 정도의 void를 형성한다. 이렇게 SRO 반응에 의한 수축은 입내나 입계에서 생기는 void의 생성되는 직접적인 원인이 될 수 있다.
X-750 garter spring은 압력관을 둘러싸고 있으므로 핵분열에 따른 고속 중성자 조사 환경에 노출된다. Garter spring이 노출되는 온도는 대략 280-300 °C 정도일 것으로 보이며, 고속 중성자 조사 과정은 형상의 변화는 없지만 재료 내부의 원자 배열을 흩트리기 때문에 불규칙화를 일으킨다. 그러나 그림 4에 CR X-750은 130 °C 이상에서는 발열 반응을 일으키며 규칙화된다는 것을 확인할 수 있다. 300 °C 내외에서 사용되는 X-750에서 고속 중성자 조사는 불규칙화를 일으키고, 동시에 이 온도에서 X-750은 엔트로피 감소를 일으키며 규칙화된다. 원자로가 가동하면 고속 중성자 조사는 지속되므로 X-750 재료의 규칙화는 중성자 조사가 없는 환경에서보다 훨씬 빠르고 중성자 조사가 엔트로피를 증가시키므로 지속적으로 일어날 것이다. 즉, 비조사 재료는 규칙화 효과가 언젠가 포화되지만, 중성자 조사 환경에 노출된 재료는 조사에 따라 규칙화가 포화되지 않고 지속된다.
X-750에서 중성자 조사에 의하여 증가하는 엔트로피는 고엔트로피 합금(high-entropy alloy, HEA)에서 고려하는 엔트로피와는 성격이 다르다 [26]. 최근 연구되고 있는 HEA 중 하나인 CoCrFeMnNi 합금에서 고려하는 엔트로피는 합금 원소가 얼마나 골고루 섞일 수 있는지를 나타내는 성분이다. 반면, 본 연구에서 다루는 엔트로피는 원자가 구가 아니므로 원자의 특정 축이 이웃 원자와 어떻게 만나는가에 따라 형성되는 엔트로피이다.
따라서 X-750 합금의 garter spring 재료는 원자로 가동 환경에서 빠르고 지속적으로 규칙화를 일으키고, 규칙화에 따른 격자 수축은 입계 및 입내에 void를 형성시켜 입계 파괴를 일으키는 직접적인 원인을 제공한다고 판단할 수 있다. 이 void는 핵반응에 의해 형성되는 He 기체가 상대적으로 압력을 적게 받는 공간을 제공함으로써 He bubble 형성 위치를 제공할 것으로 보인다.
5. 결 론
여러 조건으로 처리된 X-750 Ni-base 합금에 대한 DSC 및 XRD 분석 결과 다음과 같은 결론을 얻었다.
1. WQ 시편은 500-700 °C에서 발열을 수반한 SRO 반응을 일으키고, Tc가 각각 578 °C 및 671 °C인 SRO 반응의 본질은 각각 Ni2Cr 및 CrFe SRO 반응으로 보인다.
2. WQ 시편에서 Ni2Cr 및 CrFe SRO 반응에 대한 Q는 각각 217 및 303 kJ/mol로, 발열 양은 13 J/g로 나타났다.
3. 20% CR 시편은 130-520 °C에서 발열을 수반한 SRO 반응을 일으키는데, 이것은 냉간 가공이 Ni2Cr 및 Ni-Fe SRO 반응이 엔트로피를 방출하여 낮은 온도에서 일어나도록 하는 구동력을 제공하기 때문이다.
4. 475 °C에서 2,160시간 규칙화 처리한 WQ+O 및 CR+O 시편은 490-670 °C에서 흡열 반응을 일으키며, 이것은 규칙화 처리 과정에서 형성된 SRO가 불규칙화 되면서 흡열하기 때문이다
5. FC, WQ, CR 시편을 475 °C에서 규칙화 처리하면(200) 면간 거리는 시간에 따라 감소하며 2,160시간 처리하면 각각 0.03, 0.08, 0.09% 정도 수축한다.