폐리튬이온전지 재활용 공정 폐액으로부터 리튬의 회수를 위한 인산리튬 침전 특성 연구
Recovery of Lithium as Li3PO4 from Waste Water in a LIB Recycling Process
Article information
Trans Abstract
This study was conducted to obtain engineering design data for a process to recover lithium in the form of Li3PO4 from the waste water of a lithium ion battery (LIB) recycling process. The influence of temperature, pH, and concentration on the solubility of Li3PO4 and the reaction rate in the Na3PO4-Li2SO4-H2O system was investigated. As a result, the solubility of Li3PO4, 372 mg/L, increased to 417 mg/L as the reaction temperature increased from 20 to 90 ℃. At the same time, the reaction rate increased from 0.0174 × 10-4 to 2.32 × 10-4 mol/L·s. The yield of lithium phosphate rises in proportion to increases in the concentration of salt, temperature and pH, in the reaction of 3Li2SO4 + 2Na3PO4 → 2Li3PO4 + 3Na2SO4. That is, the higher the concentration, temperature and pH solution are, the more Li3PO4 precipitates. The temperature must be 70 ℃ or higher to obtain 90% or more Li3PO4 as a precipitate. The lithium phosphate particle formed at 20 ℃ are composed of secondary particles or their agglomerate, which is composed of primary particles of 0.01 µm or less size. The size of the primary particle becomes bigger when the reaction temperature is raised and at 90 ℃ it becomes a large columnar particle, with a 10~20 µm length and 5~10 µm breadth.
1. 서 론
유리공업과 윤활유 제조 등에 주로 사용되던 리튬은 2000년대에 들어서 리튬이온전지가 상용화되면서 그 수요량과 가격이 급증하고 있으며, 리튬의 생산과 응용에 연구자들의 관심도 높아지고 있다. 리튬은 용도와 수요자의 요구에 따라 탄산리튬, 수산화리튬, 황산리튬 등의 형태로 생산되고 있으며 2012년 기준 리튬의 용도별 수요는 건전지용 35%, 유리용 26%, 윤활유용 13%, 합금용 8%, 공조냉매용 4%, 고분자용 3%, 의료용 3% 그리고 기타 8% 등이었으나 그 후 건전지 용도의 수요량이 급격히 증가하는 추세에 있다 [1]. 전세계 리튬화합물의 총생산량은 2008년 27,200톤(금속리튬으로 환산한 양, 미국 제외)에서 2012년 36,600톤으로 연 평균 8.6%의 성장율을 나타내었으며[2], 중국의 전기자동차 생산을 본격화한 2013년도부터는 그 수요와 가격이 더욱 급격하게 증가하고 있다 [3]. 일본, 중국과 함께 세계3대 리튬이차전지[18,19] 생산국 중 하나인 우리나라는 탄산리튬과 수산화리튬 등의 리튬화합물을 대부분 수입하고 있으며 그 양은 전세계 리튬수요량의 10%를 넘는다 [4,5]. 최근 우리나라의 탄산리튬 수입량을 나타낸 표1은 탄산리튬 수입량이 2010년 7,988톤에서 2017년 20,754톤으로 연평균 20%의 성장률을 나타내었고 가격 또한 연평균 16.6% 정도의 상승을 나타내고 있다.
이러한 공급부족의 심화가 예상되고 있는 상황에서 리튬 자원 확보를 위한 각국의 경쟁이 매우 치열해지고 있으며, 우리나라는 중국과 일본의 적극적이고 치밀한 리튬확보 전략에 밀려 상대적으로 매우 적은 리튬자원만을 확보하고 있는 상태이다 [6,7].
리튬은 주로 염수와 광석으로부터 생산되고 있으며 그 중에서 염수로부터 생산되는 양이 76% 정도이다 [8]. 염수로부터 리튬을 생산하는 국가로는 칠레와 아르헨티나가 있고 광석으로부터 리튬을 생산하고 있는 국가는 호주, 중국, 포르트갈 등이 있다 [9].
염수로부터 탄산리튬을 생산하는 비용은 2-3 $/kg으로 광석으로부터 제조하는 비용(6-8 $/kg) 보다 매우 저렴하지만 제품의 순도가 낮고 품질이 불균일하며 회수율과 생산속도가 매우 낮은 단점을 갖는다 [10]. 따라서 염수로부터 보다 높은 회수율과 생산속도로 탄산리튬을 생산하기 위한 연구[11]들이 진행되고 있으며 그 중에서 인산리튬 침전법도 경제성이 우수한 것으로 평가되어 연구가 진행되고 있으나 그 결과들은 특허출원의 형태로만 공개되고 학술논문으로는 발표된 바는 없어 그 내용을 자세히 알기 어렵다.
우리나라에서는 폐리튬이차전지등으로부터 코발트와 니켈을 회수하는 공정에서 발생하는 폐수에 포함되어 있는 리튬을 인산리튬의 형태로 회수하는 공정[12,13]이 개발되어 운영되고 있다. 이 기술은 폐리튬이차전지 또는 이차전지 제조공정 스크랩을 파쇄-선별 후 분말상으로 얻어지는 양극활물질과 음극활물질 등의 혼합물을 황산으로 용해시킨 다음 용매 추출로 코발트와 니켈을 회수하고 나서 버려지는 폐수에 3,000mg/L 정도의 농도로 함유되어 있는 리튬을 인산리튬으로 침전시켜 제거하는 공정이다. 본 논문은 상기 인산리튬 침전 반응의 메카니즘을 설명하기 위하여 수행되었으며, 황산리튬수용액과 인산나트륨수용액을 반응시켜 인산리튬을 침전시키는 반응에 있어서 반응조건에 따른 인산리튬 침전의 입도와 형상, 수율 그리고 결정화도 등의 변화와 침전반응속도등에 대하여 기술한다. 또한 침전반응으로 인산리튬을 회수하고자 하는 경우 그 수율에 직접적인 영향을 미치는 용해도의 변화를 온도와 pH를 변수로하여 관찰하였다.
2. 실험방법
2.1. 시약 및 실험장치
불순물의 영향을 배제하기 위하여 특급시약을 사용하여 제조된 황산리튬 수용액과 인산나트륨 수용액을 사용하였다.
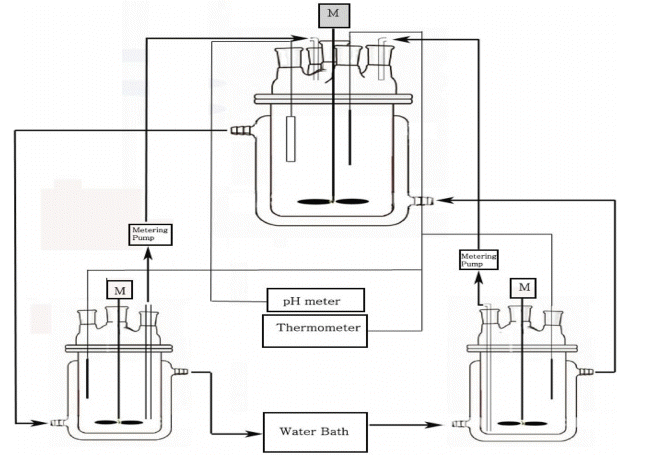
그림 1은 본 연구에 사용된 실험장치로 1) 온도조절용 물재킷이 부착된 500 ml 용량의 유리제 반응용기 2개와 1000 ml 반응용기, 2) 강제순환형 항온수조, 3) 정량펌프, 4) 기계식 교반기, 5) pH미터, 6) 온도계로 구성된다. 탄산가스의 유입에 의한 영향을 배제하기 위하여 각 반응조의 상부에 아르곤 가스를 50 ml/min의 유량으로 불어넣었다. 교반기의 임펠러는 76 × 17 mm2의 단면적을 갖는 테프론이 코팅된 제품을 사용하였으며, 교반속도는 100 rpm으로 고정하여 사용하였다.
리튬의 분석은 불꽃방출분광법(flame emission photometric method)[14]으로 하였으며 Jenway사의 화염광도계(flame photometer) Model PFP7을 사용하였다. X-선 회절분석은 분말회절분석법으로 행하였고 Rigaku사의 고분해능 X-ray 회절계(high resolution X-ray diffractometer) D/Max-2500V를 사용하였으며, 주사전자현미경(scanning electron microscope, SEM)은 Jeol사의 JSM-6300을 사용하였다.
2.2. 실험방법
2.2.1. 인산리튬의 성상에 미치는 Li2SO4수용액 농도의 영향
0.2 mol/L 농도의 Na3PO4 수용액 333 ml에 당량의 황산리튬 수용액을 첨가하여 인산리튬 침전을 생성시키는 과정에서 황산리튬 수용액의 농도를 0.1, 0.2, 0.4, 0.8, 1.6 mol/L로 변화 시켜 생성물의 미세구조와 그 중량의 변화를 관찰하였다. 즉 20℃로 조절된 Na3PO4 0.2 mol/L 수용액 333 ml에 대하여 황산리튬 0.1 mol/L수용액 1,000 ml, 0.2 mol/L수용액은 500 ml, 0.4 mol/L 수용액은 250 ml, 0.8 mol/L 수용액은 125 ml, 1.6 mol/L 수용액은 67 ml를 각각 20℃가 되도록 한 다음 100 rpm으로 교반 중인 인산나트륨 수용액에 50 ml/mim 속도로 주입을 하고, 주입 완료 후 60분간 교반을 계속한 다음 생성물을 여과하였다. 생성물을 105℃에서 2시간 건조 후 무게를 측정하여 기록하였고, 입자의 크기와 미세구조는 건조시료를 백금코팅 후 전계방사형 주사전자현미경을 사용하여 관찰하였다.
2.2.2. Na3PO4 용액 농도의 영향
0.2 mol/L Li2SO4 수용액 500 ml에 주입 하는 Na3PO4 수용액의 농도를 0.1 mol/L(667 ml), 0.2 mol/L(333 ml), 0.4 mol/L(167 ml), 0.8 mol/L(83 ml)로 변화 시켜 생성물의 형상과 중량변화를 관찰하였다. 인산리튬수용액의 농도와 인산리튬수용액을 황산리튬수용액에 주입 하는 것 외에는 모두 2.2.1과 동일한 조건으로 실험하였다.
2.2.3. 온도의 영향
0.2 mol/L 농도의 Na3PO4 수용액 333 ml에 0.2 mol/L 농도의 Li2SO4 수용액 500 ml를 50 ml/min으로 주입하여 인산리튬 침전을 생성시키는 반응에 있어서 반응온도를 10, 20, 30, 40, 50, 70, 90℃로 변화시켜 인산리튬 침전의 크기와 형상, 결정성, 수율에 미치는 영향을 조사하였다. 수율은 침전으로 얻어지는 인산리튬의 중량을 이론 침전량에 대한 백분율로 나타내었으며, 본 실험의 경우 이론 침전량은 0.0667 mol/L Li3PO4 해당하는 7.725 g에 인산리튬의 용해도 0.325 g/833 ml를 차감한 7.4 g이다.
2.2.4. 반응온도에 따른 반응속도
0.2 mol/L 농도의 Na3PO4 수용액 333 ml에 0.2 mol/L 농도의 Li3PO4 수용액 500 ml를 사전에 반응온도인 20, 30, 40, 50, 70, 90℃가 되도록 한 다음 황산리튬 수용액을 한꺼번에 인산나트륨 수용액에 주입하고 100 rpm으로 교반하면서 일정 시간 간격으로 시료를 채취하여 시린지필터로 여과한 다음 여액 속에 잔류하는 리튬이온의 농도를 분석하였다.
2.2.5. 온도에 따른 Li3PO4의 용해속도와 용해도
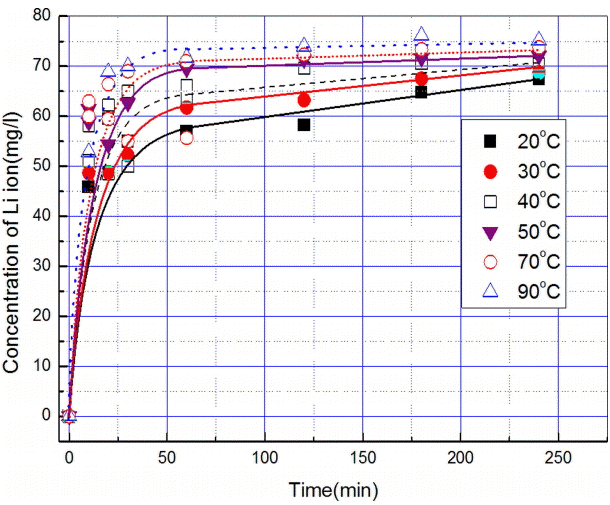
반응온도에 따른 Li3PO4의 용해속도와 용해도의 변화를 관찰하기 위하여 반응온도인 20, 30, 40, 50, 70, 90℃로 조절된 증류수 500 ml에 10 g의 인산리튬을 일시에 첨가한 다음 일정 시간 간격으로 시료를 채취하여 용해된 리튬의 농도를 분석하였다.
탄산이온의 영향을 배제하기 위하여 용매인 증류수를 사용 직전에 끊여서 CO2를 최대한 제거한 다음 밀봉 상태에서 냉각하여 사용하였다.
증류수의 증발에 의한 액량의 변화를 방지하기 위하여 그림 1의 반응용기에 응축기가 부착하여 사용하였다.
2.2.6. pH에 따른 Li3PO4의 용해도
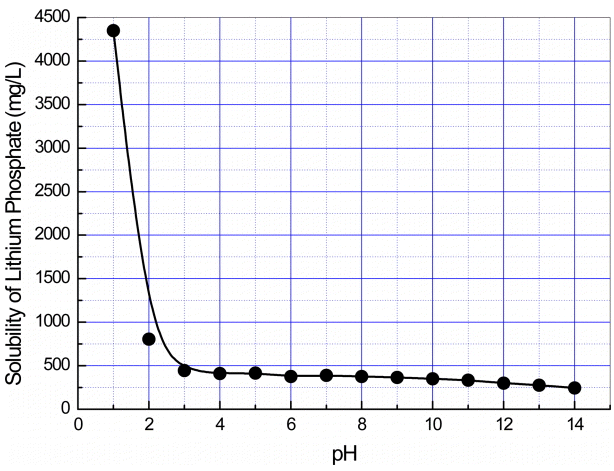
pH에 따른 Li3PO4의 용해도를 측정하기 위해서 1 N H3PO4 용액과 1 N의 NaOH를 사용하여 용매인 증류수의 pH를 사전에 1~14가 되도록 조절한 증류수 500 ml에 10 g의 인산리튬을 일시에 첨가하고 100 rpm으로 4시간 동한 교반 후 시료를 채취하여 용해된 리튬의 농도를 분석하였다. 용해 반응기의 온도는 20℃를 유지하였으며, 상기 용해속도 측정 시와 동일한 요령으로 실험하였다.
3. 실험결과 및 고찰
3.1. 인산리튬의 성상에 미치는 Li2SO4 수용액 농도의 영향
Na3PO4 수용액의 농도를 0.2 mol/L로 고정하고 여기에 첨가되는 황산리튬 수용액의 농도를 변화 시켜 침전반응을 진행시키고 이 때 얻어지는 생성물의 미세구조와 그 중량의 변화를 관찰 결과, 0.1 mol/L의 황산리튬을 주입한 경우는 침전을 전혀 생성하지 않았고, 0.2 mol/L의 황산리튬을 주입한 경우는 4.47 g의 인산리튬 침전을 생성하였으며, 0.4 mol/L 일때 5.69 g, 0.8 mol/L에서 6.29 g, 1.6 mol/L에서 6.60 g을 생성하였다. 인산리튬의 용해도가 0.30 g/L[15] 임을 고려할 때 생성물의 중량은 7.3~7.5 g 정도가 되어야 함에도 침전물의 중량이 그에 미치지 못하는 것은 20℃에서는 인산리튬 수용액이 과포화 상태를 유지하려는 경향때문에 임계크기[16]가 커짐에 따라 결정으로 성장하지 못하고 씨눈(embryo) 단계에 머무르거나 용해되어 소멸되는 양이 많아지기 때문으로 생각된다. 상기 인산리튬 침전을 회수하고 난 여과액을 90℃ 이상으로 가열하면 침전하지 못했던 인산리튬이 완전히 침전하는 현상은 이러한 생각을 뒷받침한다.
그림 2의 SEM 사진에서는 20℃에서 생성하는 인산리튬 입자가 0.01 μm 이하의 극미세 1차입자 들이 응집하여 0.1~2 μm의 2차 입자를 이루고 이들이 다시 응집하여 1~10 μm의 3차 입자와 이들의 10~100 μm 크기로 응집한 4차 입자로 구성되어 있음이 관찰된다.
5,000배로 관찰한 그림 2(e)에서 1차입자는 너무 미세하여 사진만으로는 그 형상과 크기를 판단하기 어려우나 입방형에 가까운 0.01 μm 정도의 입자들로 구성되어 있는 것으로 추정되고, 2차 입자는 입자의 중심에서부터 바깥쪽으로 1차 입자들이 응집하면서 성장한 형태를 보인다. 그 크기는 가로와 세로가 0.1~0.3 μm이고 길이가 1~2 μm정도로 관찰된다. 이들이 응집하여 생성된 3차입자들은 대부분 구형을 하고 있으며, 그 크기는 1~10 μm이고 황산리튬의 농도가 높을수록 크기가 커지는 경향을 보인다. 구형 3차입자의 응집물인 4차입자의 크기도 황산리튬의 농도가 증가할수록 커지는 경향을 보인다.
이와 같은 현상이 나타나는 이유는 본 실험의 조건범위에서는 교반에 의한 확산이나 성분이온들의 재배열에 의한 결정성장 보다는 인산리튬의 결정핵 생성 반응이 우세하며, 따라서 결정핵 또는 그와 유사한 크기의 입자들의 응집 정도에 따라 생성되는 입자의 크기와 형상이 결정되는 것으로 생각된다.
3.2. Na3PO4 용액 농도의 영향
황산리튬 수용액의 농도를 0.2 mol/L로 고정하고 여기에 주입되는 인산나트륨 수용액의 농도를 변화시켜 침전반응을 진행시키고 이 때 얻어지는 생성물의 미세구조와 그 중량의 변화를 관찰하였다.
여러 농도에서 생성된 인산리튬 입자의 모양과 형상은 농도가 높을수록 구형의 3차입자의 크기와 그들이 응집물인 4차입자의 크기가 커졌던 3.1의 결과와 비슷한 경향을 나타냄을 그림 3에서 관찰할 수 있다. 이러한 현상이 나타나는 이유는 반응액의 농도가 높을수록 자발적핵생성에 의한 핵생성이 결정성장 보다 우선하게 되어 생성되는 일차입자의 크기는 작아지고 그 수는 많아지게 되며, 이 입자들의 응집 정도에 따라 생성되는 입자의 크기와 형상이 결정되는 것으로 생각된다.
한편 침전된 인산리튬의 양은 3.1실험 결과와 매우 다른 결과를 보인다. 그림 4의 결과에서 0.2 mol/L 농도의 Li2SO4 수용액 500 ml에 0.1 mol/L 농도의 Na3PO4 수용액 667 ml를 주입한 경우는 인산리튬 침전이 전혀 생성하지 않았으며 0.2 mol/L 농도의 Na3PO4 수용액 333 ml를 주입한 경우는 0.01 g 정도의 극 미량의 인산리튬만이 생성하였다. Na3PO4 수용액의 농도가 0.4 mol/L, 0.8 mol/L로 증가함에 따라 인산리튬의 수율은 급격히 증가함이 관찰된다.
이와 같은 현상들이 나타난 가장 큰 원인은 반응액의 pH가 원인일 것으로 판단된다. 즉 pH가 13정도인 0.2 mol/L Na3PO4 수용액에 pH 6정도인 Li2SO4 수용액을 주입하는 반응에서는 인산리튬의 용해도가 비교적 낮은 환경이기 때문에 결정핵 생성이 용이하여 침전 생성이 비교적 많아지지만, 반대의 경우는 결정핵 생성단계인 반응 초기에 반응액의 pH가 낮아 공급되는 인산이온(PO43-)은 HPO42- 나 H2PO4-로 전이되어 용해도가 높은 Li2HPO4 나 LiH2PO4의 생성환경을 제공하기 때문으로 생각된다.
3.3 온도의 영향
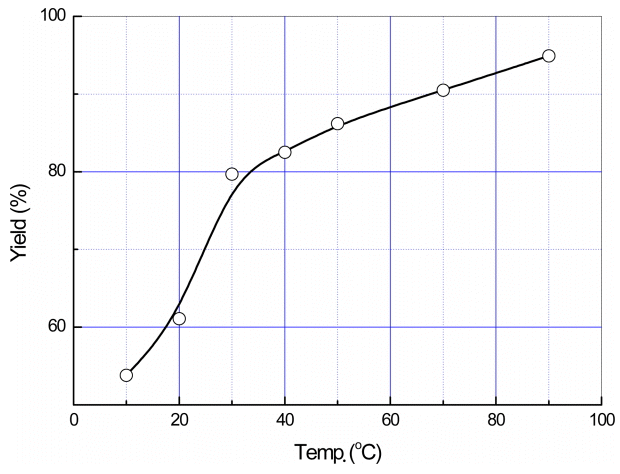
반응 온도에 따른 수율변화를 나타낸 그림 5의 결과에서 인산리튬의 수율은 반응온도의 증가에 비례하여 급격히 증가함을 알 수 있다. 즉, 10℃에서 54% 정도의 수율을 나타내지만 90℃에서는 95% 정도의 수율을 나타낸다.
반응온도의 변화에 따른 인산리튬 입자의 크기와 모양의 변화를 관찰한 그림 6의 SEM 사진에서 20℃에서는 상기 3.1에서 관찰한 바와 같이 0.01 μm 이하의 극미세 1차입자 들이 응집하여 2차, 3차, 4차 입자를 순차적으로 구성하는 특징을 보이지만, 30℃ 에서는 극미세 1차 입자들은 거의 관찰되지 않고 크기가 1~3 μm인 1차입자들과 이들이 응집한 30~60 μm의 2차 입자들만이 관찰된다. 40, 50, 70, 90℃로 반응온도가 상승함에 따라 1차입자의 크기는 점점커지는 경향을 관찰할 수 있으며, 특히 90℃에서는 단경이 5~10 μm이고 장경이 10~ 20 μm인 주상의 독립 입자들이 생성이 현저히 증가하였음을 알 수 있다.
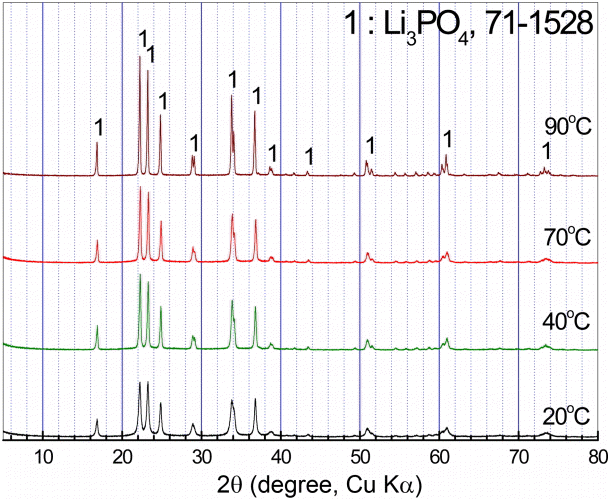
이들에 대한 X선 회절 패턴을 조사하여 나타낸 그림 7의 결과에서는 모든 회절피크가 인산리튬(Li3PO4)의 피크이며 다른 결정구조를 갖는 물질은 존재하지 않음을 알 수 있다.
또한 20℃에서 생성한 인산리튬의 회절선에서는 반가폭[17](Full Width at Half Maximum, FWHM)이 매우 커서 결정립의 크기가 미세하고 결정화도가 낮음을 반영하고 있으며, 90℃에서 생성된 인산리튬의 회절선은 반가폭이 작아 결정립이 크기와 결정화도가 증가하였음을 보여주고 있다.
3.4. 반응온도에 따른 반응속도
반응온도와 시간에 따른 용액내 리튬이온의 농도 감소를 나타낸 그림 8의 결과에서 저온 영역에서는 침전물이 생성할 때 까지 다소의 시간이 걸리는 현상이 관찰된다. 즉, 20℃에서는 반응개시 후 60분, 30℃에서는 20분, 40℃에서는 10분이 경과 후부터 침전의 생성에 따른 리튬이온 농도의 감소가 관찰된다. 50℃ 보다 높은 온도에서는 이러한 지연현상이 관찰되지 않는다. 지연현상의 원인은 낮은 온도에서는 결정성장 속도가 느려 임계크기 이상으로 성장하지 못하고 씨눈(embryo) 단계에 머무르거나 재용해되어 소멸되는 인산리튬 분자의 량이 많아지기 때문으로 생각된다.

Concentration of Li+ as a function of time and temperature in the reaction of 3Li2SO4 + 2Na3PO4 → 2Li3PO4 + 3Na2SO4.
또한 그림의 결과에서 반응온도가 높을수록 용존 리튬이온의 농도 감소속도가 빨라짐이 관찰되며 이는 인산리튬 침전 반응속도가 빨라짐을 의미한다.
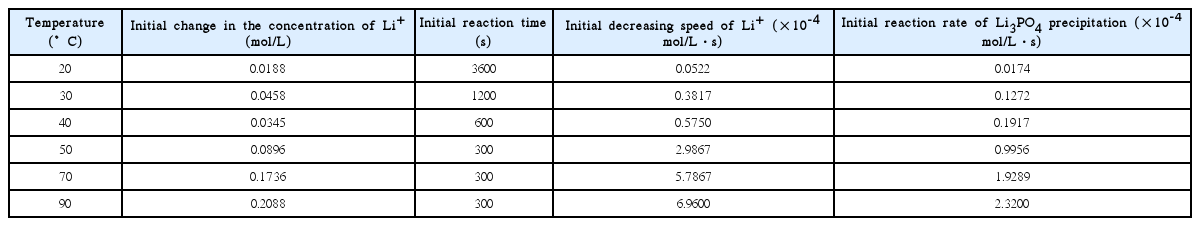
그림 8의 자료를 사용하여 반응온도에 따른 인산리튬 침전반응의 초기속도를 계산하여 나타낸 표 2의 결과에서 인산리튬 침전반응의 속도는 20℃에서 0.0174 × 10-4 mol/L·s이지만 90℃에서는 2.32 × 10-4 mol/L·s로 약 133배 증가함을 알 수 있다. 따라서 황산염 수용액 내의 용존 리튬을 인산리튬으로 침전시켜 회수하고자 하는 경우 반응온도는 매우 중요한 인자가 되며, 반응온도가 높을수록 회수율이 높아지고 반응에 소요되는 시간이 짧아 경제적일 것으로 생각된다.
3.5. 온도에 따른 Li3PO4의 용해속도와 용해도
반응온도에 따른 Li3PO4의 용해속도와 용해도의 변화를 관찰한 그림 9의 결과에서 20℃에서 240분간 용해된 리튬의 농도는 67 mg/L(Li3PO4로 환산시 372 mg/L) 90℃에서의 농도는 75 mg/L(Li3PO4로 환산시 417 mg/L)로 인산리튬의 용해도는 온도에 따라 증가함을 보인다. 용해반응 속도 또한 20℃에서는 1시간 만에 4시간 후 용해량의 83%가 용해하는 반면 90℃에서는 20분 만에 4시간 후 용해량의 92%가 용해되어 온도가 높을수록 빨라지는 경향으로 보인다.
3.6. pH에 따른 Li3PO4의 용해도
pH에 따른 Li3PO4의 용해도 변화를 측정한 그림 10의 결과에서 pH가 4 이상인 영역에서는 인산리튬의 용해도가 pH 4에서 411 mg/L이고 pH 14에서는 244 mg/L로 pH의 증가와 함께 약간씩 감소하는 경향을 보이나, pH가 3 이하인 영역에서는 수소이온 농도의 증가에 따라 인삼리튬의 용해도가 급격히 증가하는 현상을 보여준다. 또한, 용매의 pH가 12 이상인 경우는 인산리튬 첨가 후 반응 종료 시까지 용매의 pH에 거의 변화가 없었지만, 용매의 pH가 11 이하인 경우는 인산리튬 첨가 후 반응액의 pH가 서서히 상승하여 4시간 후에는 11.0~11.5의 값으로 안정화 되는 현상을 보였다. 이러한 현상이 나타나는 이유는 인산리튬의 용해로 생성되는 PO43- 의 가수분해 반응에 기인하는 것으로 보인다. 즉 아래의 가수분해 반응에서 생성하는 OH-가 반응액의 pH를 11~11.5가 되도록 하는 역할을 하는 것으로 보인다.
pH가 높아져 OH-의 농도가 높아지면 용해반응을 촉진하는 오른쪽 방향으로의 반응이 억제되어 용해도가 낮아지고 H+의 농도가 높아지면 반대의 이유로 용해도가 높아지는 것으로 보인다.
4. 결 론
폐리튬이차전지로부터 코발트와 니켈을 회수하는 공정에서 발생하는 폐수에 포함되어 있는 리튬을 인산리튬의 형태로 회수하는 공정의 개발을 위한 본 연구의 결과를 요약하면 다음과 같다.
1. 황산리튬 수용액과 인산나트륨 수용액을 반응시켜 인산리튬 침전을 얻는 반응(3Li2SO4 + 2Na3PO4 → 2Li3PO4 + 3Na2SO4)에 있어서 반응용액의 농도가 높을수록 pH가 높은 환경일수록 침전의 수율은 향상된다.
2. 반응온도가 높을수록 인산리튬의 수율이 증가하며 90% 이상의 수율을 얻기 위해서는 70℃ 이상이어야 한다.
3. 20℃에서 생성하는 인산리튬은 0.01 μm 이하의 극미세 1차 입자 들이 응집한 2차, 3차 입자로 구성되지만 반응 온도의 상승에 1차 입자의 크기가 증가하고 응집입자들은 감소하는 경향을 보이며 90℃에서는 단경이 5~10 μm이고 장경이 10~20 μm인 주상의 독립 입자들이 생성이 현저히 증가한다.
4. 0.2 mol/L 농도의 Na3PO4 수용액과 Li2SO4 수용액을 반응시켜 인산리튬을 침전시키는 반응의 속도는 20℃에서 0.0174 × 10-4 mol/L·s이지만 90℃에서는 2.32 × 10-4 mol/L·s로 약 133배 증가한다.
5. 인산리튬의 용해속도는 온도가 높을수록 빨라지고 용해도도 20℃에서 372 mg/L 이지만 90℃에서는 417 mg/L로 증가한다.
6. 인산리튬 포화수용액의 pH는 11.0~11.5의 값을 나타내고, pH의 증가하면 용해도가 감소하는 경향이 있으며 pH 3이하의 산성영역에서는 H+의 농도에 비례하여 용해도가 증가한다.
Acknowledgements
본 연구는 2018년도 혁신도시 공공기관 연계육성사업( 과제번호 p0002063)의 연구비 지원과 2015년도 강원대학교 대학회계 학술연구조성비로 연구하였음(관리번호201510034).