Ti-6Al-4V합금에서 양극산화 공정변수가 TIO2 나노튜브 형성에 미치는 영향
Effect of Anodic Oxidation Process Parameters on TIO2 Nanotube Formation in Ti-6Al-4V Alloys
Article information
Trans Abstract
To investigate the effect of anodic oxidation process parameters on TIO2 nanotube formation in Ti-6Al-4V alloys, the composition of NH4F and H2O in the anodic oxidation processes were changed under the conditions of constant DC power ranging from 20 V to 60V and current density ranging from 10 mA to 30 mA. As the amount of NH4F was increased, the surface reaction rate became faster and surface dissolution also became more active. This result can be explained by the fact that TIO2 nanotubes were basically formed in the TIO2 layer located in the front of the Ti matrix by selective dissolution of the oxide layer, due to F - ions existing in the electrolytes. In anodic oxidation in ethylene glycol + 0.2 wt% NH4F with different amounts of water ranging from 0 ~ 8 vol%, the increase in the amount of water resulted in an increase in both the diameter and the length of growing nanotubes. When the voltage increased, the diameter and the length of the nanotubes tended to increase. But no nanotubes were formed at the voltage and the current density lower than a certain critical value. An increase in electrolytic holding time resulted in the diameter of the nanotubes increasing and decreasing repeatedly, but eventually increasing. X-ray analysis indicated that the as-grown nanotubes were amorphous while the anatase phase and the rutile phase were detected after anodic oxidation treatment, followed by annealing at 650 °C under Ar atmosphere for 2 hours.
1. 서 론
의료기술의 발전과 심각한 고령화 사회의 진행으로 지난 10년간 손상된 골조직을 대체할 금속 임플란트의 수요가 급증하고 있다. 임플란트로 사용되는 생체재료는 강도, 인성, 내식성, 내마모성이 우수함과 동시에 인체에 무해하고 골과 결합하는 생체친화성이 요구된다. 이러한 특성을 갖는 대표적인 생체금속재료에는 스테인레스강, Co-Cr-Mo합금 및 타이타늄합금이 있으며 이들 금속재료는 현재 체내 이식용 임플란트 재료들의 70% 이상을 차지하고 있다 [1]. 그중에서도 타이타늄합금은 가볍고 비자성이며 강도, 인성, 내식성 등의 뛰어난 기계적 특성과 함께 생체적합성도 우수하여 오늘날에 널리 이용되고 있다. 생체재료의 개발 초기에는 손상된 조직을 대체하기 위한 재료로서의 연구가 이루어져 왔으나, 최근에는 위의 목적 외에 추가적으로 세포와의 결합이 용이한 재료 표면에 대한 연구가 많이 수행되고 있다 [2]. 타이타늄과 그 합금도 생체활성 (bioactive)이 없기 때문에 골세포 분화가 느려 치유기간이 길고, 골과 재료 사이의 결합력이 약하다는 단점을 가지고 있다 [3]. 이를 극복하기 위하여 다양한 표면 처리와 표면 개질에 대한 연구가 끊임없이 보고되고 있다 [4,5]. 대표적인 표면처리 방법으로는 샌드 블라스팅, 에칭, 양극산화법 등이 있다 [6]. 양극산화법은 전기화학적으로 타이타늄 표면에 산화피막을 형성시키는 방법으로 전해액의 종류, 조성, 인가전압 등의 조건에 따라 산화피막의 구조가 달라져 이 분야에 대한 많은 연구가 진행되고 있다 [7].
한편 세포가 생체재료표면에서 분화될 때 생존여부에 큰 영향을 미치는 국소접착(focal adhesion)이라는 것이 존재한다 [8,9]. 최근 Kuo 등은 세포의 생존율이 국소접착의 크기가 50 ~ 200 nm 정도에서 가장 높아진다고 보고하였으며 [10], 이로 인해 나노구조 패턴을 이용하여 세포를 잘 결합시키는 방법에 대한 연구가 최근 활발하다. 타이타늄 합금표면에 TIO2 나노튜브를 성장시키는 방법으로는 졸겔법, 분말화학처리법, 양극산화법 등이 알려져 있으며, Zwilling 등은 1999년 HF를 포함하는 전해질에서 양극산화를 이용하여 타이타늄과 타이타늄 합금 표면에 TIO2 나노튜브를 형성시켰으나 HF의 강한 용해성으로 인해 튜브의 길이를 500 nm 이상 성장 시킬 수 없었다 [11,12]. 이후 Danookdharree, U 등은 HF 대신 전해질에 NH4F를 혼합하여 pH를 조절하는 방법으로 TIO2의 용해 속도를 감소시켜 나노튜브를 더욱 성장 시킬 수 있다고 보고하였다 [13]. 이러한 관점에서 볼 때 TIO2 나노튜브는 제조방법이 쉽고 전해질, F- 이온 및 증류수의 농도, 인가 전압, 양극산화 시간 및 온도등의 공정변수 변화를 시켜 나노 튜브의 크기와 형태를 제어 할 수 있기 때문에 특정 세포의 분화와 성장에 맞게 TIO2 나노 튜브를 맞춤형으로 조절할 수 있어 중요하다고 할 수 있다. 2008년 Choi 등은 NH4F 용액을 이용하여 Ti 합금의 표면에 나노튜브를 형성시킬때에 전해질에 포함된 물의 함량이 나노튜브형성에 미치는 영향과 나노튜브의 성장거동을 규명하였으나 [14], 다양한 양극산화 조건에 따른 나노튜브 형성 거동에 대한 연구는 아직 많지 않은 수준이다.
이에 본 연구의 목적은 NH4F 용액을 이용한 양극산화처리로 타이타늄 합금의 나노튜브를 형성하여 생체재료 표면에 거칠기(surface roughness)를 향상시키고, 전해질, F-이온 및 증류수의 농도, 인가전압, 양극산화 시간을 조절함으로써 나노튜브의 표면형상의 변화를 관찰하고 각 조건에 따른 표면의 형상학적 차이를 비교함으로서 세포별 분화에 적합한 크기의 형상을 갖는 적절한 조건을 파악하고자 하였다.
2. 실험 방법
본 연구에서 사용된 시편은 30 × 60×1mm 의 Ti6Al4V ELI(Extra Low Interstitials) 합금 판을 사용하였다. 시편은 #220, #400, #800, #1500, #2000의 SiC 연마지로 순차적으로 연마하였고 연마된 시편의 표면에 있는 불순물을 제거하기 위하여 HF + HNO3 + H2O 용액에서 10초간 화학연마를 실시 후 에탄올, 증류수 순으로 10분간 초음파 세척하였다. 양극산화에 사용한 전해질 수용액으로는 에틸렌글리콜(C2H4(OH)2, OCI, Korea)에 불화암모늄(NH4F, Junsei Chemical, Japan)과 H2O로서, 400 ml의 에틸렌글리콜 용액에 불화암모늄의 농도를 0.2wt%, 0.4 wt%, 0.6 wt%, 물의 농도를 0 vol%, 2 vol%, 4 vol%, 6 vol%, 8 vol%로 변화시켜 수용액을 만든 후 1시간 동안 마그네틱바를 이용하여 1000 rpm의 속도로 교반하여 완전히 용해시켰다. TIO2 나노튜브를 형성하기 위해 DC전원장치의 양극과 음극에 각각 준비한 타이타늄 시편과 백금 메쉬망을 연결 후 20 mm 떨어진 위치에 마주하도록 고정하고 전해질 수용액 중에 위치시켰다. DC 정전압을 20, 30, 40, 50, 60 V, 전류밀도 10, 20, 30 mA/cm2의 조건에서 각각 0.5, 1, 2, 4, 8, 16 시간동안 인가하여 400 rpm으로 교반해주며 양극산화 처리하였다. 양극산화 처리가 끝난 후에는 시편을 꺼내어 흐르는 물에 세척하고 에탄올에서 약 20분 동안 초음파세척을 진행하였다.
양극산화를 통해 형성된 나노튜브의 표면 미세구조는 주사전자현미경(HR FE-SEM)을 이용하여 시료 표면에 생성된 나노튜브의 윗부분을 관찰하고, 나노튜브의 직경은 무작위로 40개의 나노관을 측정하여 나온 평균값으로 표시하였고, 균일도는 데이터의 표준편차 값으로 나타내었다. 나노관의 길이 측정은 시편 표면에서 나노튜브 막을 분리하고 분리된 나노튜브 막을 전도성 테이프로 유리기판 위에 붙여 측면에서 나노관의 길이를 측정하였다. 또한 열처리 전과 후의 TIO2 나노튜브 산화막의 결정구조 변화를 알아보기 위해 양극산화로 나노튜브 층이 형성된 타이타판을 X-선 회절분석기(XRD, X-ray scattering diffraction)를 이용하여 측정하였다.
3. 결과 및 고찰
양극산화를 이용한 TIO2 나노튜브의 형성은 전해질, 온도, 전압, 시간 그리고 타이타늄 합금의 순도의 영향을 받는다고 알려져 있다. 그중 가장 큰 영향을 미치는 것은 전해질로서 그 종류와 농도에 따라 TIO2 나노튜브의 직경과 길이에 다양한 영향을 미친다. 타이타늄 금속의 양극산화 시 Ti4+이온과 물에 함유된 O2−이온이 반응하여 양극산화 피막이 형성되고 전해질 내 F−이온이 타이타늄 표면에 형성된 산화층과 반응하여 국부적인 용해를 일으켜 작은 피트들이 생성된다. 이때 반응에 의해 생성된 강한 용해성을 갖는 [TiF6]2− 착화물과 H+이온이 동시에 증가하고 이로 말미암아 기공 바닥에서 화학적 용해속도를 증가시켜 다공성의 구조를 가지게 된다 [15].
이로 인한 피막층의 국부적 두께 감소는 피트의 바닥에서 전기장의 강도를 다시 증가시켜 새로운 산화층의 형성을 유도하는 과정이 반복되어진다.
기공의 성장은 공정 (1)~(2)의 과정을 통해 타이타늄 산화물의 장벽층에서 타이타늄 방향으로 성장한다. 타이타늄에서 산화물-전해질 계면 방향으로 이동한 Ti4+는 HF 전해질로 용해된다. 이때 타이타늄-산화물 계면에서의 산화물의 성장속도와 기공 하부-전해질 계면에서의 산화물 용해속도는 같게 되면 그 후 기공이 성장하더라도 장벽층의 두께는 일정하게 유지된다. 한편으로는 기공과 기공 사이 영역에서 기공의 분리와 나노튜브 형성을 이끄는 작은 피트들이 형성된다. 튜브구조의 길이는 튜브입구 근처의 산화물 용해 속도와 튜브 하부의 타이타늄-산화물 경계에서 내부로의 성장속도가 동일해질 때 증가하는 것이 중단된다.
양극산화의 전압을 높이면 산화반응과 field-assisted 용해를 증가시키고, 화학적 용해와의 평형을 유지하기 전까지는 더욱 두꺼운 나노튜브 층의 형성이 가능하다. 위와 같은 이론을 바탕으로 전압, 시간, 온도의 변화가 TIO2 나노튜브 형성에 미치는 영향에 대해서 연구하였다.
그림 2는 타이타늄을 60V 정전압 조건하에서 Ethylene glycol + NH4F + 2 vol% H2O 용액의 NH4F 조성을 (a) 0.2 wt%, (b) 0.4 wt%, (c) 0.6 wt%으로 달리하여 1시간 동안 양극산화 후 나노튜브의 윗부분을 HR FE-SEM 으로 관찰한 사진이다. 0.2 wt% NH4F의 조성으로 양극산화처리한 (a)를 보면 큰 직경의 나노튜브는 130 nm, 작은 직경의 나노튜브는 약 111 nm로 평균 직경은 122.1 nm이다. 0.4 wt% NH4F의 조성으로 양극산화 처리한 (b)를 보면 큰 직경의 나노튜브는 131.4 nm, 작은 직경의 나노튜브는 약 120.9 nm로 평균 직경은 129.1 nm이다. 0.6 wt% NH4F의 조성으로 양극산화 처리한 (c)를 보면 큰 직경의 나노튜브는 128 nm, 작은 직경의 나노튜브는 약 109.7 nm로 평균 직경은 119.4 nm 이다. 여기서 가장 큰 특징은 0.4 wt% 이상의 조성에서는 나노튜브의 붕괴를 관찰할 수 있었는데, 그 이유로는 0.2 wt%의 조성보다 초기반응에서 F−이온의 양이 많아 [TiF6]2− 착화물과 H+이온생성 반응이 증가하였고 나노튜브층의 생성보다 나노튜브층의 분해가 활발하게 일어났기 때문으로 판단된다.

HR-FE-SEM images showing the top view of TiO2 nanotube anodized at the constant potential of 60 V for 1h in ethylene glycol + 2 vol% water + NH4F (a) 0.2 wt%, (b) 0.4 wt%, (c) 0.6 wt%.
그림 3은 타이타늄을 60 V 정전압 조건하에서 Ethylene glycol + 0.2 wt% NH4F + H2O 용액의 H2O 조성을 (a) 0 vol%, (b) 2 vol%, (c) 4 vol%, (d) 6 vol%, (e) 8 vol%으로 달리하여 1시간 동안 양극산화 후 주사전자현미경(HR FE-SEM)으로 나노튜브를 관찰한 사진을 보여주고 있다. 먼저 물의 함량이 0%일 때 양극산화 처리한 시편(그림3 (a))를 살펴보면 직경은 68.26 nm 길이는 약 1.78 μm였다, 물의 함량이 2 vol%일 때 양극산화 처리한 그림 3 (b)는 직경은 70.65 nm 길이는 약 8.769 μm였다. 물의 함량이 4%일 때 양극산화 처리한 그림 3 (c)는 직경은 85.27 nm, 길이는 약 16.73 μm, 물의 함량이 6%일 때 양극산화 처리한 그림 3 (d)는 직경은 89.04 nm, 길이는 약 27.5 μm였다. 물의 함량이 8%일 때 양극산화 처리한 그림 3 (e)는 직경은 92.61 nm, 길이는 약 46.5 μm였다. 이러한 결과를 물의 함량에 따른 나노튜브 직경과 길이의 변화로 도표화하여 분석한 결과를 그림 4에서 나타내었다. 여기서 물의 함량에 따라 나노튜브의 직경이 선형적으로 증가하는 경향을 확인하였고 물의 함량이 증가됨에 따라 동일 조건에서 나노튜브 길이가 약 1.8 μm에서 약 46.5 μm까지 약 2500% 증가되는 것을 확인할 수 있었다. 이는 물 함량의 증가가 전해질에서의 H+의 공급뿐만아니라 전해질의 점도를 감소시켜 F-이온의 이동을 활발하게하여 반응을 촉진시키기 때문으로 판단된다. 하지만 4 vol% 이상에서 과도하게 증가된 길이의 나노튜브층은 건조과정에서 모재와 분리가 일어났다.

HR-FE-SEM images showing the top view of TiO2 nanotube anodized at the constant pontential of 60V for 1h in ethylene glycol + 0.2 wt% NH4F + water (a) 0 vol%, (b) 2 vol%, (c) 4 vol%, (d) 6 vol%, (e) 8 vol%.
그림 5는 Ethylene glycol + 0.2 wt% NH4F + 2 vol% H2O의 전해액에서 전압변화에 따른 나노튜브 형상변화를 관찰한 결과로써, 전압은 20 V부터 60 V까지 변화시켰고, 양극산화시간은 1시간 동안 진행하였다. 그림 5에서 볼 수 있듯이 20 V로 실험을 진행한 결과 표면에 미세한 기공이 형성된 것을 확인할 수 있었다. 기공의 평균직경은 33.127 nm로 관찰되었다. 30 V로 진행된 시편의 직경은 평균값 33.12 nm로 측정되었다. 40 V의 경우 기공의 평균직경은 67.78 nm으로 관찰되었다. 50 V로 진행된 시편의 직경은 평균값 81.55 nm로 측정되었다. 60 V에서는 평균값 86.88 nm로 측정되었다. 전압이 증가할수록 기공 직경은 증가하는 것을 관찰할 수 있었다. 또한 나노튜브 표면에서 기공 주위에 실 형태의 형상을 관찰할 수 있었다. 이는 산화막 표면이 용해되는 과정에서 남은 산화막의 잔유물로 생각되어지며 전압이 증가할수록 용해 반응이 활발해져 점점 사라지는 것을 확인하였다. 그림 6은 전류밀도변화에 따른 나노튜브 형상변화를 관찰한 결과로써, 전류밀도를 일정하게 하여 1시간동안 형성된 나노튜브를 관찰한 사진이다. 전류밀도는 10 mA/cm2부터 30 mA/cm2까지 변화시키며 나노튜브 형상을 관찰하였다. 그림 6(a)는 나노튜브가 형성되지 않았으며 반면 그림 6(b)에서는 나노튜브가 형성되었으며, 그림 6(c)에서는 나노튜브가 형성되었지만 부분적으로 붕괴된 것을 볼 수 있다. 이러한 결과는 산화 피막층의 화학적 용해속도가 물로부터 공급되어지는 H+ 이온으로 인해 강하게 영향 받는데 [16], 이 이온의 공급은 전류밀도에 따라 달라지기 때문에 일정 전류밀도 이하에서는 이온들의 공급이 원활하게 이루어지지 않아 나노튜브가 형성되지 않았으며, 일정 전류밀도이상에서는 과도한 이온의 공급으로 나노튜브가 붕괴된 것으로 생각된다.

HR-FE-SEM images of TiO2 nanotube array in ethylene glycol + 0.2 wt% NH4F + 2 vol% H2O; for various anodic oxidation voltages. (a) 20 V, (b) 30 V, (c) 40 V, (d) 50 V, (e) 60 V (f) enlargement of (a)

HR-FE-SEM images of TiO2 nanotube array in ethylene glycol + 0.2 wt% NH4F + 2 vol% H2O; for various anodic oxidation current density. (a) 10 mA/cm2, (b) 20 mA/cm2, (c) 30 mA/cm2
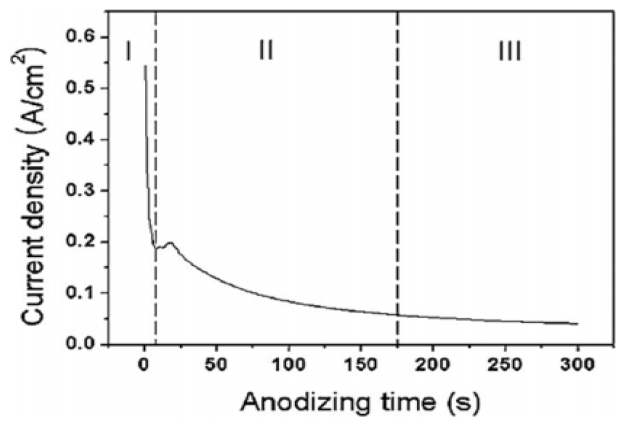
그림 7은 양극산화 시간에 따라 변화하는 전류밀도의 변화를 나타낸 그래프이다. I구간은 인가전압까지 도달하면서 전류가 급격하게 감소하는 거동을 보이며, 공급되는 전압이 일정한 상태에서 전류가 급격히 감소하는 것은 저항이 증가하게 됨을 의미하는데, 이는 산화피막의 유전체 성질을 생각하면 산화물층이 전해질과 금속사이 계면에 형성되어 감을 알 수 있다. II구간에서는 이전 구간에서 형성된 산화막에 Breakdown site가 불균일하게 발생하는 과정으로 전해질의 F-이온의 영향으로 국부적으로 기공이 형성되어 그에 따른 표면적 증가 때문에 전류가 약간 상승하게되며, 전류밀도가 줄어드는 속도가 눈에 띄게 감소되는 구간이다. III구간에서는 전류밀도가 안정화되는 구간으로 이전단계에서 형성된 기공에서의 용해작용과 산화층의 형성의 반복으로 튜브구조가 형성되는 구간이다 [14]. 따라서 양극산화 초기단계에서 일정 전류밀도이하인 경우에는 산화막의 Breakdown site가 발생하지 못하여 나노튜브로 성장하지 못하고 전류밀도가 너무 높은 경우에도 초기반응이 활발해져 나노튜브층의 붕괴를 초래한 것으로 판단된다.
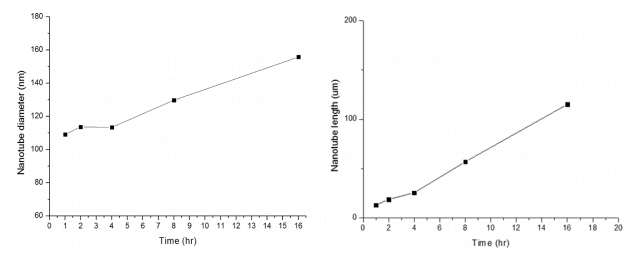
그림 8은 ethylene glycol + 0.2 wt% NH4F + 2 vol% H2O의 전해액에서 60 V의 전압과 최대전류밀도를 30 mA/cm2로 제한한 뒤 시간에 따라 변화하는 나노튜브의 형상을 관찰한 나노튜브의 표면과 단면사진이다. 30분 동안 양극산화 처리한 그림 8(a)를 살펴보면 나노튜브가 형성되지 않은 것으로 보여지며, 1시간 동안 양극산화 처리한 그림 8(b)는 직경은 109.1 nm 길이는 약 13.2 μm였다. 2시간 동안 양극산화 처리한 그림 8(c)는 직경은 113.7 nm, 길이는 약 18.89 μm, 4시간 동안 양극산화 처리한 그림 8(d)는 직경은 113.4 nm, 길이는 약 25.6 μm였다. 유지시간이 보다 길어져 8시간 동안 양극산화 처리한 그림 8(e)는 직경은 129.7 nm, 길이는 약 56.9 μm, 16시간 동안 양극산화 처리한 그림 8(f)는 직경은 155.8 nm, 길이는 약 114.9 μm였다. 이상의 결과를 시간에 따른 나노튜브의 직경, 길이 변화로 도표화하여 그림 9에 나타내었다. 초기 30분동안은 나노튜브가 형성되지 않았으며, 1시간 이후부터 나노튜브의 형상이 나타났다. 하지만 양극산화시간이 8시간이상이 되면 나노튜브의 길이는 증가하였으나, 나노튜브 표면의 붕괴를 관찰할수있었다. 이는 나노튜브와 전해질 계면의 나노튜브층이 전해질에 장시간 노출되면서 화학적 용해가 일어나기 때문으로 판단된다.

HR-FE-SEM images of TiO2 nanotube array in ethylene glycol + 0.2 wt% NH4F + 2 vol% H2O at 60 V voltage; for various anodic oxidation times. (a) 30 min, (b) 1 h, (c) 2 h, (d) 4 h, (e) 8 h, (f) 16 h
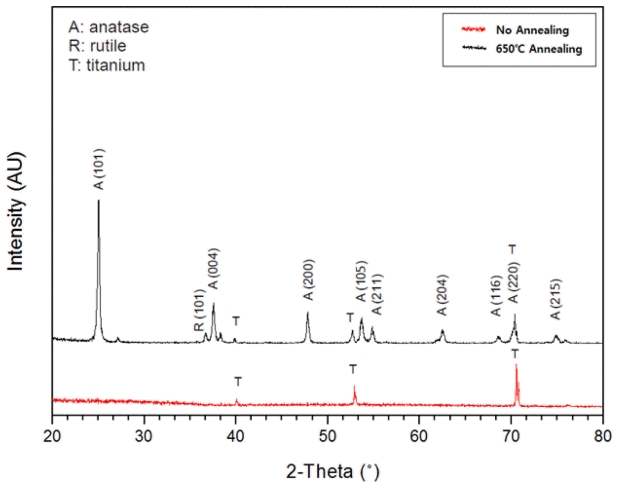
그림 10은 나노튜브의 열처리 전, 후의 결정화를 조사하기 위하여 CuKα X-ray를 이용하여 가속전압 40 kW, 관전류 30 mA 조건으로 소각산란 XRD (small angle Xray scattering diffraction) 시험을 하여 XRD peak를 분석한 데이터이다. 먼저 타이타늄 기판 위에 양극산화로 TIO2 나노튜브가 형성된 상태 그대로인 시편에서는 타이타늄 금속피크만 관찰되었다. 이는 형성된 나노튜브가 비정질 상태라는 것을 의미한다. 비정질의 결정구조에서는 XRD피크가 나오지 않지만 얇은 산화막 두께와 다공성 구조로 인하여 Ti 피크가 검출되기도 하였다. 반면 나노튜브가 형성된 타이타늄 기판을 650 oC Ar분위기에서 2시간 동안 결정화처리를 진행한 시편에서는 Ti 피크 외에 주 피크인 회절각도 2Θ=25° 면지수(101)에서 아나타제 상이 검출되었고, 회절각도 2Θ=37°면지수(004) 및 회절각도 2Θ=47° 면지수(200)에서도 각각 검출되었다. 회절각도 2Θ=36° 면지수(101)에서는 루타일 상 피크가 검출되었다. 따라서 필요에 따라 응용하고자 하는 용도에 맞게 TIO2 나노튜브의 결정구조를 열처리를 통해서 변화시킬 수 있음을 알 수 있다.
4. 결 론
본 연구에서는 Ti6Al4V ELI 합금의 표면층의 형상을 변화시키기 위해 NH4F와 H2O의 조성을 변화시키고, DC 정전압을 20~60 V 범위에서 조정하며, 전류밀도를 10~30 mA/cm2 의 범위에서 시간에 따라 변화시키는 조건으로 양극산화 처리하여 나노튜브의 형성과 공정변수 변화의 관계를 조사하였으며 다음과 같은 결론을 얻었다.
1. 전해액에 첨가되는 NH4F을 0.2, 0.4, 0.6 wt%로 변화시켜 양극산화한 결과, NH4F의 첨가량이 증가할수록 표면반응속도가 빨라져 표면용해가 활발해짐으로써 나노튜브의 형상이 점차 불균일해졌다.
2. Ethylene glycol + 0.2 wt% NH4F의 전해질에서 물의 첨가량을 0, 2, 4, 6, 8 vol%로 변화시켜 양극 산화한 결과, 첨가되는 물의 양이 많아지면 나노튜브의 직경과 성장 길이가 증가하는 경향을 보였다.
3. 인가전압이 작으면 초기 생성된 표면산화층에 Break site가 발생하지 않아 산화막은 성장하지만 나노튜브로 성장하지 않고 일정전압 이상이 되어야만 전압이 증가할수록 나노튜브 직경도 증가하는 것을 확인하였다.
4. 일정 전류밀도 이하에서 양극산화를 하면 나노튜브가 생성되지 않았으며 일정 전류밀도 이상에서 수행하면 나노튜브는 생성되지만 전류밀도에 따라 나노튜브형상의 차이를 보였다.
5. 전해 유지시간에 따른 나노튜브의 변화를 보면 전해유지시간이 길어질수록 나노튜브의 직경은 증가와 감소를 반복하는 경향을 보였으나 전체적으로 보면 증가하는 경향을 보였다.
6. 생성된 나노튜브의 결정구조를 열처리를 통해 원하는 결정구조로 변화시킬 수 있음을 알 수 있었다.
7. 따라서 타이타늄 생체재료 모재에서 TIO2 나노튜브가 붕괴되지 않고 형성될 수 있는 범위의 양극산화 공정변수는 다음과 같다. NH4F을 0.2 wt% 미만으로 첨가하고, H2O의 함량을 2 vol% 이하로 첨가하며, 양극산화 시간을 8시간 이하로 진행하여야 한다.
Acknowledgements
본 연구는 (재)산학협동재단의 2017년도 학술연구비지원사업으로 수행되었습니다.