대기압의 공기 분위기에서 열증발법에 의해 제작된 초박형 MgO 나노시트
Ultrathin MgO Nanosheets Fabricated by Thermal Evaporation Method in Air at Atmospheric Pressure
Article information
Trans Abstract
Ultrathin MgO nanosheets were successfully synthesized by thermal evaporation of a mixture of Mg and graphite powders as the source material. The synthesis was performed at 1000 °C in air. Scanning electron microscopy showed that the two-dimensional MgO nanosheets had widths of several micrometers and the thickness of less than 20 nm. X-ray diffraction analysis revealed that the MgO nanosheets had a cubic crystal structure and high purity. Zero-dimensional MgO nanocubes were formed at temperatures below 1000 °C and one-dimensional MgO nanowires were grown at a temperature higher than 1000 °C. As the synthesis temperature increased, the morphology of the Mg nanocrystals changed from cube to sheet and then wire. The experimental results suggested that the difference in Mg vapor concentration could be responsible for the morphological change in the MgO nanocrystals. When Mg vapor concentration was low, MgO nanocrystals were grown with a cubic shape. A relatively high concentration of Mg vapor led to the growth of sheet-like MgO nanocrystals. A very high Mg vapor concentration favored the growth of MgO nanowires. The growth mechanism is discussed based on the Mg vapor concentration and the crystal structures of Mg and MgO. Visible emissions, which were attributed to lattice defects such as oxygen vacancies, were observed in the cathodoluminescence spectra of the MgO nanocrystals.
1. 서 론
금속 산화물 나노결정은 벌크결정에서는 나타나지 않는 독특한 물리·화학적 특성을 나타내며, 이러한 독특한 특성을 이용하면 새로운 기능을 가진 전자 소자. 광학 소자, 광전자 소자, 센서 소자 등을 구현할 수 있기 때문에 다양한 금속 산화물 나노결정을 합성하기 위한 연구가 활발히 이루어지고 있다 [1,2].
금속 산화물 중에서도 MgO는 에너지 밴드갭(Eg=7.7 eV at 298 K)이 크고 열적 안정성도 우수하며 절연 특성도 뛰어나기 때문에 다층 전자/광학소자에서 절연층과 버퍼층으로 사용되고 있는 매우 중요한 재료이다. MgO 나노결정도 내열재, 흡착제, 촉매, 초전도체, 유전체, 자기저항소자 등을 포함하는 폭넓은 분야에서 응용이 기대되어 큰 주목을 받고 있다. 특히, MgO 나노결정은 마이크로미터 크기의 MgO 결정에 비해 큰 유전상수를 나타내며 고온 초전도 특성도 더욱 우수하다. 또한 높은 비표면적으로 인해 촉매와 수질오염원 중의 하나인 염료를 제거하는 흡착제로서 높은 효율을 나타내고 있다. 흡착제와 촉매로서의 성능을 향상하기 위해서는 나노결정의 비표면적이 높을수록 좋으며, 그런 관점에서 2차원 판상이나 시트 형상을 한 MgO 나노결정의 합성에 대한 중요성이 증가하고 있다. 2차원 MgO 나노결정은 wet chemistry method [3], precursor calcination method [4,5], solvothermal method [6], sol-gel method [7], ultrasonic method [8], hydrothermal method [9] 등의 주로 액상법으로 합성되고 있다. 이들 액상법들은 합성 조건이 까다롭고, 여러 단계의 길고 복잡한 화학 공정을 거쳐야 하며 특별한 실험기구를 사용해야 하는 등의 많은 단점이 있다. 한편, 기상합성법은 나노결정을 합성하는 가장 간단하고 효과적인 합성 방법임에도 2차원 판상 또는 시트 형상의 MgO 나노결정의 합성에 대한 연구 보고는 거의 없는 실정이다.
본 연구에서는 간단한 기상합성법인 열증발법을 이용하여 공기 중 대기압 분위기의 단순한 합성 조건에서 2차원 시트 형상의 MgO 나노결정을 합성하였으며 2차원 나노결정의 발광 특성도 살펴보았다.
2. 실험 방법
Mg 분말 0.5 g과 흑연 분말 0.5 g을 볼밀 장치에 장입하여 10시간 동안 균일하게 혼합한 후 원료로 사용하였다. Mg 분말 0.5 g에 대해 흑연 분말을 각각 0.1 g, 0.25 g을 혼합한 원료들을 사용하여 실험도 하였으나, Mg 분말만을 원료로 사용하여 얻은 실험 결과와 동일하게 입방정 형상을 한 MgO 결정이 생성되었고 흑연 첨가의 영향이 나타나지 않았다. 그러나 흑연 분말을 0.5 g 혼합한 원료의 경우에는 MgO 결정의 형상 변화에 흑연 첨가의 영향이 나타나게 되어 Mg 분말 0.5 g과 흑연 분말 0.5 g을 혼합한 분말을 원료로 사용하여 연구를 진행하였다. 원료 분말을 알루미나 도가니에 넣고 열 증발 공정을 위하여 머플 전기로의 온도를 공정 온도까지 올린 다음 전기로의 중앙에 놓았다. 공정 온도에서 1시간을 유지한 후 전기로의 전원을 끄고 실온까지 냉각하였다. 생성물의 형상과 발광 특성에 미치는 온도의 영향을 연구하기 위하여 800 °C, 900 °C, 1000 °C, 1100 °C의 온도에서 실험을 수행하였다.
생성물의 형상은 융합부품소재 핵심연구지원센터 장비인 주사전자현미경(SEM, JEOL, JSM-IT800)을 사용하여 관찰하였고, 생성물의 구성 성분은 에너지 분산형 X선 분광분석기(EDS, Oxford, Ultim Max 100)를 사용하여 분석하였다. X-선 회절분석기(XRD, PANalytical, X'pert PRO MPD, Cu-Kα radiation, λ=1.5406 Å)로는 생성물의 결정상을 분석하였고, 생성물의 발광 특성은 음극선 발광 분광분석기(CL, Gatan, MonoCL4)를 이용하여 상온에서 평가하였다.
3. 결과 및 고찰
생성물의 결정상을 확인하기 위하여 XRD 특성을 분석하였다. 그림 1에 원료 분말을 800 °C, 900 °C, 1000 °C, 1100 °C의 대기압 공기 분위기에서 각각 1시간 동안 열처리한 시료의 XRD 패턴을 나타내었다. 2θ=36.9o, 42.9o, 62.3o, 74.6o, 78.6o에서 회절 피크가 관찰되었고, 이들 피크는 a=b=c 축의 격자상수가 4.21 Å인 cubic 결정구조를 가진 MgO 결정의 (111), (002), (022), (113), (222) 결정면의 회절 피크와 잘 일치한다. XRD 분석 결과로부터 모든 공정 온도에서 생성된 생성물은 cubic 결정구조를 가진 MgO임을 알 수 있었고, MgO 이외의 다른 물질의 회절 피크는 관찰되지 않았기 때문에 생성된 MgO 결정의 순도도 매우 높다는 사실을 확인할 수 있었다.

XRD patterns of the products synthesized via thermal evaporation of the mixture of Mg and graphite powders at (a) 800 °C, (b) 900 °C, (c) 1000 °C and (d) 1100 °C in atmospheric air.
생성물의 형상은 SEM을 이용하여 관찰하였다. 원료 분말을 800 °C, 900 °C, 1000 °C, 1100 °C에서 각각 1시간 동안 열처리한 시료에서 관찰된 결정들의 SEM 이미지를 그림 2에 나타내었다. 800 °C, 900 °C에서 열처리한 시료에서는 입방정 형상의 MgO 결정들이 관찰되었으나 1000 °C에서 열처리한 시료에서는 입방정 형상의 결정뿐만 아니라 두께가 매우 얇은 2차원 시트 형상의 MgO 결정들도 다량으로 관찰되었다. 800 °C와 900 °C에서 관찰된 입방정 결정은 한변의 길이가 대략 10-300 nm 범위를 나타내었다. 1000 °C에서 관찰된 나노시트 결정의 크기는 두께가 20 nm이며 폭은 대략 1.5-6.0 μm 범위를 나타내었다. SEM 이미지에서 볼 수 있듯이 나노시트는 두께가 너무 얇아 반투명에 가깝다. 열처리 온도를 1100 °C까지 증가시키면 나노시트 형상의 결정은 관찰되지 않고 1차원 나노선 형상의 결정이 관찰되었다. 나노선은 수 μm의 길이를 나타내었고 직경은 약 200 nm를 나타내었다.

SEM images of the products synthesized via thermal evaporation of the mixture of Mg and graphite powders at (a) 800 °C, (b) 900 °C, (c) 1000 °C and (d) 1100 °C in atmospheric air.
생성물의 구성 성분은 EDS를 사용하여 분석하였다. 그림 3에 원료 분말을 800 °C, 900 °C, 1000 °C, 1100 °C의 대기압 공기 분위기에서 각각 1시간 동안 열처리한 시료의 EDS 스펙트럼을 나타내었다. 모든 시료에서 Mg와 O만 검출되었다. XRD와 EDS의 분석 결과는 모든 온도 조건에서 생성된 생성물들이 순도가 높은 MgO 물질임을 나타낸다.

EDS spectra of the products synthesized via thermal evaporation of the mixture of Mg and graphite powders at (a) 800 °C, (b) 900 °C, (c) 1000 °C and (d) 1100 °C in atmospheric air.
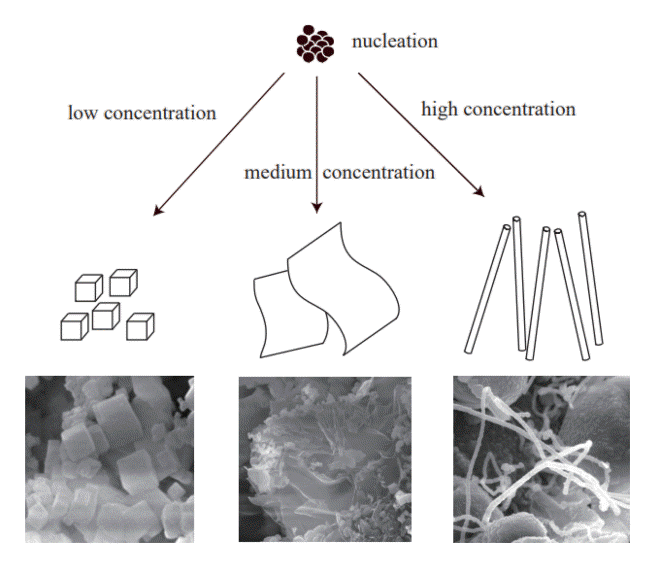
온도에 따라 MgO 결정의 형상이 다른 이유는 Mg 증기의 농도가 결정 성장에 큰 영향을 미쳤기 때문이라고 추론된다. 본 실험에서 공정 변수는 온도밖에 없으며 온도에 의해 크게 바뀌는 성장 조건은 Mg 증기의 농도이기 때문이다. 따라서 Mg 증기의 농도 차로 MgO 나노결정의 형상 변화를 이해하는 것이 바람직하다. 본 실험에서의 MgO 나노결정의 성장 거동은 Mg 증기의 농도, MgO 결정구조, Mg 결정구조의 3가지 요인과 관련이 있다. MgO 결정구조는 면심입방구조이며, Mg 결정구조는 육방조밀충진구조이다. 성장하는 결정은 표면에너지를 최소로 하기 위한 형상으로 발달하기 때문에 입방정 결정구조를 가진 MgO는 입방정 형상으로 성장하는 경향이 있다. 본 실험에서 800 °C와 900 °C의 온도 조건은 Mg의 끓는점인 1091 °C 보다 낮기 때문에 Mg 증기가 천천히 안정되게 발생하며, 따라서 Mg 증기가 공기 중의 산소에 의해 산화되어 MgO 결정핵을 생성하고 MgO 결정으로 성장하게 된다. MgO 결정핵은 열역학적 관점에서 가장 낮은 표면에너지를 가지는 입방정 형상으로 생성되며 MgO 결정도 입방정 형상으로 성장하게 된다. 온도가 상승하면 Mg 증기의 농도 증가로 인해 과포화도가 증가하게 되고 결정성장은 열평형 상태를 유지하지 못하게 되어 나노선, 나노막대, 나노 벨트와 같은 이방성 성장이 일어나게 된다. Mg의 끓는점과 가깝거나 높은 온도인 1000 °C와 1100 °C에서는 Mg 증기의 과포화도가 급격하게 증가하게 되어 이방성 성장을 촉진하기 때문에 MgO 나노시트와 나노선 등이 생성되었다고 생각된다.
기상-고상 성장기구에 의한 결정 성장 과정에서는 평탄한 표면에 흡착된 성장종의 원자 또는 분자들은 표면 위를 확산하여 ledge, kink, ledge-kink 등의 높은 에너지를 가진 성장 위치에서 결정격자와 비가역적 결합을 한다. 이처럼 평탄한 표면에서는 2차원 성장인 step-flow 성장 양식으로 결정 성장이 일어난다. 또한, 평탄한 결정 표면의 가장자리도 ledge, kink, ledge-kink의 밀도가 높기 때문에 흡착된 성장종의 원자 또는 분자들이 결정 표면의 가장자리까지 용이하게 확산하여 결정격자와 결합함으로써 판상 또는 시트 등의 2차원 결정 형상으로의 성장이 촉진될 것이다. 한편, Li 등은 기체 상태인 성장종의 농도가 증가하면 표면에너지가 낮은 결정면들이 형성되기 시작하고 낮은 표면에너지를 가진 결정면은 평탄해지는 경향이 있다고 하였다 [10]. 따라서 성장종의 농도가 증가하면 낮은 표면에너지를 가진 결정면이 생성되고 평탄해지며, 평탄한 결정면에서는 2차원 성장이 강화된다고 이해할 수 있다. 이를 바탕으로 본 실험에서 생성된 MgO 나노시트의 성장 과정에 대해 다음과 같이 설명할 수 있다.
Mg의 끓는점과 가까운 1000 °C에서는 Mg 증기 농도의 급격한 증가와 흑연에 의한 환원성 분위기로 인해 Mg 증기가 공기 중의 산소와 반응하기 쉽지 않아 MgO 증기가 발생하기 어렵다. 이 때문에 Mg 결정핵이 우선 생성되었을 것이다. Mg 결정은 육방조밀충진 결정구조를 가지기 때문에 가장 낮은 표면에너지를 가진 결정면은 기저면인(0002) 면이다. 따라서 표면에너지를 최소로 하기 위해 결정이 성장하면서 (0002) 결정면이 특별히 발달하였으며, 평탄한 결정면인 (0002) 면은 step flow 성장으로 2차원 성장 속도가 빨라져서 시트 형상이 되었을 것이다. 특히, Mg와 같은 저융점 금속은 결정 표면에서 확산 속도가 빠르기 때문에 평탄한 표면인 (0002) 면에 흡착한 Mg 원자들이 표면 위와 표면 가장자리의 성장 위치까지 빠르게 확산하여 2차원 성장을 촉진했을 것이다. 이렇게 형성된 2차원 형상의 Mg 나노시트는 공기 중의 산소와 반응하여 MgO 나노시트 결정이 되었을 것으로 추론된다.
한편, ZnO와 흑연의 혼합 분말을 열증발법의 원료로 사용하여 ZnO 나노결정을 합성한 Al-Azri 등의 연구에 의하면 원료 분말의 증발온도를 높일수록, 즉 Zn 증기의 농도가 높아 과포화도가 매우 높은 조건에서 ZnO 나노선이 성장하였다 [11]. 또한 Khan 등의 연구에서는 ZnO와 흑연의 혼합 분말을 1000-1100 °C에서 열증발시켜 Zn 나노선을 성장시킨 다음, 공기 중에서의 산화 공정을 통해 ZnO 나노선을 합성하였다 [12]. 따라서 본 실험에서도 1100 °C의 높은 온도에서 Mg 증기의 높은 농도와 흑연에 의한 환원성 분위기로 인해 MgO 결정핵보다는 Mg 결정핵이 먼저 생성되어 Mg 나노선으로 성장을 한 다음, Mg 나노선이 공기 중의 산소와 반응하여 MgO 나노선이 되었을 것으로 추론된다. Sheela 등의 연구 결과에서도 Mg 나노선의 일부가 산화에 의해 MgO가 되었다고 보고되었다[13]. 육방조밀충진 결정구조를 가진 금속은 c-축 방향으로의 이방성에 기인하여 [0001] 방향으로 우선 성장한다. Zn과 Mg의 나노선도 주로 [0001] 방향으로 우선 성장한다고 알려져 있다 [13-15].
그림 4에 Mg 증기의 농도에 따른 MgO 나노큐브, 나노시트, 나노선의 성장 양상을 도식적으로 나타내었다. Mg 증기의 농도가 증가할수록 나노큐브, 나노시트, 나노선의 순서로 MgO 나노결정의 형상이 변하였다.
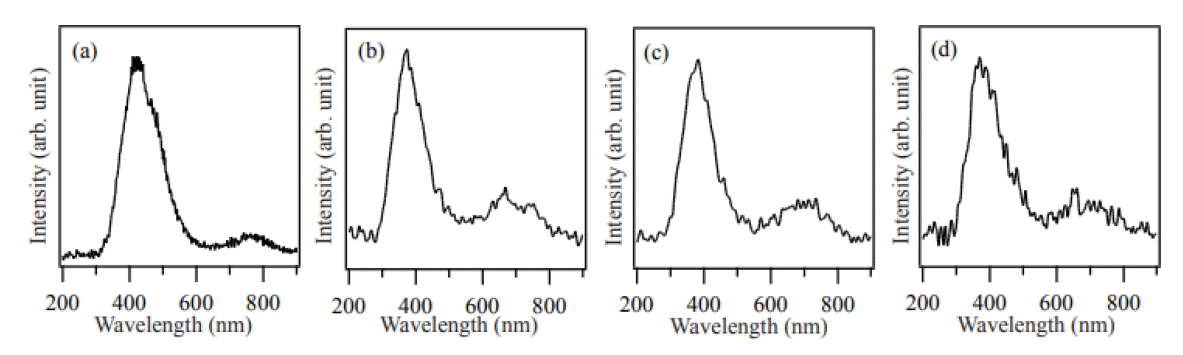
그림 5는 원료 분말을 800 °C, 900 °C, 1000 °C, 1100 °C의 대기압 공기 분위기에서 각각 1시간 동안 열처리한 시료의 CL 스펙트럼을 나타낸다. 800 °C에서 생성된 MgO에서는 430 nm에서 중심 파장을 가진 가시광 영역의 발광 피크가 관찰되었고, 900 °C, 1000 °C, 1100 °C에서 생성된 MgO에서는 약 380 nm의 중심 파장을 가진 자외 발광 피크가 관찰되었다. 380 nm와 430 nm 파장의 발광 피크는 F-center에 기인한다고 알려져 있으며 F-center는 산소 공공과 관련이 있다 [16-18]. 그러므로 본 실험에서도 나노결정의 성장 중에 발생한 산소 공공과 같은 결함들이 MgO 결정의 밴드갭 내에 새로운 에너지 준위들을 형성하여 발생한 발광 피크로 판단된다.
4. 결 론
대기압의 공기 분위기에서 Mg와 흑연 분말을 혼합한 원료 분말을 열증발시켜 2차원 나노구조인 시트 형상의 MgO 나노결정을 합성하였다. MgO 나노시트는 1000 °C의 온도에서 생성되었으며, 이보다 낮은 온도에서는 0차원 나노구조인 입방정 형상의 MgO 나노결정이 생성되었고 높은 온도에서는 1차원 나노구조인 MgO 나노선이 생성되었다. 결정 형상의 변화는 Mg 증기 농도(과포화도)의 변화와 관련이 있으며, 또한 흑연으로 인해 MgO 결정핵보다 Mg 결정핵의 생성이 유리하게 되어 Mg의 결정구조와 표면에너지가 관련된 결정 성장도 영향을 미쳤다. 이처럼 원료 분말에 흑연을 첨가함으로써 MgO의 결정구조 및 표면에너지와 관련된 결정 성장뿐 아니라 Mg의 결정구조 및 표면에너지와 관련된 결정 성장도 일어나게 되어 다양한 형상의 MgO 나노결정을 합성할 수 있었다. MgO 나노시트 결정은 폭이 최대 6 μm의 크기를 가졌으며, 표면은 매우 평탄하였고 두께는 반투명일 정도로 매우 얇았다. Mg 증기의 농도, MgO 결정구조와 Mg 결정구조를 바탕으로 다양한 형상의 MgO 나노결정의 생성 메커니즘을 이해할 수 있었다. MgO 나노결정들에서는 산소 공공 등의 격자 결함에서 기인하는 발광 피크들이 관찰되었다. 비표면적이 매우 큰 나노결정의 표면에는 격자 결함의 농도가 높기 때문에 격자 결함에 기인하는 발광 피크는 나노결정에서 나타나는 특성으로 판단된다.