루테늄 기반 전이금속 나노입자/환원된 산화그래핀 혼성체를 이용한 알칼리 수전해 촉매 합성
Fabrication of Ruthenium-Based Transition Metal Nanoparticles/Reduced Graphene Oxide Hybrid Electrocatalysts for Alkaline Water Splitting
Article information
Trans Abstract
Green hydrogen has attracted significant attention as one of the future energy sources because no greenhouse gases are emitted during production and its energy density is much higher than fossil fuels. Precious metals such as platinum (Pt) and iridium (Ir)-based catalysts are commonly used for water splitting catalysts. However, because of high cost of these precious metals, the mass production of green hydrogen is restricted. In this study, water splitting catalysts based on relatively inexpensive ruthenium (Ru), cobalt (Co), and iron (Fe) were synthesized. The metal nanoparticles were anchored on reduced graphene oxide (rGO) by a microwave-assisted process. The nanoparticles were uniformly distributed on the rGO supports with sizes of about 1.5 and 2 nm in Ru/rGO and RuCoFe/rGO, respectively. This promoted the reaction by further increasing the specific surface area of the catalysts. In addition, it was confirmed by EDS mapping results that the nanoparticles were made of RuCoFe alloy. Among the prepared catalysts, Ru/rGO was excellent toward the hydrogen evolution reaction (HER), which required an overpotential of 50 mV to reach a current density of −10 mA cm−2. In addition, RuCoFe/rGO, which contained the RuCoFe alloy, was the best for the oxygen evolution reaction (OER), and it required 362 mV at the current density of 10 mA cm−2.
1. INTRODUCTION
4차 산업 혁명이 진행됨에 따라 기술의 진보 속도가 빨라지고 있으며, 이와 동시에 전 세계적으로 에너지 소비 또한 증가하고 있다[1,2]. 현재 우리는 화석연료 기반의 에너지원을 사용하고 있는데, 화석연료는 연소 과정에서 이산화탄소, 질소산화물 등을 배출하여 지구온난화와 같은 여러 가지 환경 문제를 야기할 수 있다[3,4]. 이러한 이유로 화석연료를 대체할 신재생 에너지들에 대한 연구가 활발하게 진행되고 있으며[5-8], 그중 수소 에너지는 중량당 에너지 밀도가 최대 142 MJ kg−1 에 이르며 이는 화석연료의 3~4배에 해당한다[9].
수전해 수소라고도 불리는 그린 수소는 생산 과정에서 온실가스가 배출되지 않는 친환경 에너지이며, 이를 통해 고순도의 수소가 생산된다[10]. 수전해는 지구상에 가장 풍부한 자원인 물을 이용하며, 물에 전기에너지를 가해 수소와 산소로 분해하여 수소를 생산하는 방법이다. 수전해 반응은 수소생산반응(hydrogen evolution reaction, HER)과 산소생산반응(oxygen evolution reaction, OER)으로 나뉜다[11]. 특히, 4-전자 반응인 OER의 경우 2-전자 반응인 HER에 비해 반응속도가 크게 느리기 때문에, 전체 수전해 과정에서 반응속도를 결정하는 매우 중요한 반응이다[11]. 이론적으로 물 분해를 위해 필요한 전압은 1.23 V이다[12]. 그러나 실제 환경에서 수소를 생산 시 추가적인 과전압이 필요하고, 이는 수전해 수소 생산의 효율을 낮추는 문제가 된다 [12,13]. 이 때, 과전압을 줄이기 위해서는 촉매가 필요한데, 현재 주로 사용되는 촉매 소재는 백금(Pt), 이리듐(Ir)과 같은 귀금속 기반의 물질로, 높은 수소 및 산소 생산 활성을 나타내나 매장량이 한정적이고 가격이 비싸기 때문에 수소 에너지의 대량 생산 및 상용화 측면에서 제한적이다[14]. 이러한 이유로, Pt이나 Ir에 비해 가격이 저렴하면서도 비슷한 수준의 활성을 보이는 루테늄(Ru)이 수전해 촉매의 구성 원소로 많이 사용된다[15-17]. 더불어 지구상에 풍부하게 존재하고 귀금속에 비해 가격이 훨씬 저렴하다는 이점을 가지는 코발트(Co), 철(Fe)과 같은 전이금속들을 이용하여 촉매를 합성하는 연구 또한 많이 보고되고 있다[18-22]. 특히 전이금속 기반 산화물, 합금 등의 촉매는 OER 활성이 우수하여 수전해 촉매로 연구가 활발히 진행되고 있다[23-25].
본 연구에서는 마이크로파를 이용한 용액상 공정을 통해 환원된 산화그래핀(reduced graphene oxide, rGO)을 지지체로 하여 Ru, Co, Fe 합금 나노 입자를 담지하는 알칼리 수전해용 촉매를 합성하였으며, 전기화학 분석을 통해 HER과 OER 활성을 비교하였다. 제작한 촉매 중 Ru/rGO 및 RuCoFe/rGO 촉매의 구조를 그림 1에 나타내었다.
2. EXPERIMENTAL
2.1. 금속 나노 입자가 담지된 rGO 지지체 촉매 합성
우선, rGO (N002-PDR, Angstron Materials) 55mg을 에틸렌 글리콜 (ethylene glycol, EG) 50 ml에 혼합하여 3시간 동안 초음파로 분산하였다[26]. 그 후, 0.1 M 염화 루테늄(III) 수화물 (ruthenium(III) chloride hydrate, RuCl3·xH2O), 0.1 M 염화 코발트(II) 수화물 (cobalt(II) chloride hydrate, CoCl2·6H2O), 0.1 M 염화 철(III) 수화물 (iron(III) chloride hydrate, FeCl3·6H2O)을 약 1:1:1 부피 비율로 총 1 ml가 되도록 넣었다. 그리고 0.5 M 수산화 나트륨 (NaOH) 1 ml를 넣고, 추가로 1시간 동안 초음파로 분산하였다. 분산이 완료된 후, 700 W에서 2분 동안 마이크로파를 인가하였다. 그 후 촉매를 용액에서 분리하기 위해 8000 rpm으로 50분 동안 원심분리 하였다. 잔류 용액을 촉매로부터 제거하기 위해 아세톤으로 세척하고 8000 rpm으로 20분씩 2번 원심분리 하였다. 마지막으로 60 oC의 진공 오븐에서 충분한 시간 동안 건조시켜 RuCoFe/rGO 촉매를 완성하였다. 또한, 금속 별 유무에 따른 비교를 위해 Ru/rGO와 CoFe/rGO 촉매를 제작하였으며, Ru/rGO와 CoFe/rGO 촉매 제작 시에는 금속 전구체인 0.1 M RuCl3·xH2O, CoCl2·6H2O, FeCl3·6H2O를 각각 1:0:0, 0:1:1 부피 비율로 넣어주었고, 나머지 과정은 RuCoFe/rGO 촉매 제작 과정과 동일하게 진행하였다.
2.2. 표면 형상 및 구조적 특성 평가
합성한 촉매의 나노 입자 크기, 결정성 및 원소 별 분포를 확인하기 위해 전계방사형 투과전자 현미경 (FE-TEM, Talos F200X, Thermo Fisher Scientific)과 에너지 분산 분광 분석기 (EDS, Talos 200X, Thermo Fisher Scientific)를 사용하였다. 또한 촉매 표면에서의 결합 구조 분석을 위해 X선 광전자 분광분석기 (XPS, K-Alpha, Thermo Fisher Scientific)을 이용하였다. 그리고 담지된 루테늄 함량을 확인하기 위해 유도결합플라즈마 방출 분광 분광기(ICP-OES, Optima 8300, PerkinElmer)를 이용하였다.
2.3. 전기화학 특성 평가
모든 전기화학 특성 평가는 electrochemical workstation (VSP, Biologic)에 연결한 표준 3전극 셀 시스템으로 진행하였다. 전해질로는 질소를 이용하여 용존 산소를 제거한 1 M KOH 용액을 사용하였으며, Pt 코일 전극과 Hg/HgO 전극을 각각 상대 전극과 기준전극으로 사용하였다. 제작한 파우더 형태 촉매는 특성 평가를 위해 촉매, 에탄올 및 나피온을 사용하여 잉크 형태로 제작하였다. 이렇게 제작한 촉매 잉크를 카본 전극 (GCE, 5 mm diameter)에 도포하여 작업 전극으로 사용하였다. HER과 OER 활성 모두 5 mV s−1의 스캔 속도로 선형 주사 전위법 (linear sweep voltammetry, LSV)로 분석하였으며, 해당 LSV 그래프를 통해 반응에 필요한 과전압과 타펠 기울기를 계산하였다. 또한 촉매의 전하 전달 저항을 구하기 위해, 100 kHz-0.01 Hz 범위에서 전기화학 임피던스 분광법 (electrochemical impedance spectroscopy, EIS) 분석을 실시하였다. 또한 비교를 위해 상용 20 wt% Pt/C 및 20 wt% Ir/C에 대해서도 동일한 실험 방법으로 HER과 OER 분석을 진행하였다. 그리고 전체 수전해 반응 실험을 위해 2전극 셀 시스템을 구성했다. 우선 니켈 폼을 산처리하여 표면 산화층을 제거한 후, 그 위에 1.0 mg cm−2의 촉매 잉크를 도포하고 60 oC의 진공 오븐에서 12시간 동안 건조시켰다. 촉매의 활성은 5mV s−1 의 스캔 속도로 LSV로부터 분석했다.
3. RESULTS AND DISCUSSION
그림 2는 합성한 촉매의 형상 및 구조 분석 결과이다. 먼저 그림 2(a)와 2(b)는 Ru/rGO 촉매의 TEM 이미지이며, 해당 이미지에서 알 수 있듯이 그래핀 시트 위에 금속 나노 입자들이 고르게 분포되어 있다. 그림 2(c)는 해당 금속 나노 입자들의 크기 분포를 나타낸 막대 그래프이고, 이를 통해 그래핀 시트 위에 분포된 금속 나노 입자들은 평균 약 1.5 nm의 직경을 가지며 크기 편차 또한 작음을 확인하였다. 그림 2(d)와 2(e)의 RuCoFe/rGO 촉매에서도 마찬가지로 금속 나노 입자들이 고르게 분포하였고, 그림 2(f)로부터 입자들의 직경이 평균 약 2 nm이며, 크기 편차가 작음을 확인하였다. 이와 같이 나노 크기로 고르게 분포한 금속 나노 입자들은 촉매의 비표면적을 더욱 넓힘으로써 촉매 반응이 원활히 일어나도록 야기한다. 다음으로 RuCoFe/rGO 촉매의 결정성 분석을 위해 그림 2(g)와 같이 SAED 패턴을 분석하였다. 그 결과 rGO에 해당하는 링 패턴들만 확인되었고 각각 (002), (101), (112) 면에 해당하였다. 금속 나노 입자에 해당하는 패턴은 확인되지 않았는데, 이는 나노 입자의 크기가 극히 작기 때문으로 보인다[22]. 또한 그림 2(h)에 나타낸 HAADF-EDS 매핑 결과로부터 RuCoFe/rGO 촉매에서의 그래핀 시트 위 나노 입자들의 구성 원소를 확인하였다. 그래핀 시트 위에 형성된 금속 나노 입자들은 Ru, Co, Fe 원소들이 함께 이루었으며, 각 금속 원소들이 고르게 분포하였다.

Morphology and structural characterizations. (a,b) TEM images and (c) corresponding particle size distribution of Ru/rGO. (d,e) TEM images and (f) corresponding particle size distribution of RuCoFe/rGO. (g) SAED pattern, and (h) HAADF-EDS mapping of RuCoFe/rGO.
다음으로 Ru/rGO, CoFe/rGO 그리고 RuCoFe/rGO 촉매의 XPS 분석을 진행하였다. 그림 3(a)와 3(b)는 각각 Co 2p와 Fe 2p에서의 결합 상태를 보여주며, Co와 Fe이 둘 다 담지 되지 않은 Ru/rGO 촉매에서는 해당 피크들이 나타나지 않았다. Co 2p 결과를 먼저 확인하면, CoFe/rGO와 RuCoFe/rGO 촉매 모두 공통적으로 781.6 eV와 797.6 eV에서 피크가 나타났으며 이 피크들은 각각 Co 2p3/2 와 Co 2p1/2에 해당한다[27]. 그리고 Fe 2p 결과를 확인하면, CoFe/rGO 촉매는 711.7 eV와 724.8 eV에서 피크가 나타났고, RuCoFe/rGO 촉매는 710.95 eV와 723.75 eV에서 피크가 나타났다. 이 피크들은 각각 Fe 2p3/2 와 Fe 2p1/2에 해당한다 [28]. 즉, CoFe 외에 Ru도 들어가는 경우 Fe의 피크가 음의 방향으로 이동하였다. 이로부터 RuCoFe 합금을 형성하면서 Fe 원자가 Ru 원자로부터 전자를 얻는 것으로 확인된다[29,30]. 그림 3(c)는 세 촉매의 Ru 3p에 대한 결과를 보여준다. Ru이 담지 되지 않은 CoFe/rGO 촉매에서는 Ru 3p 피크가 나타나지 않았다. Ru을 담지한 촉매들을 비교하면, Ru/rGO 촉매에서는 462.4 eV와 484.5 eV에서 피크가 나타났으며 RuCoFe/rGO 촉매에서는 463.4 eV와 485.4 eV에서 피크가 나타났다. 각 촉매에서 나타난 피크들은 각각 Ru 3p3/2 , Ru 3p1/2에 해당한다[31]. 즉, Ru이 단독으로 존재하여 rGO에 담지 될 때와 비교하여, RuCoFe/rGO 촉매에서 담지 될 때 Ru의 피크가 양의 방향으로 이동하는 것을 확인하였다. 이 또한 RuCoFe 합금이 형성될 때 Ru으로부터 Fe으로 전자가 이동하는 것으로 판단된다[29,30]. 이러한 전자의 이동은 Ru의 전자 밀도를 낮추는데, 그로 인해 HER 활성은 감소하지만, OER에서는 OH−를 받아들이기 용이해져 반응에 필요한 과전압이 더욱 낮아진다[32,33].
마지막으로 제작한 촉매들의 전기화학적 특성을 평가하였다. 우선 그림 4는 촉매들의 HER 특성을 비교한 결과다. 그림 4(a)는 LSV 곡선을 나타내며, 그림 4(b)는 촉매 별로 전류밀도 −10, −30 mA cm−2에 도달하는 데 필요한 과전압을 비교한 막대 그래프다. Ru/rGO 촉매는 전류밀도 −10, −30 mA cm−2에 도달하는 데 각각 50, 106 mV를 필요로 하며, RuCoFe/rGO 촉매는 각각 375, 432 mV를 필요로 한다. CoFe/rGO 촉매는 제작한 촉매들 중 가장 큰 과전압을 필요로 하고, 그 값은 각각 385, 434 mV이다. 즉 Ru만 담지된 Ru/rGO 촉매의 HER 활성이 가장 우수함을 알 수 있는데, 수소의 흡탈착에는 Co나 Fe보다 Ru이 유리하기 때문이다[34,35]. ICP-OES 분석 결과, Ru/rGO와 RuCoFe/rGO에는 각각 0.98, 0.46 wt%의 Ru이 담지되었음을 확인하였다. 그리고 위의 XPS 결과에서 확인한 바와 같이 Ru/rGO 촉매와 비교하여 RuCoFe/rGO 촉매에서는 Ru 원자에 대해 청색 편이가 일어나는데, 이로 인해 전자 밀도가 낮아져 HER 활성이 감소하게 된다[32]. 또한 그림 4(c)와 같이 제작한 촉매들의 타펠 기울기를 비교하면 Ru/rGO 촉매가 46 mV dec−1로 가장 작았고, CoFe/rGO 촉매가 91 mV dec−1, RuCoFe/rGO 촉매가 100 mV dec−1로 나타났다. 이는 CoFe/rGO 촉매와 RuCoFe/rGO 촉매는 상대적으로 물 분해 속도가 느리지만, 이에 반해 Ru/rGO 촉매는 물 분해 속도는 상당히 향상되었고, 수소의 흡탈착이 속도 결정 단계임을 시사한다. 이어 EIS 분석을 통해 촉매의 전하 전달 저항을 비교하였고, 그 결과를 그림 4(d)와 (e)에 나타내었다. 그림 4(d)와 (e)에 삽입된 그림은 Randles circuit이며, 용액 저항(Rs)은 100 kHz 의 주파수에서 측정했고, 전하 전달 저항(Rct)은 0.01 Hz의 주파수에서 측정하였다[36]. 제조한 촉매들의 전하 전달 저항을 비교해보면, Ru/rGO 촉매가 13.4 Ω 으로 전하 전달 저항이 가장 작았고, 다음으로 RuCoFe/rGO, CoFe/rGO 촉매 순으로 전하 전달 저항이 커졌다. RuCoFe/rGO 촉매의 경우, Ru이 담지되었으나 낮은 Ru 원자의 전자 밀도로 인해 타펠 기울기와 전하 전달 저항이 높게 나타나는 것으로 시사된다. 더욱이 본 연구에서 제작한 Ru/rGO 촉매는 상용 Pt/C와 비슷한 수준의 활성을 보인다. 경제적 측면을 고려했을 때 Ru은 Pt에 비해 훨씬 저렴한 원소이며[17] Ru/rGO 촉매에 담지된 Ru의 양은 0.98 wt%로 확인되었기에, 20 wt%의 Pt가 담지된 상용 Pt/C와 비교했을 때 가격 경쟁력을 확보한 촉매라고 할 수 있다.

Electrochemical measurement for HER. (a) LSV curves for HER and (b) corresponding overpotentials at −10 and −30 mA cm−2 of Ru/rGO, CoFe/rGO, and RuCoFe/rGO in 1 M KOH at a scan rate of 5 mV s−1, respectively. (c) Tafel slopes of Ru/rGO, CoFe/rGO, and RuCoFe/rGO. (d) EIS curves and (e) enlarged data of Ru/rGO, CoFe/rGO, and RuCoFe/rGO at a potential of −0.10 V vs RHE.
그림 5는 촉매들의 OER 특성을 비교한 결과다. 그림 5(a)와 5(b)의 결과와 같이, 제작한 촉매들 중에서는 RuCoFe/rGO 촉매의 과전압이 가장 작았으며, 전류밀도 10, 30 mA cm−2에 도달하는 데 각각 362, 382 mV의 과전압을 필요로 하였다. 이어 CoFe/rGO 촉매는 390, 429 mV의 과전압을, Ru/rGO 촉매는 400, 460 mV의 과전압을 각각 필요로 하였다. 또한 그림 5(c)에서 제작한 촉매들의 타펠 기울기를 비교한 결과, RuCoFe/rGO 촉매의 타펠 기울기가 35 mV dec−1로 가장 작았고, CoFe/rGO (42 mV dec−1), Ru/rGO 촉매 (106 mV dec−1) 순으로 값이 증가했다. 이로부터 Ru, Co, Fe 세 원소가 모두 포함된 촉매에서 산소 생산 효율이 가장 높음을 시사할 수 있다. 마지막으로 그림 5(d)와 (e)에 나타낸 결과와 같이 촉매들의 전하 전달 저항을 비교해 보았고, 마찬가지로 RuCoFe/rGO (57.6 Ω), CoFe/rGO, Ru/rGO 촉매 순으로 값이 증가함을 확인했다. OER 반응 특성 비교 결과를 분석해 보면, Co, Fe 및 Ru을 모두 사용한 RuCoFe/rGO 촉매의 OER 성능이 가장 우수하게 나타났다. Fe는 Co 기반 촉매에서 OER 활성을 향상시키는 데 효과적으로 기여한다고 보고되며[37], 이러한 CoFe 합금에 Ru 원소가 더해지면 그림 3(c)와 같이 Ru의 XPS 피크가 청색 편이를 하며 전자를 잃게 된다. OER에서는 오히려 이와 같이 전자 밀도가 낮아진 Ru이 OH−를 받아들 이기 용이하기 때문에 반응의 활성이 더욱 향상되는 것으로 여겨진다[33].
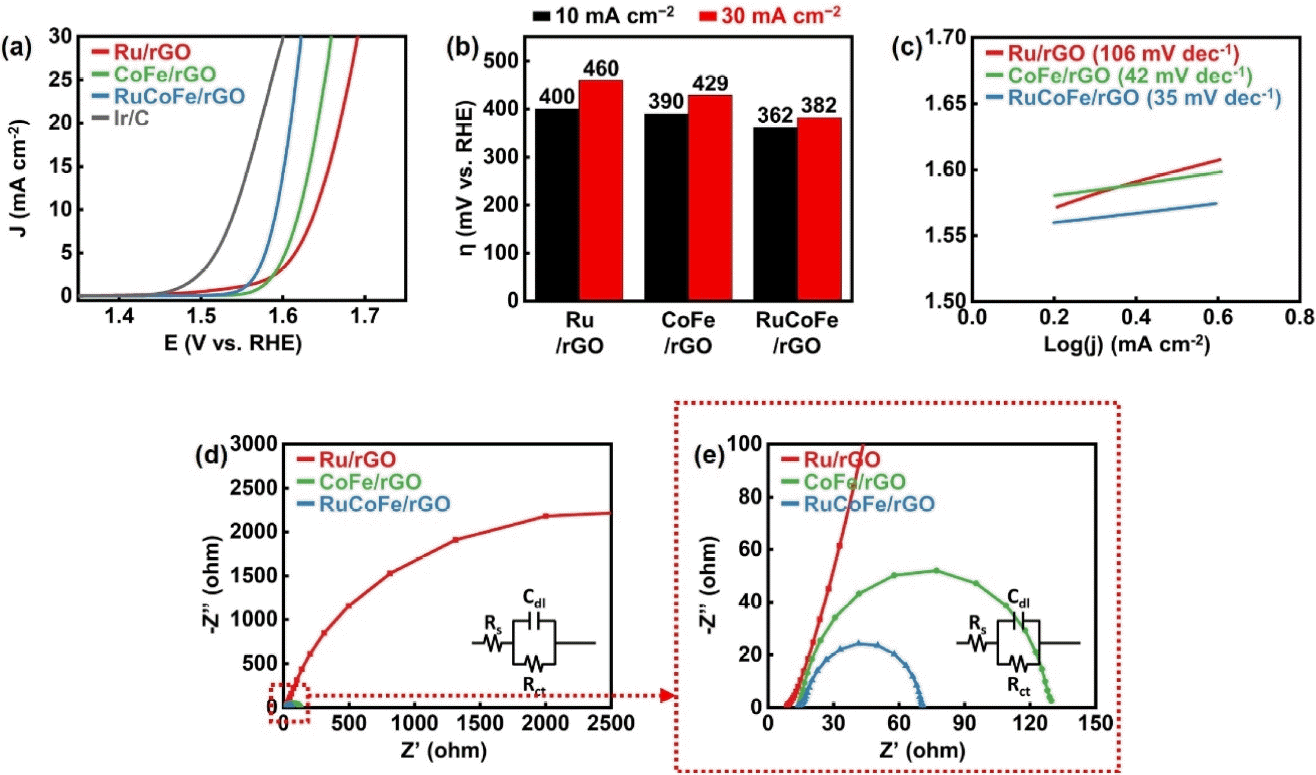
Electrochemical measurement for OER. (a) LSV curves for OER and (b) corresponding overpotentials at 10 and 30 mA cm−2 of Ru/ rGO, CoFe/rGO, and RuCoFe/rGO in 1 M KOH at a scan rate of 5 mV s−1, respectively. (c) Tafel slopes of Ru/rGO, CoFe/rGO, and RuCoFe/rGO. (d) EIS curves and (e) enlarged data of Ru/rGO, CoFe/rGO, and RuCoFe/rGO at a potential of +1.58 V vs RHE.
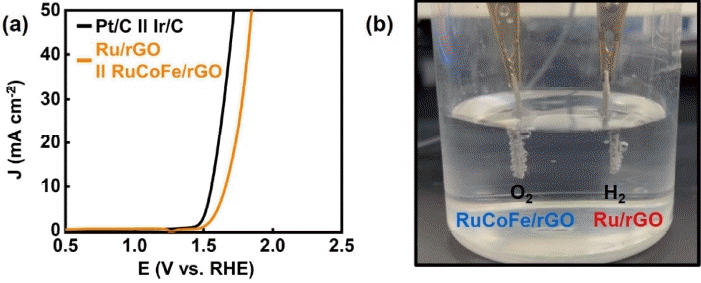
그림 6은 니켈 폼 위에 촉매를 코팅하여 1 M KOH에서 진행한 2 전극 셀 실험 결과이다. Ru/rGO 촉매는 cathode에 연결하고 RuCoFe/rGO 촉매는 anode에 연결하여 실험을 진행했으며, 비교를 위해 Pt/C, Ir/C 촉매 또한 각각 동일한 조건으로 각각 cathode와 anode에 사용하여 실험을 진행했다. 그림 6(a)는 Pt//C || Ir/C의 경우 전류 밀도 10 mA cm−2에 도달하는 데 1.55 V의 전압을 필요로 하는 반면, Ru/rGO || RuCoFe/rGO는 1.65 V의 전압을 필요로 함을 보여준다. 반응에 필요한 전압은 Pt/C || Ir/C가 더 작았으나, Ru/rGO || RuCoFe/rGO도 큰 차이가 나지 않으면서 경제성 또한 확보했다는 장점이 있다. 그림 6(b)는 전체 수전해 반응 시 나타나는 현상을 보여준다. Ru/rGO 촉매를 코팅한 cathode에서는 수소 기체가 발생하고, RuCoFe/rGO 촉매를 코팅한 anode에서는 산소 기체가 발생한다.
4. CONCLUSIONS
본 연구에서는 비교적 빠르고 간단하게 촉매의 제작이 가능한 용액상 공정을 사용하였으며, 마이크로파를 이용하여 rGO 지지체 위에 루테늄-전이금속 합금 나노 입자를 담지시킨 수전해용 촉매를 제작하였다. 제작한 촉매들에 담지된 나노 입자의 직경은 Ru/rGO 촉매와 RuCoFe/rGO 촉매에서 각각 평균 약 1.5와 2 nm로 확인되었다. 특히, RuCoFe/rGO 촉매의 경우, HAADF-EDS 매핑을 통해 세 원소 모두 그래핀 표면에 나노입자 형태로 존재함을 확인하였으며, XPS 분석을 통해 Ru과 Fe 사이에 상호작용이 있음을 확인하였다. 전기화학 분석을 통해 수소 및 산소 생산 시 필요한 과전압을 비교한 결과, HER에서는 Ru/rGO 촉매가, OER에서는 RuCoFe/rGO 촉매가 가장 낮은 과전압을 나타내어 각 반응에 가장 유리함을 확인하였다. 이러한 이유는 Ru/rGO에는 Co나 Fe에 비해 수소의 흡탈착이 쉬운 Ru의 함량이 가장 많고, Ru의 전자 밀도가 커 HER에 유리하기 때문이다. 반면, OER에서는 Ru의 전자 밀도가 작을수록 OH−를 받아들이기 용이하며 CoFe 합금 또한 OER 활성 향상에 기여하기 때문에, RuCoFe 합금을 형성할 때 반응에 필요한 과전압이 더욱 낮아지는 것으로 판단된다.
Acknowledgements
본 연구는 과학기술정보통신부 (2022R1A4A1034312) 및 산업통상자원부(MOTIE)와 한국에너지기술평가원(KETEP) (20224000000090)의 지원을 받아 수행한 연구임.