황 함량 변화가 NiZnS 복합광촉매의 태양광 물분해 효율에 미치는 영향
Effect of Sulfur Contents in NiZnS Composite Photocatalysts on Solar Water Splitting
Article information
Trans Abstract
Solar energy is attracting much attention as an eco-friendly source for future energy needs. Herein, NiZnS photocatalysts were synthesized with a hydrothermal method at various sulfur contents. The ZnS material is widely used as a photocatalyst because of its high stability, low toxicity, and excellent charge separation characteristics. Nickel is considered a co-component in the ZnS base to improve hydrogen evolution efficiency, because nickel sulfide has a narrow band gap. Field emission scanning electron microscopy analysis was used to observe particle size and shape. As the sulfur ratio increased, the particle size increased, and relatively uniform particle sizes were obtained at the 2:2 molar ratio of NiZn:S. X-ray diffractometer analysis showed the formation of ZnO crystals at low sulfur contents in the NiZnS photocatalysts. Among the various NiZnS compositions, the NiZn:S ratio of 2:2 resulted in the highest hydrogen production rate (1541.5 μmol/g/h) with stable reproducibility. UV-vis spectroscopy was used to analyze light absorbance, and the band gap changed with different sulfur contents due to the oxygen vacancies in ZnO, as identified by X-ray photoelectron spectroscope. High amounts of thiourea used to introduce the sulfur increased the particle sizes and blocked sunlight coming to NiZnS surfaces, thereby degrading photocatalytic performance. Therefore, changing the sulfur content when fabricating the NiZnS composite photocatalysts affected the crystalline structures and band characteristics of the materials, and it finally resulted in improved light absorption, charge separation, and the hydrogen production rate of the photocatalysts.
1. INTRODUCTION
최근 환경오염의 증가에 따라 인류 생존의 위기가 커지면서, 친환경적으로 에너지를 생산할 수 있는 무한에너지에 대한 관심이 매우 높아지고 있다. 그 중에서도 수소에너지는 석탄과 석유를 대체하여 연료로 사용될 수 있다는 점에서 크게 각광받고 있으며 수소를 생산하기 위한 다양한 연구가 전 세계적으로 광범위하게 이루어지고 있다. 수소 에너지를 생산할 수 있는 방법으로는 메탄 수증기 개질, 석탄 가스화, 수전해법 등으로 알려져 있으며, 여러 방법들 중에서도 특히 지속가능한 에너지인 태양광을 사용하는 광촉매 수전해법이 친환경적이라 할 수 있다. 태양광 수전해 수소생산에 사용되는 대표적인 광촉매로는 TiO2[1-3], ZnS[4] 등이 세계적으로 활발히 연구 되고 있으나, 띠 간격(band gap)이 넓어 가시광선 영역에서의 광흡수에 한계점을 가지고 있다. 이러한 단점들을 개선하기 위해 많은 연구자들이 띠 간격을 줄이기 위한 연구 결과들을 보고하였으며, 다양한 연구결과들을 요약하여 이종접합(heterojunction)[5], 복합재료(heterostructure)[6], 도핑(doping)[7] 등에 대한 리뷰 결과를 제시하였다. 이종접합 연구에서는 CdS와 TiO2를 혼합하고[8], WO3와 g-C3N4를 혼합하는[9] 등 다양한 띠 간격을 가지는 물질을 혼합하여 전도 띠(conduction band)와 원자가 띠(valence band)의 위치를 이용한 상호작용으로 띠 간격을 줄이며 우수한 결과를 보여주었다. 또한, 복합재료 광촉매에서는 ZnCdS[10,11], ZnIn2S4[12], CuZnS[13] 등을 합성하는 연구들이 진행중이며 좁은 띠 간격을 가지는 재료의 혼합으로 띠 간격이 감소되어 가시광선 영역의 흡수율을 증가시키는 결과들이 보고되었다. 도핑 영역에서는 금속 물질 혹은 비금속 물질을 사용하여 진행하였으며, 백금(platinum, Pt)[14], 철(iron, Fe)[15], 코발트(cobalt, Co)[16]와 같은 금속 물질을 사용하면 전도띠의 에너지를 낮추고 황(sulfur, S)[17], 질소(nitrogen, N)[18]와 같은 비금속 물질을 사용하면 원자가띠의 에너지를 높여 띠간격을 줄이는 효과가 있음이 보고되었다.
본 연구에서는 위에서 기술한 여러 방법 중 복합재료 광촉매의 특성을 사용하여 ZnS의 띠 간격을 줄여 성능을 향상시키고자 한다. ZnS는 n형 반도체로 독성이 적고 저렴한 가격, 우수한 전하 분리와 광여기 특성 등을 가지고 있어서 수소 생산 광촉매로 많은 연구가 진행되고 있다[19]. 또한 니켈 황화물들은 띠 간격이 좁고, 그 중 NiS2(nickel disulfide)의 경우 독성이 적고 자원이 풍부하며 안정적인 특성을 가지고 있는 것으로 알려져 있다[20]. 이러한 ZnS와 니켈 황화물의 장점을 활용하기 위해 니켈, 아연, 황 세 가지 물질을 혼합하여 새로운 복합재료 광촉매를 합성하고자 한다. NiZnS 광촉매 합성을 위해 nitrate 계열의 니켈과 아연의 전구체(precursor)를 이용하였으며 황 전구체로는 thiourea를 사용하여 세 가지 재료로 수열합성법(hydrothermal method)을 통해 제조하였다. 황의 함량을 변화시켜 합성하면서 수소 생산의 추이를 확인하였으며 FE-SEM, XRD, XPS, UV-vis 등을 이용하여 광촉매의 특성 분석을 진행하였다. 또한 광촉매의 수소 재생산성을 확인하여 내구성을 평가하였다. 분석 결과를 토대로 황의 함량이 광촉매의 합성과 태양광 물분해 특성에 미치는 영향에 대해 조사하고 결론을 도출하였다.
2. EXPERIMENTAL
황의 함량에 따른 NiZnS 광촉매를 합성하기 위해 nickel nitrate hexahydrate(Ni(NO3)2·6H2O, ≥97.0%, Sigma Aldrich), zinc nitrate hexahydrate(Zn(NO3)2·6H2O, 98%, Sigma Aldrich), thiourea(CH4N2S, ≥99.0%, Sigma Aldrich)를 각각 니켈, 아연, 황의 전구체로 사용하였다. 수열합성법(hydrothermal method)으로 합성하기 위해 용매로 증류수(resistivity>18MΩ) 160 mL를 사용하였으며, 용매에 각 전구체를 표 1에 제시된 비율로 첨가한 후 1시간 동안 교반(stirring)을 진행하였다. 니켈과 아연은 1:99 몰 비(molar ratio)로 고정하였으며, 황의 함량에 따른 변화를 알아보기 위해 니켈과 아연 전구체의 양을 동일하게 하고 thiourea의 양을 변화시켰다. 교반이 끝난 용액을 200 mL 용량의 테프론 라이너에 옮겨 담은 후, 오토클레이브를 이용하여 가열로(furnace) 온도 200 °C에서 24시간 동안 열처리하였다. 이후 상온에서 5시간 동안 냉각한 후 원심분리기를 사용하여 물과 에탄올으로 세 차례씩 번갈아가며 세척하고 60 °C 오븐에서 최종 건조하였다.
NiZnS 광촉매의 수소생산 특성을 확인하기 위해 뚜껑이 수정판으로 이루어진 250 mL의 pyrex 용기에 광촉매를 일정량 사용하여 실험을 진행하였다. NiZnS 광촉매 0.01 g을 40 mL 증류수에 30분간 초음파 처리하여 입자를 분산시킨 후, sodium sulfide nonahydrate(Na2S·9H2O, ≥98.0%, Sigma Aldrich) 0.35 M과 sodium sulfite(Na2SO3, 97.0%, Samchun) 0.25M를 추가하여 총 60mL 용량으로 혼합하였다. 이 후 10분간 질소 퍼징(purging) 후 4시간 동안 수소 생산 실험을 진행하였다. 이때 광원은 태양광 시뮬레이터 (solar simulator, PEC-L11, Peccell technologies, 150 W Xe lamp with an AM 1.5G filter)를 사용하였으며 표준 태양광 전력 (1 kWm-2)을 기준으로 사용하였다. 한 시간 간격으로 시린지(syringe)로 기체를 포집하여 가스 크로마토그래피(gas chromatography, Agilent 7890B)를 이용하여 수소 생산량을 측정하였다. 수소 생산량은 두 종류의 표준 가스(1 vol% H2, 4 vol% H2)를 이용하여 측정한 것을 기준으로 환산하였다. NiZnS 광촉매는 에너지 분산형 X-ray 분석(energy dispersive X-ray spectrometer; EDX) 기기가 장착된 전자 주사 현미경(field emission scanning electron microscopy; FE-SEM, SU8010, Hitachi, 10 kV)을 사용하여 표면 분석을 진행하였다. 결정성 분석을 위해 X-ray 회절 분석기(X-ray diffractometer; XRD, D/Max-2500, Rigaku, Cu Kα radiation)를 사용하여 45 kV, 200 mA로 15°~70° 범위에서 2θ range로 5°/min의 속도로 측정하였다. 광촉매의 원자 결합 에너지를 알기 위해 X-ray 광전자 분광 분석기(X-ray photoelectron spectroscope; XPS, Nexsa, Thermo Fisher)를 사용하였으며 각각의 피크(peak)는 C 1s 오비탈(orbital)의 284.6 eV를 기준으로 칼리브레이션(calibration) 되었다. NiZnS 광촉매의 광학적 특성을 조사하기 위해 자외선 가시광선 분광기(UV-visible spectrometer; UV-vis, S-4100, Scinco)를 사용하였다.
3. RESULTS AND DISCUSSION
수소 생산에서 광촉매 입자의 크기와 형태는 효율에 많은 영향을 준다. SEM 이미지를 활용하여 대략적으로 500개 내외의 입자를 통해 평균 입자크기를 분석하였다. 그림 1은 대표적으로 NZS2 광촉매의 SEM 및 EDX 이미지를 보여주고 있다. 확대된 이미지는 광촉매 표면 형상이 평평하기 보다는 울퉁불퉁한 형태를 보여주고 있으며 이로 인해 비표면적이 높아지고 광활성을 높이는 역할을 할 수 있을 가능성을 보여준다. 특히 이러한 표면 형태학은 수소 생산 효율 향상에 크게 영향을 줄 수 있을 것으로 판단된다. 또한, EDX 맵핑 분석을 통해 니켈, 아연, 황 세 물질 모두 광촉매 입자에 존재함을 확인하였다. SEM 이미지 분석을 통해 얻은 NZS2 광촉매의 평균 크기는 6.74 μm이며, 표준편차는 1.33 μm으로 다양한 조성의 샘플들 중에서 가장 균일한 입자크기 분포를 보여주고 있다. 입자크기는 NZS1이 가장 작게 나타났으며 대체적으로 황의 함량이 증가할수록 입자 크기가 증가하였다. NZS4와 NZS5는 유사한 크기를 가졌으나 NZS5의 편차가 1.90 μm로 가장 큰 것으로 나타났다. 입자크기의 편차가 크다는 것은 동일량의 샘플을 실험에 사용할 경우 큰 입자가 포함될 가능성이 크고 이로 인해 편차가 적은 샘플에 비하여 광촉매의 평균 활성 효율에서도 부정적인 영향을 줄 가능성이 크다. 따라서 최대한 표준편차가 적은 샘플을 생산하는 것이 광활용 효율을 높이기 위해서는 바람직한 방향이라고 판단된다. ZnS의 합성에서 황 함량을 증가시키기 위해 사용한 thiourea를 과량으로 첨가하면 thiourea의 capping 현상으로 인해 평균 입자 크기가 커진다는 연구결과가 보고 되었으며[21] 본 연구의 결과에서도 그림 1에 삽입된 표에서 보이는 것과 같이 유사한 경향을 보이는 것으로 나타났다.

Typical SEM images from the NZS2 photocatalyst, corresponding EDX elemental mapping image including Zn, S, Ni and O elements and particle sizes of NiZnS photocatalyst samples.
그림 2는 NiZnS 광촉매들의 결정구조를 분석한 XRD 결과를 보여주고 있다. 가장 강한 강도를 보이는 것은 ZnS의 wurtzite 구조와 sphalerite 구조가 중복되는 피크로 나타났으며, 2q 위치로 28.57°, 47.61°, 56.42°는 각각 wurtzite의 (002)면, (110)면, (112)면 그리고 sphalerite의 (111)면, (220)면, (311)면을 나타내는 것으로 보고되었다[22]. 이는 NiZnS 광촉매가 제조되는 과정에서 전반적으로 ZnS 결정 구조가 생성되는 비율이 높음을 의미한다. 추가적으로 27.19°, 30.60°, 51.98°에서 나타나는 피크는 ZnS wurtzite 구조의 (100)면, (101)면, (103)면을 나타내는 것을 의미한다[23]. 또한, 33.12o에서 약하게 나타나는 피크는 ZnS sphalerite (200)면으로 판단되며 S의 비율이 증가하면서 피크의 intensity가 증가하는 것을 보여주고 있으며 그림 2에 확대 삽입된 그래프에서 확인할 수 있다. 이는 S의 함량 증가가 sphalerite 결정구조 생성에 영향을 주고 있음을 의미하며, ZnS 합성 시 S의 비율에 따라 wurtzite 구조에서 sphalerite 구조로 변화를 나타낸다는 것을 알 수 있다. 또한, S가 과량 사용될 경우 sphalerite crystal 크기가 증가하면서 wurtzite로 변화되지 않는다는 연구결과도 보고된 바 있다[22]. 추가적으로 NZS1과 NZS2는 34.40°에서 1개의 특별한 피크가 발견되는데, 이는 안정한 구조의 ZnS 결정으로 생성되기 위해 필요한 S 함량이 부족하여 수열합성 반응기에 존재하는 산소와 결합한 ZnO 결정이 생성된 것으로 ZnO (002)면의 피크를 나타내고 있다[24,25]. ZnO 결정이 만들어지는 반응식을 아래와 같이 나타낼 수 있다.
식 (1)은 thiourea가 수열합성 조건에서 해리되는 것을 나타냈으며, 이로 인해 식 (2)에서 제시된 대로 생성된 암모니아(NH3)가 물과 반응하여 수산화 이온(OH-)를 생성하였을 것이라 판단된다. 식 (3)에 서술한 대로 thiourea의 부족으로 인해 Zn2+는 Zn(OH)2를 거쳐 ZnO로 합성된 것으로 판단되며, 이러한 현상이 이미 보고되기도 하였다[26]. 또한, ZnO가 합성되었다는 것은 Zn2+ 과 반응할 황이 부족함을 의미하는 것을 알 수 있다. 그림 2에서 Ni와 관련된 결정 피크는 나타나지 않았는데 이는 Zn 함량에 비하여 상대적으로 매우 적은 양이 존재하여 결정상 분석에서는 무시할 만한 영향을 나타내는 것으로 판단할 수 있다.
그림 3은 XPS 분석으로 NZS2 광촉매 표면의 원자 결합 에너지를 분석한 결과이다. 그림 3(a)는 전체적인 XPS 스펙트럼을 나타낸 것으로 아연, 산소, 탄소, 황의 피크를 확인할 수 있다. 상대적으로 매우 소량 첨가된 니켈은 Ni 2p 오비탈 피크 중 가장 강하게 나타나는 Ni 2p3/2 피크만 856.38 eV에서 약하게 확인되었으며[27], 그림 3(a)에 삽입된 그림에서 보여주고 있다. 그림 3(b)는 Zn 스펙트럼으로 Zn 2p3/2와 Zn 2p1/2 피크는 1022.01 eV와 1045.05 eV에서 나타났으며 이는 Zn2+ 오비탈 피크로 판단된다. 두 결합 에너지 차이는 23.04 eV으로 Zn 2p의 피크에서 나타나는 특징 중 하나이다[28]. 그림 3(c)의 S 2p 오비탈은 161.51 eV, 162.70 eV에서 피크가 나타났으며 이는 각각 S 2p3/2, S 2p1/2 피크로 사료된다[29]. 그림 3(d)의 O 1s 피크에서는 공기 중 산소가 아닌 lattice oxygen이 531.66 eV에서 발견되고 추가적으로 533.39 eV에서 oxygen vacancy가 나타나므로 NZS2 광촉매에 ZnO가 존재함을 알 수 있다[30]. Oxygen vacancy는 결정 격자에서 산소가 빠지는 형태의 결함으로, 이로 인해 띠 간격이 감소하는 현상이 발생한다는 연구결과가 보고되었다[31].
그림 4는 NiZnS 광촉매들의 광학적 특성을 파악하기 위해 자외선 가시광선 분광분석을 한 결과와 이를 이용해 Tauc plot으로 띠 간격을 계산한 결과이다. 그림 4(a)에서 NiZnS 광촉매의 황의 함량이 증가하면서 전체적인 흡광도가 상승하다 NZS3 부터 감소하는 현상이 발견되었다. 이는 ZnO에 의한 oxygen vacancy에 따라 띠 간격이 줄어들면서 흡광도가 높아지는 영향으로 판단되며[32], S의 함량이 지속적으로 증가하면서 ZnO의 양이 줄어들면서 이에 의한 영향이 감소하면서 흡광도 또한 감소하는 것으로 보인다. 따라서 NZS2 샘플에서 최적의 흡광 특성이 나타났다고 추측된다. 부수적으로 앞에서 기술한 바와 같이 thiourea의 capping현상이 과량으로 사용할 경우 NiZnS 광촉매 표면에 입사하는 빛을 차단했을 가능성도 무시할 수 없을 것으로 판단된다. 그림 4(b)에서는 황의 함량이 2:1에서 2:2로 증가하면서 띠 간격이 2.82 eV에서 2.43 eV로 감소하였으나 이후에는 함량이 증가할수록 띠 간격이 순차적으로 증가하였다. 띠 간격이 좁을수록 적은 에너지로도 전자가 여기될 수 있기 때문에 활용할 수 있는 파장대가 늘어나 수소 생산에 유리할 것으로 판단된다. 따라서 광을 흡수하여 활용하는 측면에서 NZS2 광촉매가 가장 우수한 효율을 보일 수 있다는 것을 암시하고 있다.
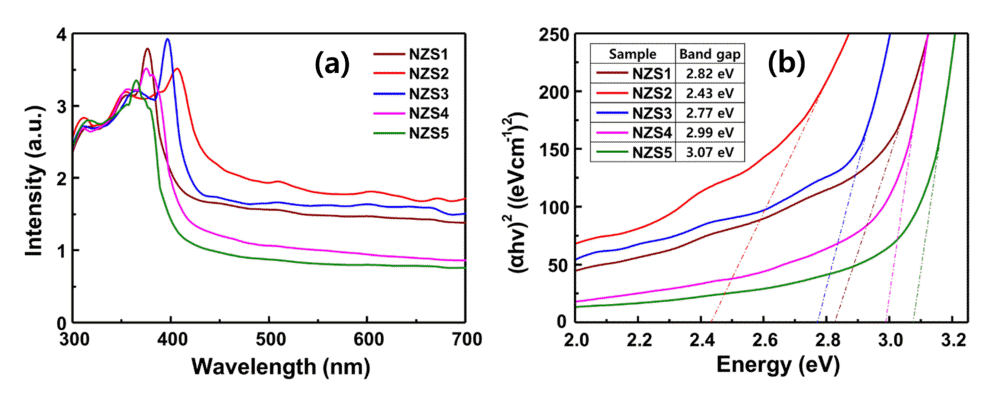
(a) UV-vis absorbance spectra from the NiZnS composite photocatalysts, (b) Tauc plots to calculate band gaps of NiZnS photocatalysts.
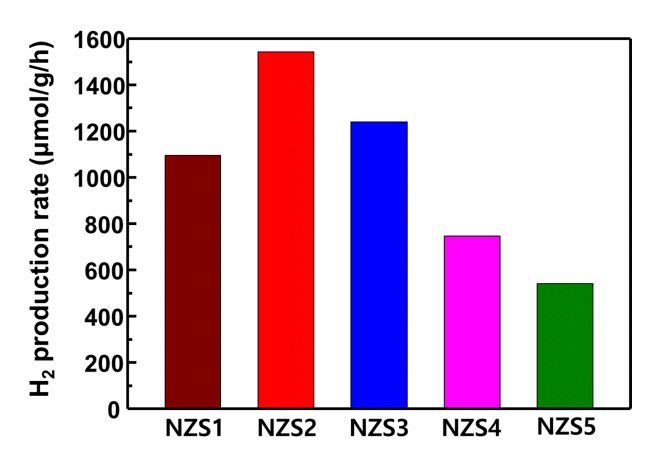
그림 5는 NiZnS 광촉매의 황 함량 별 시간당 평균 수소생산 결과이다. 황 함량이 증가함에 따라 수소 생산량이 증가하다가 2:3 몰 비인 NZS3에서부터 수소 생산량이 감소하는 양상을 보였다. NZS2 광촉매가 1541.5 μmol/g/h의 가장 우수한 수소 생산량을 보였으며 NZS4, NZS5는 1000 μmol/g/h 이하의 낮은 생산량을 보였다. 이러한 결과는 그림 4에서 보여준 띠 간격의 경향과 유사한 것으로 NZS1, NZS2는 ZnO와 이종접합 및 ZnO의 oxygen vacancy로 인해 띠 간격이 좁아져서 빛 흡수율 증가를 통한 높은 수소생산 결과를 나타낸 것으로 판단된다. 하지만 황의 비율이 증가하면서 NZS3, 4, 5는 thiourea의 capping 효과로 인한 빛 차단이 증가하여 광여기가 어려워지며 수소 생산량이 감소한 것으로 추측된다. 황의 함량이 많은 샘플에서는 띠 간격 또한 상대적으로 크게 나타나 광흡수 효율에서도 부정적인 영향을 보인 것으로 생각된다. 또한 황 함량 증가에 따른 입자크기 증가로 표면적이 감소한 것도 수소 생산 효율에 부정적으로 영향을 주었을 것으로 판단된다.
그림 6은 NiZnS 광촉매의 내구성 평가를 위해 4시간 동안의 수소 생산을 4번 동안 반복한 결과이다. 각각의 실험은 질소 퍼징 후 실시해 오차를 최소화하여 진행하였으며, 수소생산 결과가 가장 우수한 NZS2 광촉매를 샘플로 사용하였다. 첫번째 실험에서는 도합 6867.0 μmol/g의 수소 생산량을 보였으며 두번째 실험에서는 7703.7 μmol/g로 약간 증가하는 수소 생산량이 나타났다. 이는 반응이 진행되면서 조사된 태양광으로 인해 수소 생산 반응기의 온도가 다소(5 °C) 상승한 것이 반응속도에 영향을 준 것으로 사료되며, 이후의 반복 실험은 ±1 °C 내외의 온도 변화로 반응속도에 미치는 영향이 적다고 판단되었다. 두번 째 실험 이후 수소 생산량은 소폭 변화하는 것을 보였다. 황화물 광촉매에서는 빛에 의해 광촉매가 분해되면서 성능이 떨어지는 광부식 현상이 주로 발견되나[13], NZS2는 수소 생산량 감소율이 매우 낮으므로 광부식 현상이 거의 없는 것으로 판단되며 비교적 안정한 광촉매라고 평가된다.

Reproducibility of H2 evolutions from NZS2 photocatalyst with the four cycles after purging the reactor with nitrogen gas between cycles.
그림 7은 NiZnS 광촉매의 띠 간격과 에너지 띠 전위 수준(energy band potential level)에 따른 전하 이동 매커니즘을 나타낸 개략도이다. XRD와 XPS 분석으로 NZS2 광촉매에서 ZnO가 형성됨을 확인하였으므로 NZS2 광촉매는 ZnO와 ZnS가 상호작용하고 있는 상태로 판단된다. 광여기가 일어난 상태에서 ZnO의 낮은 원자가 띠에 있는 정공이 보다 높은 ZnS의 원자가 띠로 올라가며, ZnS의 높은 전도 띠에 있는 전자가 보다 낮은 ZnO의 전도 띠로 내려간다. 이는 2형 이종접합(type-2 heterojunction)에 기인한 것이며 띠 간격 감소를 야기하며 효율적인 전하분리를 통해 수소생산에 필요한 전자의 손실을 최소화하여 사용되기에 적합한 구조로 판단된다. 또한, 소량 첨가된 니켈이 금속 도핑과 유사한 작용을 하여 전도 띠를 낮춰주며 더 좁은 띠 간격을 형성하게 되며[33], 전자를 모으는 역할을 하여 수소 생산에 사용될 수 있도록 보조적인 역할을 수행한 것으로 생각된다. 추가적으로 ZnO의 oxygen vacancy도 띠 간격 감소에 관여한 것으로 판단된다. 결론적으로 니켈이 활성 부위(reaction site)로 작용하며 수소 이온과 반응하여 수소 생산이 일어나며, ZnS의 원자가 띠에 있는 정공이 물과 반응하며 산소를 생산할 수 있는 효율적인 전하분리가 이루어지는 것으로 판단된다.
5. CONCLUSIONS
본 연구에서는 니켈, 아연, 황 세 가지 물질을 사용하여 수열합성법으로 NiZnS 광촉매를 제조하였으며, 황의 함량에 따른 광촉매의 변화와 수소 생산량을 비교하였다. NiZn:S = 2:2 몰 비일 때 수소 생산량이 가장 높게 나타났으며, 그 이후 황의 함량이 증가할수록 감소하는 추세를 보였다. SEM 분석으로 황의 비율이 높아질수록 입자크기가 증가하며, NiZn:S = 2:2 몰 비에서 입자크기의 편차가 가장 작게 합성되었고 비표면적이 넓은 형상을 나타냈다. 황의 함량이 적은 경우에는 황 전구체가 부족하여 ZnO가 부속 물질로 발생하였으며 황의 함량이 많아질수록 ZnS의 sphalerite 구조가 우세하게 나타났다. ZnO와의 이종접합과 XPS에서 확인된 ZnO의 oxygen vacancy로 인해 띠 간격이 감소하여 광촉매의 성능향상에 중요한 역할을 하였다. 과량의 thiourea는 광촉매 입자크기를 증가시키고 내부로 입사하는 빛을 차단해 성능을 저하시켰다. 재생산성 실험에서는 수소 생산이 매우 안정적으로 유지되는 경향을 보였으며 광부식성 또한 낮은 것으로 나타났다. 결론적으로 NiZnS 복합재료 광촉매에서 황 함량이 변화함에 따라 생성되는 결정상에 영향을 미쳤으며 최적의 황 함량에서 합성하였을 때 최대의 수소 생산량을 나타냄을 알 수 있었다.
Acknowledgements
이 논문은 2022년도 서울시립대학교 교내학술 연구비에 의하여 지원되었음.