AbstractWith the rapid development of portable devices and Energy Storage Systems (ESS), secondary batteries with high energy density and high capacity are in great demand. Among various candidates, Lithium-sulfur (Li-S) batteries have been considered for next-generation energy devices given their high theoretical capacity (1675 mAh g-1) and energy density (2500 Wh kg-1). However, the commercialization of Li-S batteries faces challenges due to sulfur’s low electrical conductivity and the shuttle effect, caused by the dissolution of lithium polysulfide intermediates in the electrolyte during the charge-discharge process. Herein, to resolve these problems, we report the fabrication of a vanadium dioxide (VO2) composite via a simple hydrothermal method and optimize the structure of VO2 for constructing an effective Multi-Walled Carbon Nano Tube (MWCNT) and 3D flower-shaped VO2 (MWCNT@VO2) binary sulfur host by a simple melt diffusion method. In particular, the polar VO2 composite not only physically absorbs the soluble lithium polysulfides but also has strong chemical bonds with a higher affinity for lithium polysulfides, which act as a catalyst, enhancing electrochemical reversibility. Additionally, MWCNT improves sulfur’s poor electrical conductivity and buffers volume expansion during cycling. The designed S-MWCNT@VO2 electrode also exhibits better capacity retention and cycling performance than a bare S-MWCNT electrode as a lithium polysulfide reservoir.
1. 서 론최근 휴대용 전자 제품과 전기자동차, 그리고 에너지 저장장치(Energy Storage System, ESS)의 수요 증가로 고용량, 고에너지밀도화 된 이차전지가 요구되고 있다. 그 중 가장 상용화된 리튬이온 배터리는 전이금속산화물을 기반으로 한 양극 활물질(e.g. LiCoO2, LiMn2O4, LiFePO4)의 사용으로 이론 용량과 에너지밀도를 최대 300 mAh g-1, 150~200 Wh kg-1 정도 구현할 수 있어 현재의 수요를 충족시키기 어려운 상황이다. 이에 기존의 전지를 대신할 높은 용량과 에너지밀도를 갖는 새로운 소재의 차세대 이차전지 연구 개발이 활발히 진행 중이다. 이러한 관점에서 황(Sulfur, S)을 양극 활물질로 사용하는 리튬-황 전지가 차세대 전지로 각광받고 있다. 황은 원자 당 2개의 전자를 받아 리튬 금속과 반응하여 Li2S를 만들어 내고 이는 기존의 전이금속산화물을 기반으로 한 전지보다 높은 이론용량(1675mAh g-1)과 에너지밀도(2500 Wh kg-1)를 가지고 있다. 게다가 황은 다른 활물질과 달리 비금속으로 환경 친화적이며 풍부한 매장량으로 비교적 저렴한 가격(S: $0.25/kg, LiCoO2: $40/kg)을 형성하고 있다. 이러한 장점에도 불구하고 리튬-황 전지의 상용화는 여전히 어려움을 겪고 있다. 황은 낮은 전기전도성(~10-30 S cm-1)으로 부도체적인 성격을 띄며, 충방전 과정 중 용해성을 띈 반응 중간 생성물인 리튬 폴리설파이드(Lithium polysulfide, Li2Sx, 4 ≤ x ≤ 8)가 전해질에 용출되어 셔틀현상(shuttle effect)이 일어나게 된다. 용출된 리튬 폴리설파이드는 리튬 금속과 반응하여 Li2S를 생성하며 이는 황과의 밀도 차 (S: 2.03 g cm-3, Li2S: 1.66 g cm-3) 로 인해 양극에는 부피팽창, 음극인 리튬 금속에는 리튬 덴드라이트(dendrite)의 형성으로 활물질의 비가역적인 손실 및 용량 저하로 이어지게 된다[1-5].
위와 같은 문제점들을 해결하기 위해 높은 전도성과 유연한 구조를 가진 다공성 탄소, 그래핀, 탄소나노튜브 등 탄소계열 물질을 황과 함께 복합화하여 전기전도도 향상, 전극 내 황의 함량 증가와 폴리설파이드 용출 방지 및 충방전 시 부피팽창을 완화하는 연구가 주목받고 있다[6,7]. 하지만, 비극성인 탄소의 사용은 극성인 리튬 폴리설파이드와 비교적 약한 물리적 결합으로 장기적인 측면에서 리튬 폴리설파이드의 용출을 막기에는 어려움이 존재한다[8]. 따라서 최근에는 TiO2[9], CoS2[10], TiN[11] 등 극성물질인 금속 산화물, 황화물, 나이트라이드계 등을 첨가하여 리튬 폴리설파이드와의 강한 화학적 결합으로 비극성인 탄소보다 더 높은 전자 친화력으로 사이클 중 용해성을 띈 리튬 폴리설파이드의 용출을 막아 셔틀현상을 완화하면서 전기화학적 촉매의 역할을 하는 연구가 주목을 받고 있다.
그 중에서도 VO2는 가장 뛰어난 구조적 유연성과, 용해성을 띈 리튬 폴리설파이드 보다 산화환원 전압대가 높아 강한 화학적 반응성으로 전해질로 리튬 폴리설파이드의 용출을 막아 충방전 시 Li2S의 생성을 감소시켜 셔틀현상의 완화에 도움을 준다고 보고되고 있다[12-15]. 하지만 낮은 전도특성으로 단독사용에는 어려움이 있어 본 연구에서는 간단한 수열합성법을 통해 최적화된 형태를 가진 VO2를 제조하고, 황과 다중벽 탄소 나노튜브(Multi-Walled Carbon Nano Tube, MWCNT)[16,17]와 함께 최적화된 VO2를 Melt diffusion 공법을 통해 복합화 시킴으로써 전기전도성 향상과[18] 셔틀현상을 완화한 차세대 리튬-황 전지용 양극소재로써의 가능성을 평가하였다.
2. 실험 방법2.1 VO2 분말 제조본 연구에서는 VO2 분말 제조를 위해 80 mL의 DI water에 vanadium pentaoxide (V2O5, ≥98%, Sigma-Aldrich) 2.4 g 과 oxalic acid dihydrate (H2C2O4∙2H2O, ≥99%, Sigma-Aldrich) 4.99 g을 넣고 80 °C에서 교반 시킨 후, 용액이 푸른색으로 변하였을 때 6 mL를 추출하여 Isopropanol (2-Propanol, 99.5%, Samchun chemical) 60mL와 섞어 200 °C에서 분말 형상의 최적화를 위해 각각 2.5시간, 5시간, 7.5시간 동안 수열합성을 진행하였다. 수열 합성 이후 생성된 혼합물은 에탄올 (99.9%, Samchun chemical) 및 DI water를 이용해 반복적으로 원심분리를 실시하였으며 그 후 동결건조를 통해 VO2 분말을 추출하였다[19].
2.2. 전극제조황과 MWCNT 분말을 3:2의 무게비율로 몰타패슬을 이용하여 혼합하였다. VO2 첨가에 따른 비교군을 제조하기 위해 해당 혼합과정에서 황의 5 % 무게비율만큼 VO2를 첨가하여 혼합하였고 각각 S-MWCNT, S-MWCNT@VO2로 명명하였다. 혼합된 분말은 아르곤 가스 분위기의 글로브 박스에서 스웨즈락에 밀봉 후 Melt diffusion 공법으로 155 °C에서 12시간 동안 아르곤 가스 분위기 하에서 열처리를 실시하였다. 전극 슬러리는 S-WMCNT(@VO2) : Super P : SBR/CMC를 70 : 20 : 10의 중량비로 섞어 제조한 후 Al 호일 위 1 5 0 μm의 두께로 닥터 블레이드를 사용하여 도포하고 이후 60 °C에서 진공 열처리를 실시하였다.
2.3. 코인셀 조립전기화학적 성능 평가를 위해 아르곤 가스 분위기의 글로브 박스에서 CR2032 타입의 코인셀을 제작하였다. 반쪽 셀(half cell) 테스트를 위해 리튬 금속을 상대전극으로, 제작한 S-MWCNT, S-MWCNT@VO2 전극을 작동전극으로 하였다. 1M LiTFSI 농도의 dimethoxymethane (DME)와 1,3-dioxolane(DOL)를 1:1로 혼합한 용매에 0.2M의 LiNO3를 첨가제로 사용한 전해질을 사용하였으며, 코인셀 조립 시 1 5 0 μl를 주입하였다. 모든 전지의 실험은 상온에서 진행하였고, 전기화학적 성능 평가 및 전기화학 임피던스 분광법은(Electrochemical Impedance Spectroscopy, EIS) Automatic Battery Cycler(WBCS300L, WonATech)와 Potentiostat(VSP-3e, BioLogic)을 이용하여 Cut-off 전압범위를 1.7~2.8 V로 설정하여 진행하였다.
2.4. 특성분석결정구조에 대한 분석을 위해 X선 회절분석(X-ray Diffraction, D8 Advance A25 Plus, Bruker)을 이용하여 10 ≤ 2θ ≤ 70°의 범위에서 결정구조를 확인하였다. 주사전자현미경(Scanning Electron Microscopy, Mini-SEM, EM 30, GSEM)과 투과전자현미경(Transmission Electron Microscopy, TEM, TF30ST, FEI)을 이용하여 미세구조와 형태를 분석하였다. 비표면적 측정(Brunauer-Emmett-Teller, BET, 3Flex, Micrometrics)을 통하여 N2 분위기에서의 흡탈착을 통해 VO2의 비표면적을 분석하였다. 25~600 °C까지 분 당 10 °C의 승온속도로 열 중량 분석(Thermogravimetric analysis, TGA, Q600, TA Instrument)을 진행하여 분말 내 황의 함량을 분석하였다. 50~500 cm-1의 파수범위로 532nm 레이저에서 라만 분광기(Raman Spectrometry, RAMANtouch, nanophoton)를 이용하여 전기화학적 특성 평가 후 VO2의 리튬 폴리설파이드 흡착능을 확인하였다.
3. 결과 및 고찰본 연구에서는 간단한 수열합성법과 Melt diffusion 공법을 통해 황, MWCNT, VO2 복합체를 제조하였으며 실험에 대한 간단한 모식도는 그림 1에 나타내었다. 최적화된 VO2 형상 제어를 위해 수열합성 시간을 달리하여 제조하였고 이후 준비된 전극 재료들을 스웨즈락에 넣어 Melt diffusion을 통해 복합화 하였다.
수열합성 시 열처리 시간에 따른 VO2 분말의 결정 구조 분석은 그림 2(a)의 XRD 패턴을 통해 확인하였다. 2.5시간 동안 열처리한 분말은 비정질의 형태를 띄고 있으며 이를 제외하고는 단사정계 VO2 구조와 일치하는 것을 확인하였다. (ICDD card no. 01-084-7141) 미세구조 분석은 그림 2(b-d)의 SEM과 그림 3(a-c)의 TEM을 통해 확인하였으며 열처리 시간에 따라 미세구형의 형태에서 흐트러지는 형상을 확인하였다. 특히 5시간 동안 열처리한 VO2 분말은 TEM 이미지에서 미세구형과 더불어 뾰족한 가시 형태의 부산물이 생성되어 마치 입체적인 꽃과 같은 형상을 띄고 있는 것을 확인하였다. 이와 같은 형상으로의 변화는 Ostwald-ripening 과정[19-21]으로 인해 진행되는 것으로 여겨지며 반복된 과정에 따라 재결정화가 이루어지면서 속이 텅 빈 형태로 변화하는 것을 확인할 수 있었다. 반면 7.5시간 동안 열처리한 VO2 분말은 미세구형 주변에 붙어있던 부산물들이 탈락되는 것으로 사료되며, 구형의 형태를 띄는 것을 확인하였다. 그림 4(d-f)는 VO2 분말의 EDS mapping 결과로 V와 O 원소가 고르게 분포되어 있음을 확인하였다. 또한 TEM 이미지 우측 상단 각각의 SAED 패턴을 통해 열처리 시간이 증가할수록 비정질에서 다결정으로 변화하는 것을 확인하였다.
그림 4는 N2 분위기에서의 흡탈착에 따른 BET 그래프를 나타낸 것이며 모든 VO2 분말은 전형적인 4번째 타입의 등온선을 나타내었다. 각각 표면적은 10.25 m2 g-1, 16.4 m2 g-1, 8.48 m2 g-1로 5시간 동안 열처리한 VO2 분말이 두 분말보다 비교적 큰 표면적을 나타내어 해당 시간동안 열처리한 VO2 분말이 최적의 수열합성 조건 하에 얻어진 분말로 전극 내 안정적인 황의 고용과 용해성을 띈 리튬 폴리설파이드의 용출을 막는 촉매역할을 가장 잘 수행할 것으로 사료되어 5시간 동안 열처리한 VO2 분말을 첨가한 전극을 제조하여 비교하였다.
전기화학적 성능 평가를 진행하기에 앞서 황과 MWCNT, VO2 복합체의 합성 결과를 확인하기 위해 XRD 패턴 분석을 진행하였고 결과는 그림 5 (a)에 나타내었다. MWCNT는 26o와 42o에서 피크를 확인할 수 있으며, S-MWCNT, S-MWCNT@VO2 복합체에서 나타난 XRD 패턴은 황의 XRD 피크세기보다 감소하였으며, 또한 26o 주변에서 피크가 넓어진 것을 확인할 수 있었다. 이를 통해 황이 1 5 5°C에서 가장 낮은 점성을 가지면서 황과 MWCNT가 Melt diffusion 공법에 의해 합성이 잘 이루어진 것으로 파악된다[16]. 다만, VO2는 구성 비율이 낮아 XRD 패턴 분석으로는 복합체에서 구조 확인이 어려운 것으로 판단된다. 그림 5(c),(d)의 SEM을 통해 미세구조를 분석한 결과, 황과 MWCNT가 분리되지 않고 서로 잘 결합된 것을 확인하였다. S-MWCNT@VO2 이미지에서는 앞서 VO2 분말의 SEM 이미지에서 확인할 수 있었던 미세 구형 입자가 사이사이 박혀있는 것을 관찰하여 복합화가 잘 이루어진 것을 확인하였다. 복합체의 결정 구조 및 표면 형상뿐만 아니라 복합체 내 황의 함량을 확인하기 위해 TGA 분석을 진행하였다. 그림 5 (b)에서 260 °C 부근에서 급격한 중량감소가 5 5 0°C 부근까지 이어지는 것을 확인하였고 이에 따라 S-MWCNT 복합체에서는 62.1 wt%, S-MWCNT@ VO2 복합체에서는 58.82 wt%의 고용률을 확인함에 따라 VO2 첨가 시에도 안정적인 황의 고용을 확인하였다.
S-MWCNT, S-MWCNT@VO2 복합체를 전극으로 코인셀을 제조하여 순환전압전류법(Cyclic Voltammetry, CV)를 진행하였다. S-MWCNT 전극은 대략 ≤ 1 mg cm-2, S-MWCNT@ VO2 전극은 ~1 mg cm-2 의 전극 내 황 함량을 띄고 있으며, 그림 6(a),(b)에서 두 전극 모두 약 2.3 V, 2.0 V에서 두 개의 환원 피크를 나타내었다. 2.3 V에서 나타나는 첫 번째 피크는 고리형태의 황(S8)이 긴 사슬 리튬 폴리설파이드(Li2Sx, 4 ≤ x ≤ 8)로 환원되는 반응을 나타내는 피크이며, 이후 짧은 사슬 리튬 폴리설파이드(Li2SX, 2<x<4)로 연속적으로 환원이 진행되다가 2.0V에서 나타나는 두 번째 피크에서 짧은 사슬 리튬 폴리설파이드가 불용성인 Li2S2, Li2S로 환원되는 반응을 나타낸다. 또한 S-MWCNT 전극은 2.37 V, 2.39 V 부근에서, S-MWCNT@VO2 전극은 2.35V, 2.4 V 부근에서 각각 두 개의 산화 피크가 관찰되었는데, 이는 불용성인 Li2S2, Li2S가 다시 고리 형태의 황(S8)으로 전환되는 피크를 나타낸다[22, 23]. S-MWCNT@VO2 전극은 S-MWCNT 전극에 비해 더 낮은 전압 영역대에서 충전이 진행되었으며, 또한 산화환원 피크의 변화가 비교적 적고 세기가 더 강하며 사이클이 진행되는 동안 충전 시 더 낮은 전압으로 이동하는 것으로 보아 S-MWCNT@VO2 전극이 폴리설파이드의 용출을 막아 지속적인 충방전 과정에서도 비교적 가역적인 전기화학반응을 보이는 것을 확인할 수 있다[24]. 그림 6(c),(d)는 정전류 충방전법에 따른 0.1C (1C=1675 mA g-1)의 전류속도에서 S-MWCNT 전극과 S-MWCNT@VO2 전극의 충,방전 곡선을 나타내었다. 방전 곡선에서 두 개의 전압 평탄 구간을 관찰할 수 있으며 이는 CV 그래프에서 나타났던 것과 같이 첫 번째 전압 평탄 구간은 고리형태의 황(S8)이 긴 사슬 리튬 폴리설파이드로, 두 번째 전압 평탄 구간은 짧은 사슬 리튬 폴리설파이드가 불용성인 Li2S2와 Li2S로 환원되는 구간을 나타낸다. 또한 두 번째 전압 평탄 구간은 첫 번째 전압 평탄 구간에 비해 비교적 반응이 느리게 진행되기 때문에 전극의 전체 용량을 담당하게 되며[22], 상대적으로 두 번째 전압 평탄 구간이 더 긴 S-MWCNT@VO2 전극의 방전 곡선은 S-MWCNT 전극에 비해 용량이 더 크게 나타나는 것을 확인할 수 있었다. S-MWCNT@VO2 전극의 초기 방전 및 충전용량은 1163mAh g-1, 1037 mAh g-1으로 S-MWCNT 전극의 초기 방전 및 충전용량(601 mAh g-1, 532 mAh g-1)과 비교해 보았을 때 훨씬 더 높은 용량을 나타내었다.
그림 7(a)는 0 .5 C의 전류속도에서 장기 수명테스트를 진행한 전극의 그래프를 나타내며 S-MWCNT 전극은 100사이클 이후 두 번째 방전 용량 대비 40%의 용량 유지율을 보이는 반면, S-MWCNT@VO2 전극은 비교적 높은 52%의 용량 유지율을 확인하였다. 이러한 성능 차이는 VO2를 첨가함으로써 황과 MWCNT만 양극 활물질로 사용했을 때보다 물리적 결합력 뿐만 아니라 높은 산화환원 전압대로 인한 화학적 결합력의 증가로 리튬 폴리설파이드의 용출을 막아 가역적인 반응의 증가로 인한 수명특성 향상으로 사료된다. 그림 7(b)는 충방전 속도에 따른 율속 특성 평가를 위해 전류속도를 0 .1C, 0.5 C, 1 C, 2 C, 5 C로 단계별로 증가시키면서 진행하였으며 S-MWCNT@VO2 전극이 1206, 565, 501, 455, 373 mAh g-1의 방전 용량으로 모든 전류 속도에서 더 높은 용량을 나타내었으며 다시 0.5C로 진행하였을 때 505 mAh g-1의 방전 용량을 나타내면서 초기 0.5C 전류속도에서의 방전 용량 대비 89%의 성능 회복률을 보였다. 이에 반해 S-MWCNT 전극은 모든 전류속도에서 낮은 방전 용량을 나타내었다. 이러한 율속 특성은 전하 전달과 전극 계면의 저항과 연관이 있는데[14], 이를 확인하기 위해 EIS 분석을 진행하였고 그림 7(c)에 Nyquist plot 결과를 나타내었다. 각 전극은 모두 한 개의 반원을 나타내었고, 이는 전극 계면에서의 전하 전달 저항(Rct)을 의미한다. S-MWCNT 전극은 54 Ω, S-MWCNT@ VO2 전극은 40 Ω의 더 낮은 Rct 값을 나타내었다. 이는 MWCNT와 더불어 VO2 첨가에 따른 물리적 및 화학적 결합력의 향상으로 리튬 폴리설파이드의 흡착 증가로 인한 전해질로의 용출을 막아 가역적인 전기화학적 반응으로 인해 빠른 전하전달을 야기하였으며 앞선 CV 그래프, 율속 특성 평가 결과와 부합하는 것을 확인할 수 있다.
그림 8은 앞선 전기화학평가 결과들을 바탕으로 VO2 첨가에 따른 향상된 전기화학적 특성을 파악하기 위해 측정한 라만 그래프이다. 해당 전극들을 코인셀로 제조하여 정전류 충방전법으로 1.7~2.8 V의 전압 범위에서 0.5 C의 전류속도로 방전, 충전, 방전을 진행하여 최종적으로 전극 표면에 남아있는 물질들을 확인하였으며, 용이한 측정을 위해 아르곤 가스 분위기 안에서의 글로브 박스 안에서 코인셀을 분해한 뒤 전해질로 헹궈낸 후 전극을 Poly Vinyl Chloride (PVC) 필름 아래에 고정시켜 공기가 차단된 상태에서 측정을 진행하였다. 97, 141, 192, 283, 406 cm-1 에서 VO2 분말의 라만 피크가 발견되었지만, 전극에 포함된 VO2의 구성 비율이 낮아 S-MWCNT@VO2 전극의 라만 피크에 미치는 영향은 낮은 것으로 사료된다. S-MWCNT 전극과 S-MWCNT@VO2 전극에서 공통적으로 뜨는 278, 300~400 cm-1 영역대의 피크는 전해질염으로 사용된 LiTFSI의 피크로 사료되며, 첨가제로 사용된 LiNO3의 피크는 잘 뜨지 않는 것으로 확인되었다[25]. 또한 S-MWCNT, S-MWCNT@VO2 전극의 피크에서 공통적으로 S8(216, 217, 219, 227 cm-1) 피크를 확인할 수 있었으며, S-MWCNT 전극에서는 S42-(234 cm-1) 피크를 발견함에 따라 방전 과정 중 비가역적인 반응이 일어났음을 유추할 수 있다[25-27]. 반면, S-MWCNT@VO2 전극에서는 Li2 S2 (174 cm-1)피크를 확인할 수 있으며 이는 VO2의 첨가로 인해 전해질로의 리튬 폴리설파이드 용출이 완화되었고 이로 인해 S8과 Li2S의 가역적인 반응이 일어나는 것으로 확인되어진다[25].
5. 결 론본 연구에서는 VO2의 첨가에 따른 전기화학적 성능을 분석하기 위하여 간단한 수열합성법을 통해 최적화된 VO2의 형상 제어를 진행하였고, Melt diffusion을 통해 황과 MWCNT, 입체 꽃 형태의 VO2가 복합화된 전극을 제조하여 성능을 비교하였다. 최적화된 S-MWCNT@VO2 전극은 S-MWCNT 전극과 비교하여 우수한 충방전 용량과 율속 특성을 보이며, 0.1C 전류속도에서 1163 mAh g-1의 방전 용량과 0.5C 전류속도에서 100 사이클 동안 두 번째 방전 용량 대비 5 2%의 방전 용량 유지율을 나타냈다. 이를 통해 극성 물질인 VO2의 첨가는 화학적 결합력의 증가로 리튬 폴리설파이드와의 흡착을 증가시켜 전하전달 향상과 반응 중 셔틀현상 완화에 도움을 주어 차세대 리튬-황 전지용 양극 활물질 소재의 개발에 새로운 가능성을 줄 것으로 예상된다.
AcknowledgmentsThis work was supported by the National Research Foundation of Korea (NRF) grant funded by the Korea Government (NRF-2021R1A4A1030318 and NRF-2022R1C1C1011386). This result was supported by Regional Innovation Strategy (RIS) through the National Research Foundation of Korea (NRF) grant funded by the Ministry of Education (MOE) (2021RIS-003)
Fig. 3.TEM images of (a) VO2 (2.5h), (b) VO2 (5h), (c) VO2 (7.5h), EDS mapping images of (d) VO2 (2.5h), VO2 (5h), VO2 (7.5h) 
Fig. 5.XRD patterns of (a) MWCNT, Elemental sulfur, S-MWCNT, S-MWCNT@VO2, (b) TGA curves of S-MWCNT, S-MWCNT@VO2, SEM images of (c) S-MWCNT, (d) S-MWCNT@VO2 composites. 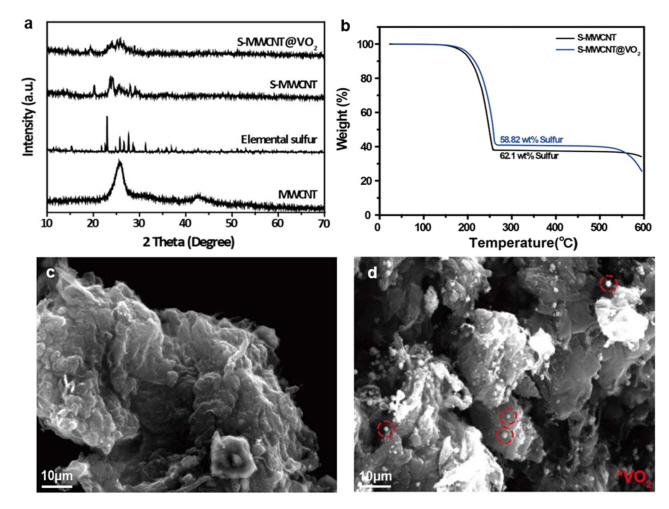
Fig. 6.CV curves of (a) S-MWCNT, (b) S-MWCNT@VO2 electrodes, galvanostatic curves of (c) S-MWCNT, (d) S-MWCNT@VO2 electrodes at 0.1C. 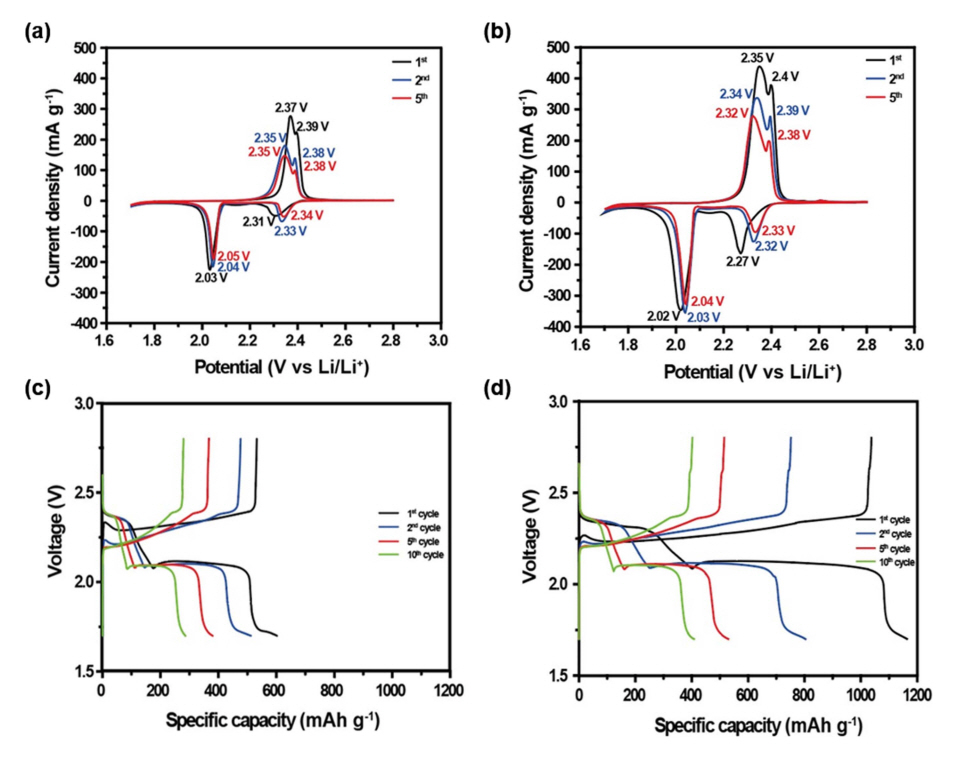
REFERENCES2. A. Rosenman, E. Markevich, G. Salitra, D. Aurbach, A. Garsuch, and F. Chesneau, Advanced Energy Materials. 5, (2015).
3. L. W. Yang, Q. Li, Y. Wang, Y. X. Chen, X. D. Guo, Z. G. Wu, G. Chen, B. H. Zhong, W. Xiang, and Y. J. Zhong, Ionics. 26, 5299 (2020).
6. C. M. Xu, Y. S. Wu, X. Y. Zhao, X. L. Wang, G. H. Du, J. Zhang, and J. P. Tu, J Power Sources. 275, 22 (2015).
8. Q. Pang, X. Liang, C. Y. Kwok, and L. F. Nazar, Nature Energy. 1, (2016).
9. W. J. Dong, D. Wang, X. Y. Li, Y. Yao, X. Zhao, Z. Wang, H. E. Wang, Y. Li, L. H. Chen, D. Qian, and B. L. Su, Journal of Energy Chemistry. 48, 259 (2020).
10. C. Yang, Y. Li, W. Peng, F. Zhang, and X. Fan, Chem Eng J. 427, (2022).
11. A. M. Beyene, J. H. Yun, S. A. Ahad, B. Moorthy, and D. K. Kim, Applied Surface Science. 495, (2019).
12. B. Chen, J. Wei, X. Li, Y. Ji, D. Liang, and T. Chen, J Colloid Interface Sci. 629, (2023).
13. Y. Song, W. Zhao, X. Zhu, L. Zhang, Q. Li, F. Ding, Z. Liu, and J. Sun, J.,ACS Appl Mater Interfaces. 10, 15733 (2018).
15. Y. Ning, B. Wang, F. Jin, J. Yang, J. Zhang, H. Luo, F. Wu, Z. Zhang, H. Zhang, Y. Zhou, and D. Wang, Journal of Alloys and Compounds. 838, (2020).
17. M. Zheng, Y. Chi, Q. Hu, H. Tang, X. Jiang, L. Zhang, S. Zhang, H. Pang, and Q. Xu, J Mater Chem A. 7, 17204 (2019).
18. K. Cho, C. Balamurugan, H. Im, and H. J. Kim, J.,Korean Journal of Metals and Materials. 59, 813 (2021).
20. W. S. Weng, J. Lin, Y. C. Du, X. F. Ge, X. S. Zhou, and J. C. Bao, J Mater Chem A. 6, 10168 (2018).
21. F. Y. Kong, M. Li, X. Y. Yao, J. M. Xu, A. D. Wang, Z. P. Liu, and G. H. Li, Crystengcomm. 14, 3858 (2012).
22. R. Xu, J. Lu, and K. Amine, Advanced Energy Materials. 5, (2015).
25. M. Hagen, P. Schiffels, M. Hammer, S. Dorfler, J. Tubke, M. J. Hoffmann, H. Althues, and S. Kaskel, J Electrochem Soc. 160, A1205 (2013).
|
|
|||||||||||||||||||||||||||||||||||||