1. 서 론
유·무기 하이브리드 페로브스카이트 물질은 우수한 흡광도 및 긴 확산거리로 인해 태양전지에서 현재 독보적인 흡광 물질로 각광 받고 있다[1-3]. 특히 제조의 용이함과 페로브스카이트 조성의 다변화를 통한 유/무기 물질들과의 폭넓은 호환성은 구조적/물리적/전기적 성질의 튜닝을 통해 에너지/디스플레이 소자로의 확장성을 인정받아 왔다[4]. 유/무기 페로브스카이트 물질들 가운데서도 methylammonium lead tribromide (MAPbBr3, CH3NH3Br3)와 methylammonium lead iodide (MAPbI3, CH3NH3PbI3)는 2015년부터 에너지 저장 매체 로서의 리튬 이온 배터리 전극으로 가능성을 인정받아왔지만, 동시에 사이클 안정성에 있어서 해결해야 할 많은 문제점을 드러내기도 하였다[5-8]. Xia et al. 논문 결과에 의하면 CH3NH3Br3 물질은 최초 332mAh/g에 달하는 비용량(specific capacity)을 보여주며 리튬 이온 저장 매체 로서의 가능성과 근본 메커니즘 연구에 대한 필요성을 불러 일으켰지만 사이클에 따른 비가역 용량의 급격한 증가는 개선되어야 할 문제점으로 지적되어졌다[9]. Tathavadekar et al. 논문 결과는 MAPbI3 bulk phase와 2차원 butylammonium leas iodide의 구조적 변형을 통해 리튬 이온의 저장 및 이동의 용이성의 개선은 증가된 용량과 사이클 안정성을 가져올 수 있다는 것을 보여주고 있다[10].
최근에 들어와서야 리튬이온의 저장과 관련된 전기화학적인 반응 메커니즘에 대한 구체적인 연구가 보고되기 시작하였다. Vicente et al. 논문에 보고된 발견은 CH3NH3PbBr3 물질의 operando X-ray diffraction (XRD) 실험을 통해 밝혀졌다. 주목할 만한 결과는 CH3NH3PbBr3 페로브스카이트 물질로의 리튬 삽입 시 페로브스카이트와 lithiated phase의 형성이 선행되며 이어지는 전환반응에 따른 metallic lead (Pb)의 형성은 리튬 이온과의 합금화 (alloying) 반응을 통한 추가용량을 발생시킨다는 것이다[11]. CH3NH3PbBr3과 Pb형성을 야기하는 전환반응의 비가역 손실이 배터리 음극 물질로의 실질적 응용을 위해 해결해야 할 중요한 문제라는 것을 발견하였다.
다시 말해, 배터리 구동시의 순차적인 전환반응과 합금화 반응의 비가역 손실과의 복잡한 연계성과 유/무기 물질의 전해질 환경내에서의 구조적 불안정성은 현재까지도 여전히 블랙박스로 남아있다. 동시에 유/무기 페로브스카이트 물질들이 그동안 태양전지, 디스플레이 및 센싱 소자 관련 분야에서 보여주었던 조성 튜닝을 통한 광학적/전기적 물성 튜닝의 성공적인 연구 결과들은 리튬 저장과 연관된 전기화학적 성질의 개선과 관련된 근본/응용 연구의 잠재적 성공 가능성을 대변해주고 있다[12-14].
무엇보다도 상당한 가능성과, 동시에 복잡성을 내포하고 있는 유/무기 페로브스카이트 물질의 배터리 전극물질로의 응용에 관한 근본 연구를 위해서는 리튬 이온의 유/무기 페로브스카이트의 전기화학적 산화/환원 반응 및 페로브스카이트/전해질 계면 반응을 첨가제 (바인더+전도재)의 영향과 독립시켜 조사하기 위한 플랫폼 구축이 필요하다.
본 연구에서는 기존의 슬러리 증착을 통한 배터리 구동이 가진 계면의 구조적 복잡성 및 유/무기 페로브스카이트, 특히 MAPbBr3내에서의 리튬 이온의 저장과 관련된 여러 부가반응을 최소화하기 위한 시스템을 구축하였다. 첨가제 없이 유/무기 페로브스카이트 물질을 통한 리튬 이온과의 전기화학적 반응을 electrophoretic deposition (EPD)을 통한 전극 증착 시스템을 도입하였으며 결정화된 전극을 사용하기 위해 inverse temperature crystallization 방법을 통해 단결정 MAPbBr3 결정립으로 이루어진 flake들을 EPD 시스템을 이용해 배터리 전극으로 활용하였다. 더불어 유/무기 페로브스카이트 활물질과 전해질 계면에서의 물리적 안정성도 리튬염과 유기용매의 교체를 통해 조사하였다.
2. 실험 방법
2.1. MAPbBr3 합성 및 단결정 성장
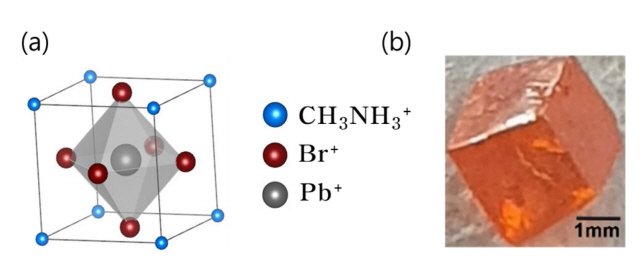
본 연구에 사용되어진 유·무기 하이브리드 페로브스카이트 물질은 methylammonium lead bromide(MAPbBr3)로, Lead(II) bromide (PbBr2, 99.999%)와 methylammonium bromide(MABr, 98%)를 1:1의 몰 비율로 N,NDimethylformamide(DMF, 99.8%)에 1M 농도로 투입 후 8시간 이상 질소 분위기의 글러브 박스에서 교반하여 합성하였다. 단결정 MAPbBr3 flake들을 얻기 위하여, 온도가 증가함에 따라 DMF에서 MAPbBr3의 용해도가 낮아지는 특성을 이용한 inverse temperature crystallization 방법을 사용하였다[15,16]. 용액을 24시간동안 80 °C로 유지하여 결정을 석출시키고, 남아있는 DMF 용매를 제거하기 위해 toluene(99.8%, Sigma-Aldrich)으로 세척 후 건조하여 단결정 flake를 수득하였다. 얻어진 MAPbBr3 flake들은 XRD측정을 통해 결정성을 분석하였다. 그림 1에 MAPbBr3 결정구조 모식도와 수득한 단결정의 광학현미경 사진을 나타내었다.
2.2. MAPbBr3 음극 제작
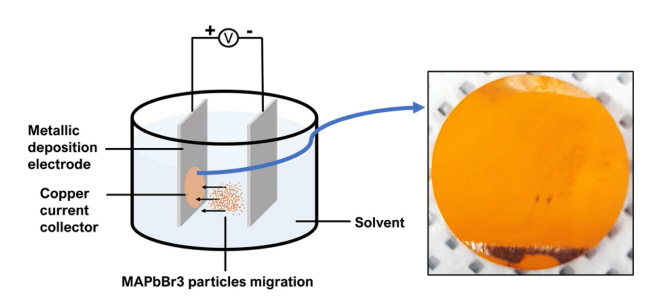
MAPbBr3 flake로 리튬 이온 배터리의 전극을 제작하기 위해, 25 μm 두께의 구리 포일을 집전체로 사용하여 그 위에 MAPbBr3를 EPD을 이용하여 증착하였다. MAPbBr3 의 EPD 증착 셋업은 그림 2의 개략도에 나타내었다. 우선 MAPbBr3 단결정 flake(200 mg)를 toluene에 분산시킨 후 sonication을 통해 균일한 용액을 만들고, 두 개의 스테인리스 판에 각각 구리 포일을 부착하여 분산액에 담가 교류 전압(300 V, 2 Hz)으로 전기장을 인가하여 flake 표면에 대전된 전하를 통해 증착하였다. EPD 증착 시 전류가 nano ampere 수준에서 유지됨으로써 용액내 페로브스카이트 flake 미세 분말이 toluene에서 해리되거나 부가반응을 일으키지 않음을 확인하였다. 그림 EPD로 구리 포일위에 증착한 전극 (그림 2)은 Ar 분위기의 글로브박스에서 120 °C로 2시간 열처리하였다.
EPD 방법으로 제작한 MAPbBr3 단결정 flake 음극의 리튬이온의 저장과 관련된 전기화학적 특성 평가를 위해 코인셀(CR2032)을 제작하였다. MAPbBr3 전극을 작업전극으로, 리튬칩을 상대전극과 기준전극으로 사용하여 polycarbonate(PC)와 dimethyl carbonate(DMC)를 1:1(v/v)로 혼합한 1M 농도의 사불화인산리튬염(LiBF4) 용액을 전해질로 사용하였다. 또한 전해질에 따른 리튬 이온 배터리 충/방전의 전기화학적 반응의 차이를 평가하기 위해 ethylene carbonate(EC)와 diethyl carbonate(DEC)를 1:1(v/v)로 혼합한 1M 농도의 육불화인산리튬염(LiPF6) 용액을 전해질로 사용하여 비교실험을 수행하였다. Battery Testing System CT-4000모델(Neware)을 사용하여 제작한 코인셀의 충방전을 실시하였다. 상온에서 50 mA/g의 일정한 전류밀도로 0.01 V에서 1.80 V의 전압범위에서 충방전 테스트를 진행하였다.
3. 결과 및 고찰
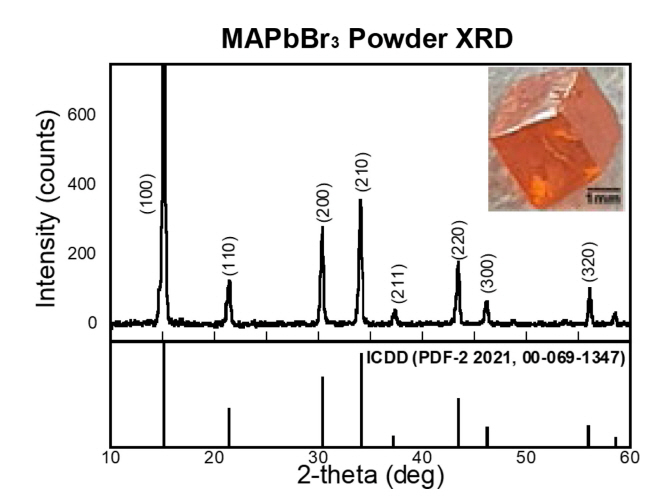
Inverse temperature crystallization을 통한 MAPbBr3 단결정 생성여부를 확인하기 위하여 XRD 측정을 진행하였으며 각 결정면에서의 피크들을 그림 3에 수록하였다. 관찰된 XRD 패턴의 피크들은 입방정의 결정구조를 보여주며 기존에 보고된 단결정 XRD 패턴들과 일치되는 결과를 보여주고 있다[17]. Inset에 있는 MAPbBr3 광학현미경 이미지는 수 밀리미터 flake들이 XRD 패턴과 일관된 입방정화 되어있는 단결정임을 잘 보여준다.
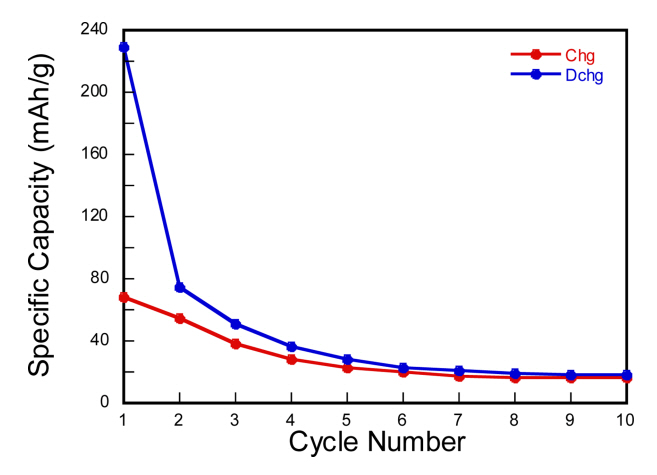
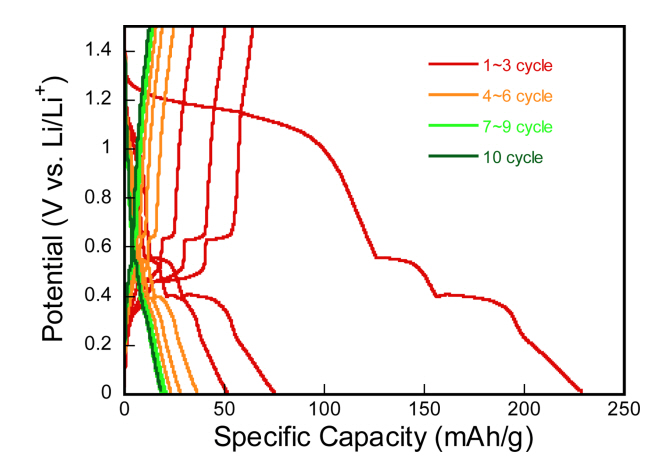
MAPbBr3 단결정 flake의 리튬 이온 삽입/탈리와 관련된 전기화학반응을 조사하기 위해 코인 셀을 50 mA/g의 전류 밀도로 0.01 V에서 1.80 V의 전압범위에서 충/방전 테스트를 진행하였다. 그림 4의 사이클 용량 변화를 보면, 첫번째 방전은 최대 229 mAh/g까지 나타나지만 사이클에 따른 용량의 급격한 감소가 관찰된다. Dawson et. al 논문은 MAPbBr3에 리튬이온이 한개 삽입된다고 가정할 경우, 최대 이론 비용량은 55.96 mAh/g으로 보고하고 있다[18]. Vicente 연구그룹은 MAPbBr3의 리튬이온 저장용량은 최대 3몰농도(LixCH3NH3PbBr3, x=3)에 달한다고 보고하고 있다[19]. 다시 말해 단위정당 3개의 리튬이온 삽입에 의해 최대 168 mAh/g의 비용량을 나타낼 수 있다는 것이다. 본 연구진의 결과와 비교할 때 그림 4와 5에 나타내어진 것과 같이 더 높은 방전용량의 관찰은 리튬이온의 삽입 반응 외에 또 다른 리튬이온 저장 메카니즘의 활성화에 기인한다고 볼 수 있다. 실제로 첨가제를 활용한 슬러리 증착을 통해 전환반응 (conversion reaction)과 합금화 (alloying) 반응에 대한 심도 있는 연구가 진행되어왔으며 이는 본 연구진의 EPD를 통한 충/방전 사이클에서 나타나는 리튬이온 저장 메커니즘과 비교하여 후반부에 논의된다[5].
그림 4의 사이클에 따른 용량변화를 통해 언급했듯이 첫 방전 이후 급격히 비용량이 감소하나 전체 충/방전 사이클에서 최소한 두 개의 명확한 전압의 plateau 구간이 나타나는 것으로 미루어 보아, 리튬이온의 삽입 및 탈리와 관련된 전기화학적 반응은 정상적으로 일어나는 것이 그림 5의 충/방전 voltage profile 커브를 통해 확인되어진다.
Garcia-Belmonte 그룹의 Operando-XRD 결과에 의하면 초기 방전 시 lithiated phase (Lix:CH3NH3PbBr3)와 pure CH3NH3PbBr3 phase의 공존이 0.3<x<1.08 구간에서 관측되며 이는 대략 2.3~1.8 V vs. Li/Li+ 사이의 셀 전압에 해당한다고 보고되어진다[19]. 리튬 삽입이 진행됨에 따라 최초의 CH3NH3PbBr3 페로브스카이트 phase는 사라지고 전환반응 (Li:CH3NH3PbBr3→CH3NH3Br+LiBr+Pb)에 따른 용량의 기여가 x=~2 (1.08 V vs. Li/Li+)까지 뒤따른다. 이어지는 Pb(II)→ Pb(0)로의 환원반응이 1.08 V vs. Li/Li+에서 이루어지고 이후에는 (x>2) Li-Pb 합금화 반응이 0.4~0.6 V vs. Li/Li+구간에서 이루어진다.
그림 5에 나타낸 충/방전 voltage profile 커브를 살펴보면 첫번째 방전 사이클에서 lithiated phase의 생성구간인 2.2V주변에서의 plateau는 관찰되지 않았다. 실제로 2V 이상의 방전구간에서는 리튬의 삽입동안 지속적인 배터리의 failure가 관측되었다. 이는 실제로 리튬의 삽입에 동반되는 격자 뒤틀림 현상에 의해 lithiated phase 와 pure phase 의 공존이 어렵다는 연구 결과와 일치하는 결과이다[19]. EPD 박막에서의 전환반응(Li:CH3NH3PbBr3→CH3NH3Br+LiBr+Pb)의 시작은 1.2 V 주변에서 plateau 구간에서 관찰된다. 계속되는 방전 과정에서 리튬의 삽입에 따른 plateau에 의한 용량이 전체 용량의 50%에 달하며 이후의 사이클에서 급격하게 감소하는 것이 확인되었다. 다시 말해, 첨가제 없이 CH3NH3PbBr3만으로 전극물질을 구성하였을 때 전환반응에 의한 용량의 대부분이 비가역 용량으로 손실된다는 것이다. Mullins et al 논문 결과에 의하면 1.1 V 주변에서의 방전 plateau는 Pb(II)→Pb(0)로의 환원 반응에 기인한다고 보고되어진다[20]. 방전 시 전환반응의 결과로 생성되는 metallic Pb의 환원반응에 의한 1.1V 주변에서의 plateau에 해당하는 용량의 대부분이 첫번째 사이클 이후 배터리 비가역 용량의 대부분을 차지하는 것으로 밝혀졌다.
이어지는 ~0.4 V, ~0.5 V에서의 plateau는 LiPb+Pb, Li8Pb3+Pb의 합금화 반응에 의한 것으로 사이클에 따른 비가역 손실은 전환반응과 관련된 용량과 비교해 점진적으로 이루어졌음을 알 수 있다. 충전 시 리튬이온의 탈리는 0.64 V와 0.47 V vs. Li/Li+에서 관찰되며 방전 시 리튬 삽입과 유사한 비가역 손실용량을 보여주었다. 주목할 만한 것은 EPD 전극에서는 첨가제를 사용하는 슬러리 전극과 달리 2 V 주변에서의 전환반응에 의한 plateau의 관찰이 어려웠지만 합금화 반응에 의한 plateau의 형성은 명확하게 관찰할 수 있었다. 이는 EPD 전극에서는 lithiated phase의 형성에 따른 격자 뒤틀림을 첨가제 없이 수용하기 어려웠음을 의미한다. 또한 이어지는 미미한 용량의 전환 반응에 의한 LiBr과 Pb, 특히 metallic Pb의 생성에 이은 합금화 반응이 용량의 대부분을 차지했다.
본 연구에서 이론 비용량의 약 4배에 달하는 첫번째 방전과정의 높은 비용량은 3단계 반응 메커니즘, (1)lithiated phase의 생성, (2) 전환반응 및 이를 통한 metallic Pb의 생성, (3) 리튬과 Pb의 합금화 반응에 기반한 것으로 해석하였다. 앞에서 언급한 것처럼 (1)의 단계에서의 격자 뒤틀림으로 인해 (2)와 (3)의 반응들이 그림 5에서 관찰된 용량의 주된 리튬 저장 메카니즘으로 작용했다. 무엇보다도 첨가제를 사용하는 슬러리에 의한 여러 연구 그룹들의 결과와 첨가제를 사용하지 않고 활물질만을 사용하는 본 연구와의 차이는 첨가제 없이는 lithiated phase형성에 의한 용량이 격자 뒤틀림에 의해 리튬 삽입 시 높은 free energy의 증가로 이어져 그 용량이 극히 미미하다는 것이다. 첨가제를 사용하는 슬러리의 경우 격자 뒤틀림은 첨가제를 통해 어느정도 완화가 되어 용량이 확인되었다고 볼 수 있다.
그림 6은 EPD로 증착된 MAPbBr3 전극의 배터리 충/방전 전후를 SEM 이미지를 통해 비교한 것으로 EPD 증착 후 MAPbBr3층들이 표면에서 결정을 이루며 성장한 것을 알 수 있다. 수십 사이클의 배터리 충/방전 후에는 수십나노미터 사이즈의 파티클들이 뭉쳐진 모습을 하고 있으며 공극의 수가 현저히 증가한 것을 확인할 수 있었다. 이는 배터리 충/방전을 통한 합금화 반응의 결과로 구조적 미세화가 진행되었다고 판단되어진다.
슬러리를 통한 배터리 전극 형성 시 바인더 및 전도재의 역할뿐만 아니라 전해질과의 구조적 계면 안정성 역시 중요한 이슈가 되어왔다[21-23]. EPD 증착 시스템의 경우 유/무기 페로브스카이트가 갖는 전해질 환경의 복잡성을 첨가제의 영향없이 단순하게 볼 수 있게 하는 플랫폼이라고 할 수 있다. 특히 첨가제가 있는 슬러리의 경우 전해질/활물질의 계면에 대한 구조적/전기화학적 안정성을 그대로 반영 못하는 반면 EPD의 경우 전해질과 활물질의 넓은 표면적은 계면의 안정성을 용량의 변화로 그대로 변화시킨다. 이에 따라 우선적으로 CH3NH3PbBr3 페로브스카이트가 전해질과 반응에 따른 구조적/전기화학적 안정성을 비교하였다. 우리는 우선적으로 전해질의 리튬염으로 그림5에서 사용된 LiBF4 대신 LiPF6 (1M in EC/DEC 1:1 v/v)을 사용하였다. 첫 방전에서 비용량의 증가 없이 전위가 0으로 떨어짐을 확인하였고 이는 LiBF4를 리튬염으로 사용한 결과(그림 5)와 비교할 때 전해질과 접촉해 있는 유/무기 페로브스카이트 물질의 전기화학적 불안정성을 명확하게 보여주고 있다.
리튬염 외에 전해질의 유기용매와 활물질의 반응성을 확인하기 위해, Ar 분위기의 글로브박스 내에서 PC, EC, DEC, DMC에 MAPbBr3 단결정과 MAPbBr3가 EPD로 증착된 구리 포일을 각각 투입하였다. 표 1은 24시간 후의 구리 포일에 증착된 MAPbBr3 박막의 변화를 보여주고 있다.
EC와 PC의 경우, 결정 flake와 포일에 증착된 활물질을 모두 녹이는 것으로 확인되었으며, DEC의 경우 결정과 구리 포일 위에 증착된 활물질을 녹이지는 못하였지만, 포일과 활물질의 접착력을 약화시켜 증착된 박막이 집전체로부터 분리되었다. 또한 DMC는 결정과 증착된 활물질을 모두 녹이지 못하는 것으로 확인되었다.
EC 또는 PC와 같이 탄소고리 구조를 가지는 유기용매는 높은 유전상수를 통해 리튬염과 함께 사용되는 필수적인 유기용매이지만, 위 결과를 통해 MAPbBr3의 안정성을 크게 저하시킴을 확인하였으므로, DMC와 같은 사슬구조의 유기용매를 높은 비율로 섞어 EC 또는 PC의 높은 점도를 낮춤과 동시에 MAPbBr3의 안정성을 높여야 함을 알 수 있다.
본 연구에서는 유·무기 하이브리드 페로브스카이트 중 MAPbI3에 비해 높은 이론 비용량을 가진 MAPbBr3의 합성과 inverse temperature crystallization 방법으로 단결정을 성장시켰다. 단결정 MAPbBr3 flake와 첨가제가 포함되지 않은 순수 활물질로 구성된 EPD 증착의 조합을 통해 페로브스카이트 결정 고유의 리튬 삽입/탈리와 관련된 리튬 저장 메카니즘을 슬러리 코팅과 비교하여 살펴보았다. 초기 방전 시 리튬 삽입을 통한 자발적인 lithiated phase의 생성은 페로브스카이트 격자 뒤틀림을 유발시켜 미미한 방전용량을 보였으나 이어지는 metallic Pb의 생성을 이끄는 전환반응에 이은 리튬 합금화 반응이 전극용량의 대부분을 차지했다. 전환반응과 관련된 높은 비가역 용량은 MAPbBr3을 배터리 음극물질로 이용할 경우 사이클 안정성에 직접적으로 관련 있는 요소임이 관찰되었다. 사이클 안정성과 관련된 활물질/전해질의 물리적 안정성을 탐침하는데 있어서 전해질의 구성성분인 리튬염과 유기용매의 교체를 통해 유/무기 페로브스카이트 물질의 전해질 환경에서의 구조적 불안정의 문제를 구체화할 수 있었다.
무엇보다도 슬러리 증착 시스템은 도전재와 바인더가 활물질과 이루는 계면의 영향으로 전해질/활물질 계면에서의 구조적 안정성을 독립적으로 실험하기 어려웠던 반면, EPD 증착 시스템은 집전체에 높은 밀도로 활물질만을 증착시키기 때문에 계면에 대한 직접적인 연구를 가능하게 하였다. 그러나 도전재와 바인더를 쓰지 않은 시스템에서 MAPbBr3의 전기 전도도는 슬러리에 비교하여 취약할 수 밖에 없다. 실제로 트랜지스터 소자에 단결정 MAPbBr3의 전도도를 측정하였을 때 본 연구진은 ~10-6S/m의 낮은 전도도를 확인하였고 이는 기존의 도전재를 포함하는 슬러리의 전도도와 비교할 때 현저히 떨어지는 수치라고 볼 수 있다.
4. 결 론
본 연구진은 유/무기 하이브리드 페로브스카이트의 리튬 이온 저장 물질로서의 활용에 있어서 가장 큰 문제로 거론되는 구조적/전기화학적 안정성을 단결정 페로브스카이트와 첨가제 프리 (additive-free) 플랫폼을 통해 음극물질 로서의 리튬 저장에 있어 lithiated phase와 전환반응의 비가역 손실이 용량 및 사이클 안정성을 저해하는 전체 반응의 제한 요소임을 증명하였다. 이를 토대로 리튬염과 유기용매 선택의 최적화는 MAPbBr3를 활물질로 사용하는 리튬 이온 배터리의 사이클에 따른 구조적 안정성 개선을 위해 필요함을 구체화하는 예를 제시해주었다.