1. ņä£ ļĪĀ
ļéśļģĖĻĄ¼ņĪ░ļŖö ļäōņØĆ ļ╣äĒæ£ļ®┤ņĀüĻ│╝ ņ¢æņ×É Ēü¼ĻĖ░ ĒÜ©Ļ│╝ļĪ£ ņØĖĒĢ┤ ļÅģĒŖ╣ĒĢ£ ņĀäņ×ÉņĀü, Ļ┤æĒĢÖņĀü, ņ×ÉĻĖ░ņĀü, ĻĖ░Ļ│äņĀü ĒŖ╣ņä▒ņØä ļéśĒāĆļéĖļŗż. ĒŖ╣Ē׳. ĻĖłņåŹ ņé░ĒÖöļ¼╝ ļéśļģĖĻĄ¼ņĪ░ļŖö ĒÖöĒĢÖ ņä╝ņä£, ļ░öņØ┤ņśż ņä╝ņä£, Ēā£ņ¢æņĀäņ¦Ć, ļĀłņØ┤ņĀĆ, ĒŖĖļ×£ņ¦ĆņŖżĒä░, ņ┤ēļ¦ż, ļ░░Ēä░ļ”¼, ņŚÉļäłņ¦Ć ļ│ĆĒÖśņåīņ×É, ļ®öļ¬©ļ”¼ ņåīņ×ÉņÖĆ ļģ╝ļ”¼ĒÜīļĪ£ ņåīņ×Éļź╝ ĒżĒĢ©ĒĢśļŖö ļŗżņ¢æĒĢ£ ļČäņĢ╝ņŚÉņä£ ĒÖ£ņÜ®ņØ┤ Ļ░ĆļŖźĒĢśļŗż. ļéśļģĖĻĄ¼ņĪ░ ņżæņŚÉņä£ļÅä ļéśļģĖņäĀ, ļéśļģĖļ¦ēļīĆ, ļéśļģĖļ▓©ĒŖĖ, ļéśļģĖĒŖ£ļĖīņÖĆ Ļ░ÖņØĆ ņØ╝ņ░©ņøÉ ļéśļģĖĻĄ¼ņĪ░ļŖö ļåÆņØĆ ļ░£Ļ┤æ ĒÜ©ņ£©ļĪ£ ņØĖĒĢ┤ ļ░£Ļ┤æ ļŗżņØ┤ņśżļō£, ņłśĻ┤æ ļŗżņØ┤ņśżļō£, ļĀłņØ┤ņĀĆ, ĒÖ£ņä▒ ļÅäĒīīļĪ£, ņĀäĻĖ░-Ļ┤æĒĢÖ ļ│ĆņĪ░ ņåīņ×ÉņÖĆ Ļ░ÖņØĆ ļéśļģĖ Ļ┤æĒĢÖņåīņ×Éļź╝ ņ£äĒĢ£ ĻĖ░ļ│Ė ĻĄ¼ņä▒ ņÜöņåīĻ░Ć ļÉśĻĖ░ ļĢīļ¼ĖņŚÉ ļ¦ÄņØĆ Ļ┤Ćņŗ¼ņØä ļ░øĻ│Ā ņ׳ļŗż[1-5].
ĒĢ£ĒÄĖ, MgOļŖö ļäōņØĆ ņŚÉļäłņ¦Ć ļ░┤ļō£Ļ░Ł, Ļ│Āņ£ĄņĀÉ, ņÜ░ņłśĒĢ£ ļé┤ĒÖöĒĢÖņä▒, ļåÆņØĆ ņØ┤ņ░©ņĀäņ×É ļ░®ņČ£Ļ│äņłś, ļåÆņØĆ ņŚ┤ņĀü ņĢłņĀĢņä▒, Ļ│ĀņŚ┤ņĀäļÅäņä▒, ļ¼┤ļÅģņä▒ ļō▒ņØś ļø░ņ¢┤ļé£ ĒŖ╣ņä▒ļōż ļĢīļ¼ĖņŚÉ ņ┤ēļ¦ż, Ļ░ĆņŖż ņä╝ņä£, ņ┤łņĀäļÅäņ▓┤, ņĀäņ×É ņåīņ×É, ņĀäļĀź ĻĖ░ĻĖ░, ņłśņ¦ł ņĀĢĒÖö, ņāØļ¼╝ņØśĒĢÖņØä ĒżĒĢ©ĒĢśļŖö ļŗżņ¢æĒĢ£ ļČäņĢ╝ņŚÉ ņØæņÜ®ņØ┤ ĻĖ░ļīĆļÉśļŖö ņżæņÜöĒĢ£ ņé░ĒÖöļ¼╝ņØ┤ļŗż. ņØ╝ņ░©ņøÉ ļéśļģĖĻĄ¼ņĪ░ņØĖ MgO ļéśļģĖņäĀņØĆ ļäōņØĆ ļ╣äĒæ£ļ®┤ņĀüņØä ĻĖ░ļ░śņ£╝ļĪ£ ņ┤ēļ¦ż, ņä╝ņä£, ļ░░Ēä░ļ”¼ņØś ĒÜ©ņ£© ļ®┤ņŚÉņä£ ļ¦żņÜ░ ņÜ░ņłśĒĢ£ ĒŖ╣ņä▒ņØä ļ│┤ņØĖļŗż[6,7].
ņ¦ĆĻĖłĻ╣īņ¦Ć ĻĖłņåŹ ņé░ĒÖöļ¼╝ ļéśļģĖņäĀņØä ĒĢ®ņä▒ĒĢśĻĖ░ ņ£äĒĢ┤ ļ¦ÄņØĆ ļ░®ļ▓ĢņØ┤ Ļ░£ļ░£ļÉśĻ│Ā ņ׳ņ£╝ļéś, ņøÉļŻī ļČäļ¦ÉņØä Ļ│Āņś©ņŚÉņä£ ĻĖ░ĒÖöņŗ£ņ╝£ ļéśļģĖĻĄ¼ņĪ░ļź╝ ĒĢ®ņä▒ĒĢśļŖö ņŚ┤ņ”Øļ░£ļ▓ĢņØ┤ Ļ│ĄņĀĢņØ┤ Ļ░äļŗ©ĒĢśĻ│Ā ļ╣äņÜ®ņØ┤ ņĀĆļĀ┤ĒĢśļŗżļŖö ņןņĀÉņØ┤ ņ׳ļŗż. MgO ļéśļģĖņäĀļÅä ņŚ┤ņ”Øļ░£ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒĢ®ņä▒ļÉśĻ│Ā ņ׳ļŗż[8-10]. ņŚ┤ņ”Øļ░£ Ļ│ĄņĀĢņØĆ ņä▒ņן ņŗ£ņŖżĒģ£ ļé┤ņØś ņé░ņåī ļåŹļÅäņŚÉ ļ¦żņÜ░ ļ»╝Ļ░ÉĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ĒĢ®ņä▒ Ļ│ĄņĀĢ ņżæņØś ņé░ņåī ļåŹļÅäļŖö ĻĖłņåŹ ņé░ĒÖöļ¼╝ ļéśļģĖņäĀņØś ņä▒ņןņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣£ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ĻĖłņåŹ ņé░ĒÖöļ¼╝ ļéśļģĖņäĀņØä ĒĢ®ņä▒ĒĢśļŖö ņŚ┤ņ”Øļ░£ļ▓ĢņŚÉņä£ļŖö ņé░ņåīļź╝ Ar ļśÉļŖö N2 ļō▒ņØś ņÜ┤ļ░śĻ░ĆņŖżņŚÉ ļ»Ėļ¤ēņ£╝ļĪ£ ĒĢ©ņ£Āņŗ£ņ╝£ ņä▒ņן ņŗ£ņŖżĒģ£ņŚÉ Ļ│ĄĻĖēĒĢśĻ│Ā ņ׳ļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ ņä▒ņן ņĪ░Ļ▒┤ņØä ĒÖĢņןĒĢśņŚ¼ ņé░ņåī ļåŹļÅäĻ░Ć ļåÆņØĆ ņĪ░Ļ▒┤ņŚÉņä£ MgO ļéśļģĖņäĀņØś ņä▒ņןņŚÉ ļīĆĒĢ£ ņé░ņåī ļåŹļÅäņØś ņśüĒ¢źņØä ņĢīņĢäļ│┤ļŖö Ļ▓āļÅä ĒĢäņÜöĒĢśļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ņé░ņåī ļåŹļÅäĻ░Ć ļåÆņØĆ ņĪ░Ļ▒┤ņŚÉņä£ ņŚ┤ņ”Øļ░£ļ▓ĢņØä ņØ┤ņÜ®ĒĢ£ MgO ļéśļģĖņäĀņØś ņä▒ņןĻ│╝ ļ░£Ļ┤æ ĒŖ╣ņä▒ņŚÉ ļ»Ėņ╣śļŖö ņé░ņåī ļåŹļÅäņØś ņśüĒ¢źņØä ņĢīņĢäļ│┤ļŖö Ļ▓āņØä ļ¬®ņĀüņ£╝ļĪ£ ĒĢ£ļŗż.
2. ņŗżĒŚś ļ░®ļ▓Ģ
ņøÉļŻī ļČäļ¦ÉļĪ£ Mg ļČäļ¦ÉĻ│╝ SnO ļČäļ¦ÉņØä ņ¦łļ¤ēļ╣ä 3:1ļĪ£ Ēś╝ĒĢ®ĒĢ£ ļČäļ¦ÉņØä ņé¼ņÜ®ĒĢśņśĆļŗż. Mg ļČäļ¦ÉĻ│╝ SnO ļČäļ¦ÉņØä ļ│╝ļ░Ć ņןņ╣śņŚÉ ļäŻĻ│Ā 10ņŗ£Ļ░ä ļÅÖņĢł ĻĘĀņØ╝ĒĢśĻ▓ī Ēś╝ĒĢ®ĒĢśņśĆļŗż. ņŚ┤ņ”Øļ░£ļ▓ĢņØä ņØ┤ņÜ®ĒĢ£ MgO ļéśļģĖņäĀņØś ĒĢ®ņä▒ņØĆ ĒŖ£ļĖīĒśĢ ņĀäĻĖ░ļĪ£ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņłśĒ¢ēĒĢśņśĆļŗż. ņÜ░ņäĀ, Ēś╝ĒĢ® ļČäļ¦ÉņØä ņøÉļŻīļĪ£ ņé¼ņÜ®ĒĢĀ Ļ▓ĮņÜ░ņŚÉ MgO ļéśļģĖņäĀņØ┤ ņä▒ņןĒĢĀ ņłś ņ׳ļŖöņ¦Ćļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ ļīĆĻĖ░ņĢĢ Ļ│ĄĻĖ░ ļČäņ£äĻĖ░ņØś ņĀäĻĖ░ļĪ£ņŚÉ ļäŻĻ│Ā 1000 ┬░CņŚÉņä£ ņŗżĒŚśņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. ņŗżĒŚś Ļ▓░Ļ│╝ļź╝ ĻĘĖļ”╝ 1Ļ│╝ 2ņŚÉ ļéśĒāĆļé┤ņŚłļŗż. ĻĘĖļ”╝ 1(a)ņØĆ Mg ļČäļ¦Éļ¦īņØä ņøÉļŻīļĪ£ ņé¼ņÜ®ĒĢśņŚ¼ ņāØņä▒ļÉ£ MgO Ļ▓░ņĀĢņØś SEM ņØ┤ļ»Ėņ¦ĆļĪ£ ņ×ģļ░®ņ▓┤ ĒśĢņāüņØä ļ│┤ņØĖļŗż. ĻĘĖļ”╝ 1(b)ņØĆ MgņÖĆ SnOļź╝ Ēś╝ĒĢ®ĒĢ£ ļČäļ¦ÉņØä ņé¼ņÜ®ĒĢśņŚ¼ ņāØņä▒ļÉ£ MgOņØś SEM ņØ┤ļ»Ėņ¦ĆļĪ£ MgO ļéśļģĖņäĀņØ┤ ņä▒ņןĒĢśņśĆņØīņØä ņĢī ņłś ņ׳ļŗż. ĻĘĖļ”╝ 2ļŖö MgO ļéśļģĖņäĀņØ┤ ņāØņä▒ļÉ£ ļČĆļČäņØś EDSņÖĆ CL ņŖżĒÄÖĒŖĖļ¤╝ņØä ļéśĒāĆļéĖ Ļ▓āņ£╝ļĪ£ ļéśļģĖņäĀņØä ĻĄ¼ņä▒ĒĢśļŖö ņŻ╝ņÜö ņøÉņåīļōżņØ┤ MgņÖĆ Oņ×äņØä ņĢī ņłś ņ׳Ļ│Ā, ~400 nmņŚÉņä£ ņżæņŗ¼ ĒīīņןņØä Ļ░Ćņ¦ä ļ░£Ļ┤æ ĒŖ╣ņä▒ņØä ļéśĒāĆļé┤Ļ│Ā ņ׳ļŗż. Ēś╝ĒĢ® ļČäļ¦ÉņØä ņŚ┤ņ”Øļ░£ņŗ£ņ╝£ MgO ļéśļģĖņäĀņØś ņä▒ņןņØ┤ Ļ░ĆļŖźĒĢśņśĆĻĖ░ ļĢīļ¼ĖņŚÉ ļ│Ė ņŚ░ĻĄ¼ļź╝ ņ£äĒĢ£ ņøÉļŻī ļČäļ¦ÉļĪ£ MgņÖĆ SnOņØś Ēś╝ĒĢ® ļČäļ¦ÉņØä ņé¼ņÜ®ĒĢśņśĆļŗż.
ņøÉļŻī ļČäļ¦ÉņØä ņĢīļŻ©ļ»Ėļéś ļÅäĻ░ĆļŗłņŚÉ ņןņ×ģĒĢśņŚ¼ ņäØņśü ĒŖ£ļĖīļź╝ ņé¼ņÜ®ĒĢśļŖö ĒŖ£ļĖīĒśĢ ņĀäĻĖ░ļĪ£ņØś ņżæņĢÖņŚÉ ļåōņĢśļŗż. ļĪ£Ēä░ļ”¼ ĒÄīĒöäļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņäØņśü ĒŖ£ļĖī ļé┤ņØś ņ¦äĻ│ĄļÅäĻ░Ć ~5├Ś10-2TorrĻ░Ć ļÉĀ ļĢīĻ╣īņ¦Ć ļ░░ĻĖ░ĒĢśņśĆļŗż. ļŗżņØī ņł£ņä£ļĪ£ ņé░ņåīņÖĆ ņ¦łņåīļź╝ Ēś╝ĒĢ®ĒĢśņŚ¼ ņäØņśü ĒŖ£ļĖī ļé┤ņØś ņĢĢļĀźņØ┤ 500 TorrĻ░Ć ļÉĀ ļĢīĻ╣īņ¦Ć ņŻ╝ņ×ģĒĢśņśĆļŗż. ĻĘĖļŗżņØī, ņś©ļÅäļź╝ 1000 ┬░CĻ╣īņ¦Ć ņś¼ļ”¼Ļ│Ā 1ņŗ£Ļ░ä ņ£Āņ¦ĆĒĢ£ Ēøä ņŗżņś©Ļ╣īņ¦Ć ļāēĻ░üĒĢśņśĆļŗż. ņé░ņåī ļåŹļÅäņØś ņśüĒ¢źņØä ņé┤ĒÄ┤ļ│┤ĻĖ░ ņ£äĒĢśņŚ¼ ņ¦łņåīņÖĆ ņé░ņåīņØś ļČĆĒö╝ļ╣äļź╝ 100:0, 75:25, 50:50, 25:75, 0:100ņ£╝ļĪ£ ļ│ĆĒÖöņŗ£ņ╝£ ņŗżĒŚśņØä ņłśĒ¢ēĒĢśņśĆļŗż.
ņāØņä▒ļ¼╝ņØś ĒśĢņāüņØĆ ņ£ĄĒĢ®ļČĆĒÆłņåīņ×¼ ĒĢĄņŗ¼ņŚ░ĻĄ¼ņ¦ĆņøÉņä╝Ēä░ ņןļ╣äņØĖ ņŻ╝ņé¼ņĀäņ×ÉĒśäļ»ĖĻ▓Į(SEM, JEOL, JSM-IT800)ņØä ņé¼ņÜ®ĒĢśņŚ¼ Ļ┤Ćņ░░ĒĢśņśĆĻ│Ā, ĻĄ¼ņä▒ ņä▒ļČäņØä ļČäņäØĒĢśĻĖ░ ņ£äĒĢ┤ ņŚÉļäłņ¦Ć ļČäņé░ĒśĢ XņäĀ ļČäĻ┤æļČäņäØĻĖ░(EDS, Oxford, Ultim Max 100)ļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. ņāØņä▒ļ¼╝ņØś Ļ▓░ņĀĢ ĻĄ¼ņĪ░ļź╝ ļČäņäØĒĢśĻĖ░ ņ£äĒĢ┤ņä£ X-ņäĀ ĒÜīņĀłļČäņäØĻĖ░(XRD, PANalytical, X'pert PRO MPD, Cu-K╬▒ radiation, ╬╗=1.5406├ģ)ļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż. ļśÉĒĢ£ ļ░£Ļ┤æ ĒŖ╣ņä▒ņØĆ ņØīĻĘ╣ņäĀ ļ░£Ļ┤æ ļČäĻ┤æļČäņäØĻĖ░(CL, Mon┬░CL4, Gatan)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ļČäņäØĒĢśņśĆļŗż.
3. Ļ▓░Ļ│╝ ļ░Å Ļ│Āņ░░
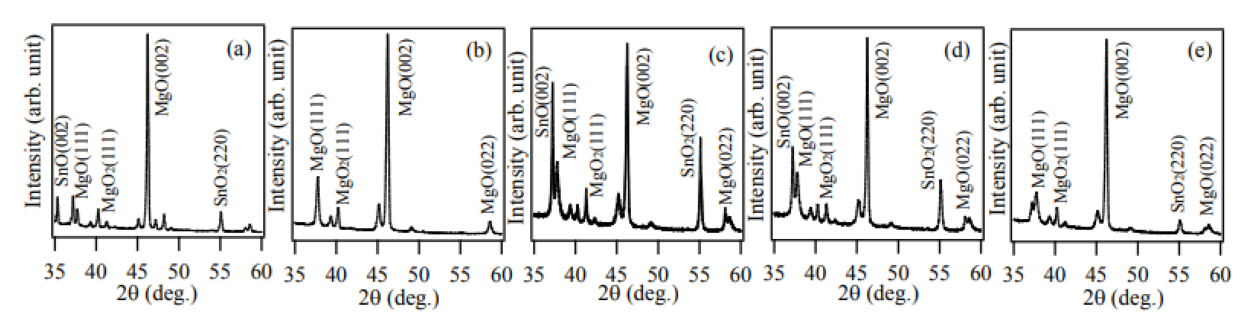
ĻĘĖļ”╝ 3ņØĆ ņøÉļŻī ļČäļ¦ÉņØä ņ¦łņåīņÖĆ ņé░ņåīņØś ļČĆĒö╝ļ╣äĻ░Ć ļŗżļźĖ ņĪ░Ļ▒┤ņŚÉņä£ 1000┬░C, 1ņŗ£Ļ░ä ļÅÖņĢł ņŚ┤ņ▓śļ”¼ Ļ│ĄņĀĢņØä ņ¦äĒ¢ēĒĢśņŚ¼ ņāØņä▒ļÉ£ ņŗ£ļŻīņØś XRD ĒÜīņĀł Ēī©Ēä┤ņØ┤ļŗż. ļ¬©ļōĀ ņŗ£ļŻīņŚÉņä£ (002) Ļ▓░ņĀĢļ®┤ņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö ĒÜīņĀł Ēö╝Ēü¼Ļ░Ć ņ¦Ćļ░░ņĀüņØĖ ņ×ģļ░®ņĀĢ Ļ▓░ņĀĢ ĻĄ¼ņĪ░ļź╝ Ļ░Ćņ¦ä MgO ĒÜīņĀł Ēī©Ēä┤ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. MgņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö ĒÜīņĀł Ēö╝Ēü¼ļŖö Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņŚ┤ņ▓śļ”¼ļź╝ ĒåĄĒĢśņŚ¼ ņøÉļŻī ļČäļ¦É ļé┤ņØś MgļŖö ņÖäņĀäĒ׳ ņé░ĒÖöļÉśņŚłņØīņØä ņĢī ņłś ņ׳ļŗż.
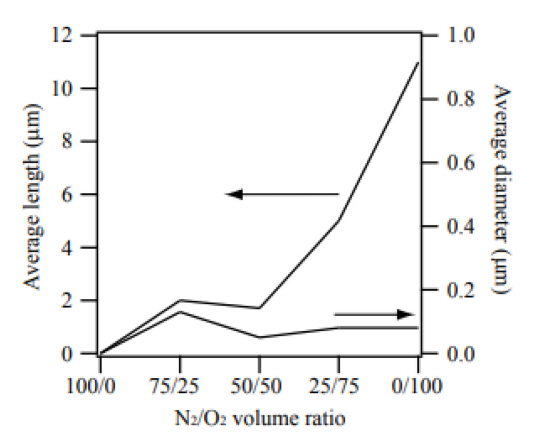
ĻĘĖļ”╝ 4ņŚÉ ņøÉļŻī ļČäļ¦ÉņØä ņ¦łņåīņÖĆ ņé░ņåīņØś ļČĆĒö╝ļ╣äĻ░Ć ļŗżļźĖ ņĪ░Ļ▒┤ņŚÉņä£ 1000┬░C, 1ņŗ£Ļ░ä ļÅÖņĢł ņŚ┤ņ▓śļ”¼ Ļ│ĄņĀĢņØä ņ¦äĒ¢ēĒĢśņŚ¼ ņāØņä▒ļÉ£ ņāØņä▒ļ¼╝ņØś SEM ņØ┤ļ»Ėņ¦Ćļź╝ ļéśĒāĆļé┤ņŚłļŗż. N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 100/0ņØĖ ņĪ░Ļ▒┤ņŚÉņä£ļŖö ļéśļģĖņäĀņØ┤ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. XRD ļČäņäØņŚÉņä£ N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 100/0ņØĖ ņĪ░Ļ▒┤ņŚÉņä£ļÅä ļ░śņØæ ĒŖ£ļĖī ļé┤ņØś ņ×öļźś ņé░ņåīņŚÉ ņØśĒĢ┤ MgOĻ░Ć ĒśĢņä▒ļÉśņŚłņØīņØä ņĢī ņłś ņ׳ņ£╝ļéś ļéśļģĖņäĀņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 75/25 ņĪ░Ļ▒┤ļČĆĒä░ ļéśļģĖņäĀņØś ņä▒ņןņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ļéśļģĖņäĀņØś ĒÅēĻĘĀ ņ¦üĻ▓ĮņØĆ 130 nmļź╝ ļéśĒāĆļé┤ņŚłĻ│Ā ĒÅēĻĘĀ ĻĖĖņØ┤ļŖö 2.0 ╬╝mļź╝ ļéśĒāĆļé┤ņŚłļŗż. N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 50/50ņØĖ ņĪ░Ļ▒┤ņŚÉņä£ļŖö ļéśļģĖņäĀņØś ĒÅēĻĘĀ ņ¦üĻ▓ĮĻ│╝ ĻĖĖņØ┤ļŖö Ļ░üĻ░ü 50 nmņÖĆ 1.7 ╬╝mļĪ£ N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 75/25 ņĪ░Ļ▒┤ņŚÉņä£ ņāØņä▒ļÉ£ ļéśļģĖņäĀļ│┤ļŗż ĒÅēĻĘĀ ņ¦üĻ▓ĮņØ┤ Ēü¼Ļ▓ī Ļ░ÉņåīĒĢśņśĆļŗż. N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 25/75, 0/100ņ£╝ļĪ£ ļČäņ£äĻĖ░ Ļ░ĆņŖż ļé┤ņØś ņé░ņåī ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ ļéśļģĖņäĀņØś ļ░ĆļÅäņÖĆ ļŹöļČłņ¢┤ ĒÅēĻĘĀ ņ¦üĻ▓ĮĻ│╝ ĻĖĖņØ┤ļÅä ļŗżņŗ£ ņ”ØĻ░ĆĒĢśņśĆļŗż. ņé░ņåī ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ ļéśļģĖņäĀņØś ļ░ĆļÅäĻ░Ć ņ”ØĻ░ĆĒĢ£ Ļ▓āņØĆ ņé░ņåīņÖĆ ļ░śņØæĒĢśņŚ¼ ņāØņä▒ļÉ£ MgOņØś Ļ│╝ĒżĒÖöļÅäĻ░Ć ņ”ØĻ░ĆĒĢśļ®┤ņä£ MgO Ļ▓░ņĀĢĒĢĄņØ┤ ļ¦ÄņØ┤ ņāØņä▒ļÉśņŚłĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ņČöļĪĀļÉ£ļŗż. N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 50/50ņ£╝ļĪ£ļČĆĒä░ 25/75, 0/100ņ£╝ļĪ£ ļ│ĆĒĢĀņłśļĪØ ļéśļģĖņäĀņØś ĒÅēĻĘĀ ņ¦üĻ▓ĮņØĆ 50 nmņŚÉņä£ 80 nm, 80 nmļĪ£, ĒÅēĻĘĀ ĻĖĖņØ┤ļŖö 1.7 ╬╝mņŚÉņä£ 5.0 ╬╝m, 11.0 ╬╝mļĪ£ ņ”ØĻ░ĆĒĢśņśĆļŗż.
ĒĢ£ĒÄĖ, SEM ņØ┤ļ»Ėņ¦Ć ļČäņäØņ£╝ļĪ£ļČĆĒä░ N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 75/25ņØĖ ņĪ░Ļ▒┤ņŚÉņä£ ņä▒ņןĒĢ£ ļéśļģĖņäĀņØś ņśåļ®┤ņØä ĻĄ¼ņä▒ĒĢśļŖö Ēæ£ļ®┤ņØĆ Ļ▒░ņ╣Āņ¦Ćļ¦ī 50/50 ņØ┤ņāüņØś ņĪ░Ļ▒┤ņŚÉņä£ ņä▒ņןĒĢ£ ļéśļģĖņäĀ ņśåļ®┤ņØś Ēæ£ļ®┤ņØĆ ļ¦żņÜ░ ļ¦żļüäļ¤ĮļŗżļŖö ņé¼ņŗżņØä ņĢī ņłś ņ׳ņŚłļŗż. ņØ┤ļĪ£ļČĆĒä░ N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 75/25ņØĖ ņĪ░Ļ▒┤Ļ│╝ 50/50 ņØ┤ņāüņØś ņĪ░Ļ▒┤ņŚÉņä£ņØś ļéśļģĖņäĀņØś ņä▒ņןņŚÉ ņ░©ņØ┤Ļ░Ć ņ׳ļŗżļŖö ņČöņĖĪņØä ĒĢĀ ņłś ņ׳ļŗż. ņé░ņåī ļåŹļÅäĻ░Ć ļé«ņØĆ N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 75/25ņØĖ ņĪ░Ļ▒┤ņŚÉņä£ļŖö MgņØś Ļ▓░ņĀĢĒĢĄ ļśÉļŖö O ņøÉņ×ÉņŚÉ ļīĆĒĢ£ MgņØś ņøÉņ×Éļ╣äĻ░Ć ļåÆņØĆ MgOx(x<1)ņØś Ļ▓░ņĀĢĒĢĄņØ┤ ņÜ░ņäĀ ņāØņä▒ļÉĀ Ļ▓āņØ┤ļŗż. Mg Ļ▓░ņĀĢņØĆ ņ£Īļ░®ņĀĢĻ│ä Ļ▓░ņĀĢ ĻĄ¼ņĪ░ļź╝ Ļ░Ćņ¦äļŗż. ņ£Īļ░®ņĀĢĻ│ä Ļ▓░ņĀĢĻĄ¼ņĪ░ņŚÉņä£ļŖö {0001} ļ®┤ņØ┤ ĻĖ░ņĀĆļ®┤ņØ┤Ļ│Ā {101 ┬» 1 ┬» 1 ┬» 1 ┬»
N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 50/50 ņØ┤ņāüņØś ņĪ░Ļ▒┤ņŚÉņä£ļŖö ļ®┤ņŗ¼ņ×ģļ░®ņĀĢĻ│ä Ļ▓░ņĀĢĻĄ¼ņĪ░ļź╝ Ļ░Ćņ¦ä MgO Ļ▓░ņĀĢĒĢĄņØ┤ ņāØņä▒ļÉśĻ│Ā ļéśļģĖņäĀņØś ņÜ░ņäĀ ņä▒ņן ļ░®Ē¢źņØĖ [001] ļ░®Ē¢źņ£╝ļĪ£ņØś ņä▒ņן ņåŹļÅäĻ░Ć ļ╣Āļź┤Ļ│Ā, ņśåļ®┤ ļ░®Ē¢źņ£╝ļĪ£ņØś ņä▒ņןņØĆ Ļ▒░ņØś ņØ╝ņ¢┤ļéśņ¦Ć ņĢŖĻĖ░ ļĢīļ¼ĖņŚÉ ļéśļģĖņäĀņØś ņ¦üĻ▓ĮņŚÉ Ēü░ ļ│ĆĒÖöĻ░Ć ņŚåņ£╝ļ®░ ņśåļ®┤ļÅä ļ¦żļüäļ¤¼ņÜ┤ Ēæ£ļ®┤ņØä ļéśĒāĆļéĖļŗż. ļČäņ£äĻĖ░ Ļ░ĆņŖż ļé┤ņØś ņé░ņåī ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ ļéśļģĖņäĀņØś ņ¦üĻ▓ĮņŚÉļŖö Ēü░ ļ│ĆĒÖöĻ░Ć ņŚåņŚłņ£╝ļéś ĻĖĖņØ┤ļŖö Ēü¼Ļ▓ī ļ│ĆĒĢśņśĆļŗż. ņ¦üĻ▓ĮņŚÉ ļ╣äĒĢśņŚ¼ ĻĖĖņØ┤ ļ│ĆĒÖöĻ░Ć Ēü¼ĻĖ░ ļĢīļ¼ĖņŚÉ ņé░ņåī ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ ļéśļģĖņäĀņØś ņóģĒÜĪļ╣ä(aspect ratio)Ļ░Ć Ēü¼Ļ▓ī ņ”ØĻ░ĆĒĢśņśĆņØīņØä ņĢī ņłś ņ׳ņŚłļŗż. N2/O2 ļČĆĒö╝ļ╣äņŚÉ ļö░ļźĖ ļéśļģĖņäĀņØś ņ¦üĻ▓ĮĻ│╝ ĻĖĖņØ┤ ļ│ĆĒÖöļź╝ ĻĘĖļ”╝ 5ņŚÉ ļéśĒāĆļé┤ņŚłļŗż.
ĻĖ░ņ▓┤ņāüņØä ņØ┤ņÜ®ĒĢ£ ļéśļģĖņäĀņØś ņä▒ņן ļ®öņ╗żļŗłņ”śņŚÉļŖö ĻĖ░ņāü-ņĢĪņāü-Ļ│Āņāü(VLS: vapor-liquid-solid) ļ®öņ╗żļŗłņ”śĻ│╝ ĻĖ░ņāü-Ļ│Āņāü(VS: vapor-solid) ļ®öņ╗żļŗłņ”śņØ┤ ņ׳ļŗż. VLS ļ®öņ╗żļŗłņ”śņŚÉ ņØśĒĢ£ ļéśļģĖņäĀņØś ņä▒ņןņŚÉļŖö ņä▒ņן ļ¼╝ņ¦łņØä ņÜ®ĒĢ┤ĒĢĀ ņłś ņ׳ņ£╝ļ®░, ļéśļģĖņäĀņØś ņä▒ņן ņś©ļÅäņŚÉņä£ ņĢĪņāü ļ░®ņÜĖņØä ĒśĢņä▒ĒĢĀ ņłś ņ׳ļŖö ņ┤ēļ¦żĻ░Ć ĒĢäņÜöĒĢśļŗż. ļ░śļ®┤ņŚÉ VS ļ®öņ╗żļŗłņ”śņŚÉ ņØśĒĢ£ ļéśļģĖņäĀņØś ņä▒ņןņŚÉļŖö ņ┤ēļ¦żĻ░Ć ĒĢäņÜö ņŚåļŗż. ĻĘĖļלņä£ ņØ╝ļ░śņĀüņ£╝ļĪ£ VLS ļ®öņ╗żļŗłņ”śņŚÉ ņØśĒĢ┤ ņä▒ņןĒĢ£ ļéśļģĖņäĀņØś ļüØļČĆļČäņŚÉļŖö ĻĄ¼ĒśĢņØś ņ┤ēļ¦żĻ░Ć Ļ┤Ćņ░░ļÉ£ļŗż[12,13]. ĻĘĖļ¤¼ļéś ļ│Ė ņŗżĒŚśņŚÉņä£ ņä▒ņןĒĢ£ ļéśļģĖņäĀņŚÉņä£ļŖö ļüØļČĆļČäņŚÉņä£ ĻĄ¼ĒśĢņØś ņ┤ēļ¦żĻ░Ć Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśĻĖ░ ļĢīļ¼ĖņŚÉ VS ļ®öņ╗żļŗłņ”śņŚÉ ņØśĒĢ┤ ļéśļģĖņäĀņØ┤ ņä▒ņןĒĢśņśĆļŗżĻ│Ā ĒīÉļŗ©ļÉ£ļŗż.
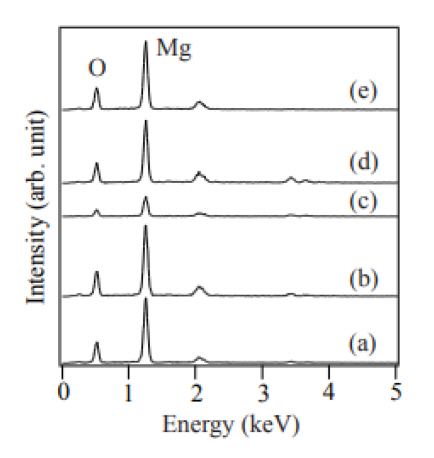
ĻĘĖļ”╝ 6ņŚÉļŖö ļéśļģĖņäĀļōżņØś ņä▒ļČäņØä ļČäņäØĒĢ£ EDS ņŖżĒÄÖĒŖĖļ¤╝ņØä ļéśĒāĆļé┤ņŚłļŗż. ļéśļģĖņäĀļōżņØĆ MgņÖĆ O ņøÉņåīļĪ£ ĻĄ¼ņä▒ļÉ£ MgOņ×äņØä ņĢī ņłś ņ׳ņŚłļŗż.
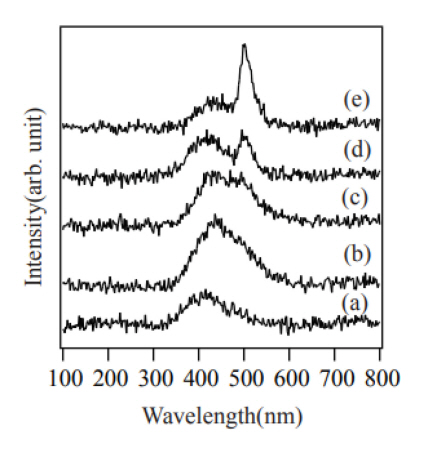
ĻĘĖļ”╝ 7ņØĆ ļéśļģĖņäĀņØś ņØīĻĘ╣ņäĀ ļ░£Ļ┤æ ĒŖ╣ņä▒ņØä ļéśĒāĆļéĖ CL ņŖżĒÄÖĒŖĖļ¤╝ņØ┤ļŗż. ~400 nmņØś ņżæņŗ¼ ĒīīņןņØä Ļ░Ćņ¦Ćļ®░ ĒÅŁņØ┤ ļäōņØĆ ļ░£Ļ┤æ Ēö╝Ēü¼ņÖĆ ņżæņŗ¼ ĒīīņןņØ┤ ~500 nmņØ┤ļ®░ ĒÅŁņØ┤ ņóüņØĆ ļ░£Ļ┤æ Ēö╝Ēü¼Ļ░Ć Ļ┤Ćņ░░ļÉśņŚłļŗż. N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 100/0 ņĪ░Ļ▒┤ņŚÉņä£ļŖö ļéśļģĖņäĀņØĆ ĒśĢņä▒ļÉśņ¦Ć ņĢŖņĢśņ¦Ćļ¦ī ~400 nmņØś ļ░£Ļ┤æ Ēö╝Ēü¼Ļ░Ć Ļ┤Ćņ░░ļÉśņŚłļŗż. MgO Ļ▓░ņĀĢņØś ļ░£Ļ┤æņŚÉņä£ ~400 nmņØś ļ░£Ļ┤æ Ēö╝Ēü¼ļŖö positively charged oxygen vacancy(F+-center)ņŚÉņä£ ĻĖ░ņØĖĒĢśļ®░, ~500 nmņØś ļ░£Ļ┤æ Ēö╝Ēü¼ļŖö neutral oxygen vacancy(F-center)ņŚÉņä£ ĻĖ░ņØĖĒĢ£ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[14]. ņé░ņåī ļåŹļÅäĻ░Ć ļé«ņØĆ ņĪ░Ļ▒┤ņŚÉņä£ļŖö ~400 nmņØś ļ░£Ļ┤æ Ēö╝Ēü¼ņØś Ļ░ĢļÅäĻ░Ć ļåÆņ£╝ļ®░, N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 75/25ņØĖ ņĪ░Ļ▒┤ņŚÉņä£ Ļ░Ćņן Ēü░ Ēö╝Ēü¼ Ļ░ĢļÅäļź╝ ļéśĒāĆļé┤ņŚłļŗż. N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 50/50ņØĖ ņĪ░Ļ▒┤ļČĆĒä░ ~500 nmņØś ļ░£Ļ┤æ Ēö╝Ēü¼Ļ░Ć Ļ┤Ćņ░░ļÉśĻĖ░ ņŗ£ņ×æĒĢśņśĆņ£╝ļ®░, N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 25/75, 0/100ņ£╝ļĪ£ ņé░ņåīņØś ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ ~400 nmņØś ļ░£Ļ┤æ Ēö╝Ēü¼ņØś Ļ░ĢļÅäļŖö Ļ░ÉņåīĒĢśļ®┤ņä£ ~500 nmņØś ļ░£Ļ┤æ Ēö╝Ēü¼ņØś Ļ░ĢļÅäļŖö Ēü¼Ļ▓ī ņ”ØĻ░ĆĒĢśņśĆļŗż. N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 0/100ņØĖ ņĪ░Ļ▒┤ņŚÉņä£ ~500 nmņØś ļ░£Ļ┤æ Ēö╝Ēü¼ļŖö Ļ░Ćņן Ēü░ ļ░£Ļ┤æ Ļ░ĢļÅäļź╝ ļéśĒāĆļé┤ņŚłļŗż. ĒŖ╣Ē׳ F-center Ļ▓░ĒĢ©ņŚÉņä£ ĻĖ░ņØĖĒĢ£ 500 nmņØś ļ░£Ļ┤æ Ēö╝Ēü¼ļŖö 25 nmņØś ļ¦żņÜ░ ņóüņØĆ ļ░śņ╣śĒÅŁņØä ļéśĒāĆļé┤ņŚłļŗż.
ņé░ĒÖöļ¼╝ņŚÉņä£ ņé░ņåī Ļ│ĄĻ│ĄņØĆ Ļ░Ćņן ņØ╝ļ░śņĀüņØĖ Ļ▓░ĒĢ©ņØ┤ļŗż. MgO Ļ▓░ņĀĢņŚÉņä£ļÅä ņé░ņåī Ļ│ĄĻ│ĄĻ│╝ Ļ┤ĆļĀ©ļÉ£ F+, F2+, F-centerĻ░Ć ņāØņä▒ļÉ£ļŗż. ņ×Éņ£ĀņĀäņ×ÉļōżņØĆ positively charged oxygen vacancyņØĖ F+ ļśÉļŖö F2+-centerļĪ£ ņØ┤ļÅÖĒĢśņŚ¼ ĻĘĖĻ││ņŚÉņä£ ņĀäņ×ÉņÖĆ ņĀĢĻ│ĄņØ┤ ņ×¼Ļ▓░ĒĢ®ĒĢ©ņ£╝ļĪ£ņŹ© ~400nmņØś ļ░£Ļ┤æ ņŖżĒÄÖĒŖĖļ¤╝ņØä ļéśĒāĆļé┤Ļ│Ā, ļ░śļīĆļĪ£ ņĀĢĻ│ĄļōżņØĆ ņ¢æņĀäĒĢśļź╝ ļØł F+-centerņÖĆņØś ņ▓ÖļĀźņŚÉ ņØśĒĢ┤ ļ░ĆļĀżļéś ņŻ╝ļĪ£ neutral oxygen vacancyņØĖ F-centerņŚÉņä£ ņ×Éņ£ĀņĀäņ×ÉņÖĆ ņ×¼Ļ▓░ĒĢ®ĒĢśņŚ¼ ~500 nmņØś ļ░£Ļ┤æ ņŖżĒÄÖĒŖĖļ¤╝ņØä ļéśĒāĆļéĖļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[15]. ļ│Ė ņŗżĒŚśņŚÉņä£ļÅä ņé░ņåī ļåŹļÅäĻ░Ć ļé«ņØĆ ņĪ░Ļ▒┤ņŚÉņä£ ņāØņä▒ļÉ£ MgOņŚÉņä£ļŖö ņé░ņåī Ļ│ĄĻ│Ąņ£╝ļĪ£ ņØĖĒĢ┤ ļ░£ņāØĒĢ£ ņ×Éņ£ĀņĀäņ×ÉļōżņØ┤ F+-centerņŚÉņä£ ņĀĢĻ│ĄļōżĻ│╝ ņ×¼Ļ▓░ĒĢ®ĒĢ©ņ£╝ļĪ£ņŹ© ~400 nmņØś ļ░£Ļ┤æ ņŖżĒÄÖĒŖĖļ¤╝ņØä ļéśĒāĆļéĖ Ļ▓āņ£╝ļĪ£ ņČöļĪĀļÉ£ļŗż. ĒĢ£ĒÄĖ, ņé░ņåī ļåŹļÅäĻ░Ć ļåÆņĢäņ¦łņłśļĪØ ~500nmņØś ļ░£Ļ┤æ ņŖżĒÄÖĒŖĖļ¤╝ņØ┤ ļéśĒāĆļéśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņĢä ņĀĢĻ│ĄņØ┤ ņāØņä▒ļÉśņ¢┤ F-centerņŚÉņä£ ņĀäņ×ÉņÖĆņØś ņ×¼Ļ▓░ĒĢ®ņØ┤ ņØ╝ņ¢┤ļé¼ļŗżĻ│Ā ņāØĻ░üļÉ£ļŗż. ņé░ņåī ļåŹļÅäĻ░Ć ļåÆņØäņłśļĪØ Ļ│╝ņ×ē ņé░ņåī Ļ│ĄĻĖēņŚÉ ņØśĒĢ┤ ņ╣©ņ×ģĒśĢ ņé░ņåī ņøÉņ×ÉĻ░Ć ļ░£ņāØĒĢśĻ│Ā, ņØ┤ņŚÉ ļö░ļØ╝ ņĀĢĻ│ĄņØ┤ ņāØņä▒ļÉśņ¢┤ F+-centerņŚÉņä£ļ│┤ļŗżļŖö F-ceneterņŚÉņä£ ņ×Éņ£ĀņĀäņ×ÉņÖĆ ņ×¼Ļ▓░ĒĢ®ĒĢśņŚ¼ ~500 nmņØś ļ░£Ļ┤æ ņŖżĒÄÖĒŖĖļ¤╝ņØ┤ ļéśĒāĆļé¼ļŗżĻ│Ā ņČöļĪĀļÉ£ļŗż. EDSļź╝ ņØ┤ņÜ®ĒĢ£ MgO ļéśļģĖņäĀņØś ņä▒ļČä ļČäņäØņŚÉņä£ Sn ņä▒ļČäņØ┤ Ļ▒░ņØś Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ļö░ļØ╝ņä£, Sn ļśÉļŖö SnO ņ×öļźśļ¼╝ņØ┤ MgO ļéśļģĖņäĀņØś ļ░£Ļ┤æ ĒŖ╣ņä▒ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖņĢśļŗżĻ│Ā ĒīÉļŗ©ļÉ£ļŗż.
4. Ļ▓░ ļĪĀ
ņŚ┤ņ”Øļ░£ļ▓Ģņ£╝ļĪ£ ņä▒ņןĒĢśļŖö MgO ļéśļģĖņäĀņØś ņä▒ņןĻ│╝ ņØīĻĘ╣ņäĀ ļ░£Ļ┤æ ĒŖ╣ņä▒ņŚÉ ļ»Ėņ╣śļŖö ņé░ņåī ļåŹļÅäņØś ņśüĒ¢źņØä ņĪ░ņé¼ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 100/0, 75/25, 50/50, 25/75, 0/100ņØĖ ļČäņ£äĻĖ░ Ļ░ĆņŖż ņĪ░Ļ▒┤ņŚÉņä£ ņŗżĒŚśņØä ņłśĒ¢ēĒĢśņśĆļŗż. N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 75/25ņØĖ ņĪ░Ļ▒┤ļČĆĒä░ MgO ļéśļģĖņäĀņØ┤ ņä▒ņןĒĢśņśĆļŗż. N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 75/25ņØĖ ņĪ░Ļ▒┤ņŚÉņä£ ņä▒ņןĒĢ£ ļéśļģĖņäĀņØĆ Ēü░ ņ¦üĻ▓ĮĻ│╝ Ļ▒░ņ╣£ ņśåļ®┤ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņŚłļŗż. N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 50/50 ņØ┤ņāüņØĖ ņĪ░Ļ▒┤ņŚÉņä£ ņä▒ņןĒĢ£ ļéśļģĖņäĀņØĆ ņ¦üĻ▓ĮņØĆ ņ×æĻ│Ā ņśåļ®┤ņØĆ ļ¦żļüäļĪ£ņÜ┤ Ēæ£ļ®┤ņØä ļéśĒāĆļé┤ņŚłļŗż. N2/O2 ļČĆĒö╝ļ╣äĻ░Ć 50/50ņ£╝ļĪ£ļČĆĒä░ 25/75, 0/100ņ£╝ļĪ£ ņé░ņåī ļåŹļÅäĻ░Ć ļŹöņÜ▒ ņ”ØĻ░ĆĒĢĀņłśļĪØ ļéśļģĖņäĀņØś ņ¦üĻ▓ĮņŚÉļŖö Ēü░ ļ│ĆĒÖöĻ░Ć ņŚåņŚłņ£╝ļéś ĻĖĖņØ┤ļŖö Ēü░ ļ│ĆĒÖöļź╝ ļ│┤ņØ┤ļ®┤ņä£ ļéśļģĖņäĀņØś ņóģĒÜĪļ╣äĻ░Ć Ēü¼Ļ▓ī ņ”ØĻ░ĆĒĢśņśĆļŗż. ņé░ņåī ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢśļ®┤ņä£ ļéśļģĖņäĀņØś ļ░ĆļÅäļÅä ņ”ØĻ░ĆĒĢśņśĆļŗż. MgO ļéśļģĖņäĀņØś ņØīĻĘ╣ņäĀ ļ░£Ļ┤æ ņŖżĒÄÖĒŖĖļ¤╝ņŚÉņä£ ņé░ņåī ļåŹļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ ~400 nmņØś ļ░£Ļ┤æ Ļ░ĢļÅäļŖö Ļ░ÉņåīĒĢśņśĆĻ│Ā, ~500 nmņØś ļ░£Ļ┤æ Ļ░ĢļÅäļŖö ņ”ØĻ░ĆĒĢśņśĆļŗż. ĒŖ╣Ē׳ ~400 nmņØś ļ░£Ļ┤æ ņŖżĒÄÖĒŖĖļ¤╝ņŚÉ ļ╣äĒĢ┤ ~500 nmņØś ļ░£Ļ┤æ ņŖżĒÄÖĒŖĖļ¤╝ņØś ļ░śņ╣śĒÅŁņØ┤ ņóüņĢśļŗż. ĒĢ®ņä▒ Ļ│ĄņĀĢ ņżæņØś ļČäņ£äĻĖ░ Ļ░ĆņŖż ļé┤ņØś ņé░ņåī ļåŹļÅäņŚÉ ļö░ļØ╝ņä£ MgO ļéśļģĖņäĀņŚÉņä£ 400 nm(ņ×ÉņŻ╝ņāē)ņÖĆ 500 nm(ņ▓ŁļĪØņāē) ĒīīņןņØś ļŗżņāē ļ░£Ļ┤æ ĒŖ╣ņä▒ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ĒĢśļéśņØś ĒśĢĻ┤æņ▓┤ņØĖ MgOļĪ£ļČĆĒä░ ņ×ÉņŻ╝ņāēĻ│╝ ņ▓ŁļĪØņāē ļ░£Ļ┤æņØä ļŗ©ļÅģņ£╝ļĪ£ ļśÉļŖö ļæÉ ļ░£Ļ┤æņØä ļÅÖņŗ£ņŚÉ ĻĄ¼ĒśäĒĢĀ ņłś ņ׳ņØä ļ┐É ņĢäļŗłļØ╝ ņé░ņåī ļåŹļÅäļź╝ ņĪ░ņĀłĒĢ©ņ£╝ļĪ£ņŹ© ņŚ¼ļ¤¼ ĒīīņןņØś Ēś╝ĒĢ®ņāēļÅä ĻĄ¼ĒśäĒĢĀ ņłś ņ׳ņ¢┤ ļŗżņ¢æĒĢ£ ņāēņØś ĻĄ¼ĒśäņØ┤ Ļ░ĆļŖźĒĢ£ ļ░£Ļ┤æ ņåīņ×É ļśÉļŖö ņāē ļ│ĆĒÖöļź╝ ņØ┤ņÜ®ĒĢ£ Ļ┤æĒĢÖ ņä╝ņŗ▒ ņåīņ×ÉļĪ£ņØś ņØæņÜ®ņØ┤ ĻĖ░ļīĆļÉ£ļŗż.